喹啉-2-甲酸锰配合物的合成、晶体结构与荧光性质的研究
陈 英,杨一泓,黄妙龄,叶梦月,陈 悦,游舒敏
(泉州师范学院 化工与材料学院,福建 泉州362000)
荧光材料是一种典型的发光材料。作为光致发光材料的一种,荧光材料由于其独特的性质受到了研究者的青睐。自二十世纪初以来,有机荧光材料被广泛用于纺织、塑料着色及印刷颜料等[1]。喹啉及喹啉衍生物,因为有大的 -共轭体系和强的配位能力等特征,在发光材料领域具有比其他有机化合物更优的特性,是一类被广泛应用的重要的荧光化合物,比如8-羟基喹啉、8-氨基喹啉以及喹啉羧酸等可作为荧光探针[2-6]。本文合成了喹啉-2-甲酸与过渡金属锰的配合物晶体,并通过X射线单晶衍射、红外光谱、热重分析和荧光光谱等对金属配合物进行表征,希望能够为此类功能材料的研发提供一些有价值的理论依据。
1 实验部分
1.1 仪器与试剂
仪器:美国Nicolette ISO10型FT-IR红外光谱仪,美国TGA Q50 V20.13型热分析仪,德国Bruker P4型单晶衍射仪,美国UV-2401PC型紫外可见光谱仪,日本F-7000 FL型荧光光谱探测系统,上海市实验仪器总厂202-1型干燥箱。
试剂:喹啉-2-甲酸、硫酸锰、N,N-二甲基甲酰胺(DMF)等,均为分析纯。
1.2 配合物的合成
准确称取2 mmol喹啉-2-甲酸,将其放入25 mL反应釜中,加入5 mL DMF和9 mL蒸馏水进行充分溶解,再加入1 mmol MnSO4,搅拌均匀,拧紧盖子,放入烘箱,在120℃下反应3 d,自然冷却至室温,有浅黄色透明块状晶体生成,产率为76.28%。
1.3 射线衍射实验和单晶结构分析
选取大小为0.40 mm×0.27 mm×0.23 mm的浅黄色透明单晶,置于Bruker P4衍射仪上,用石墨单色化的 Mo靶 K射线( λ =0.071 073 nm)在 3.43°<θ<27.51°范围内扫描,于293(2)K下共收集 2 049个衍射点,其中独立衍射点为1 931个,最终偏差因子[对I>2σ(I)的衍射点]R1=0.026 6,wR2=0.068 0。 所有数据经经验吸收校正。晶体结构用直接法解出,对全部非氢原子坐标及其各向异性热参数进行全矩阵最小二乘法修正。所有计算工作均在PC机上用SHELXTL程序包完成。
2 结果与讨论
2.1 配合物的晶体结构
X射线衍射分析表明:标题配合物属于晶体属单斜晶系,P21/a空间群,a=0.731 69(4)nm,b=1.310 49(7) nm,c=1.002 63(6)nm,β=107.354 3(16)°,V=0.917 63(9) nm3,Z=2,Mr=435.29,Dc=1.575 g/cm3,µ=0.762 mm-1,F(000)=446。 配合物的部分键长和键角列于表1。
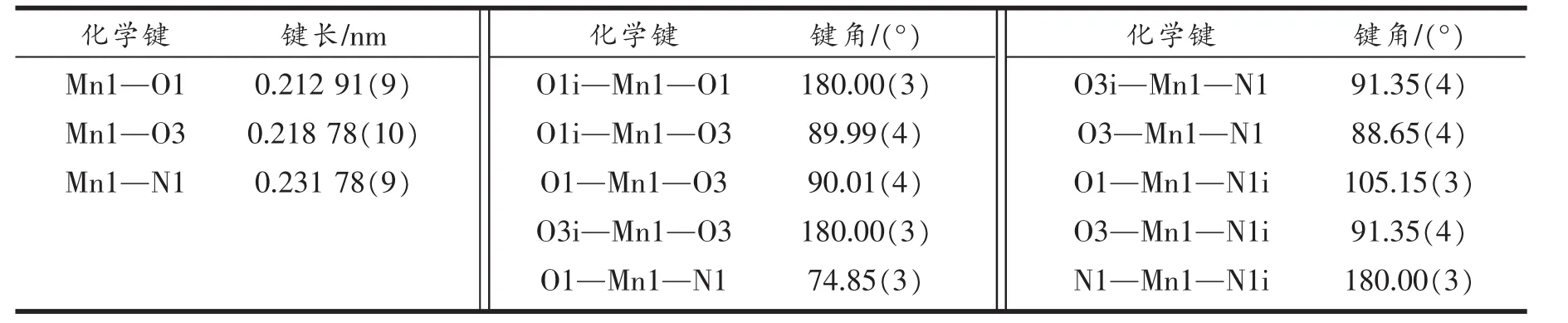
表1 配合物的部分键长和键角
图1是配合物的分子结构图。由图1可见,配合物是一个单核结构配合物,其分子式为MnL2(H2O)2(L=喹啉-2-甲酸离子),该分子以Mn(II)离子为中心对称,由1个Mn(II)离子、2个配体喹啉-2-甲酸离子和2个配位水组成。 中心 Mn(II)离子与 6 个原子(O1、N1、O1i、N1i、O3、O3i)配位,其中 O1、N1、O1i、N1i在八面体的赤道面上,扭转角∠N1—O1i—N1i—O1=0.00°,共面性非常好,O3、O3i在八面体的两极,其中∠O3—Mn1—O3i=180 °,这 6 个原子在 Mn(II)离子周围形成了稍微变形的八面体配位构型(因Mn1—O1、Mn1—N1键长不等)(见图2)。配体喹啉环N1—C1—C2—C3—C4—C5—C6—C7—C8—C9所形成的面和另一配体的喹啉环平行但不共面;配位五元环O1—C10—C1—N1—Mn1形成的面与另一配位五元环 O1i—C10i—C1i—N1i—Mn1所形成的面的二面角为0.00°。这说明O1、C10、C1、N1、Mn1、O1i、C10i、C1i、N1i 这 9 个 原 子共平面,形成了一个共轭大 键(见图1)。
相邻分子间存在氢键 O3—H3A···O2和 O3—H3B···O2。其中 O3—H3A···O2 键长为 0.274 84 nm,键角为 152.0°;O3—H3B···O2 键长为 0.284 13 nm,键角为139.3°。这些氢键将配合物扩展为二维平面结构(见图3)。相邻配体之间的喹啉环相互平行且部分重叠,其中吡啶环N1—C1—C2—C3—C4—C9的质心Cg1与另一配体的苯环C4—C5—C6—C7—C8—C9的质心 Cg2 相距 0.405 0 nm,形成弱的 -堆积[7]作用(见图4),进一步将配合物扩展为三维结构(见图5)。
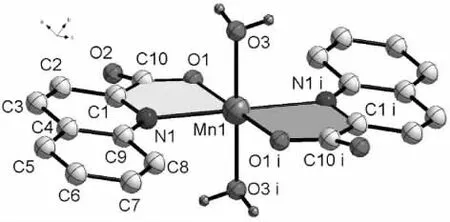
图1 配合物的分子结构图
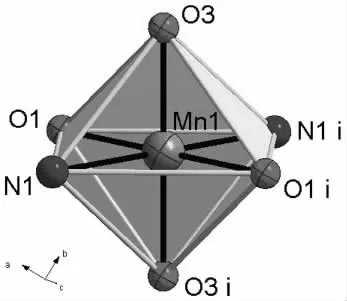
图2 中心Mn(II)离子的配位多面体图
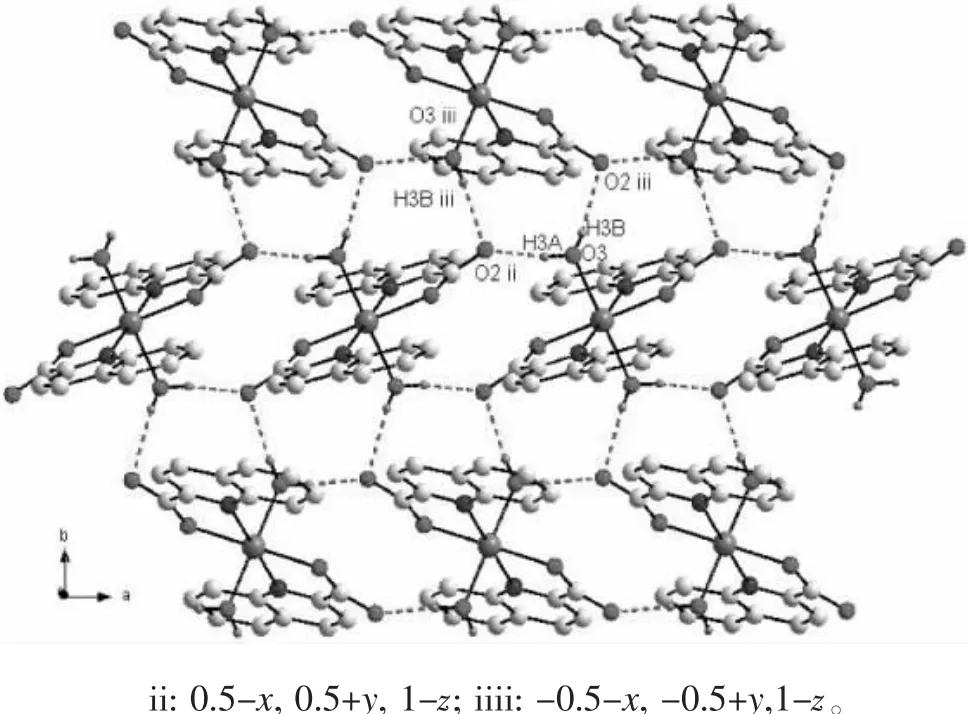
图3 配合物的氢键图
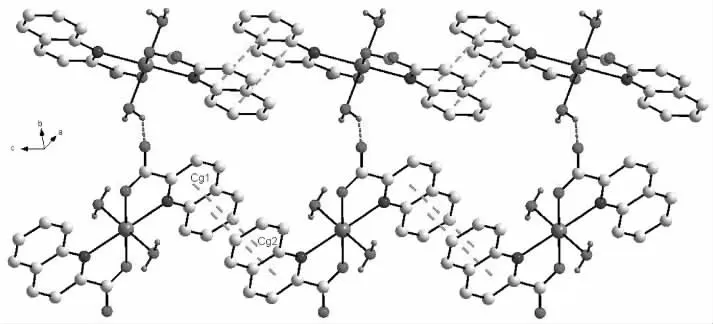
图4 配合物的 -堆积图
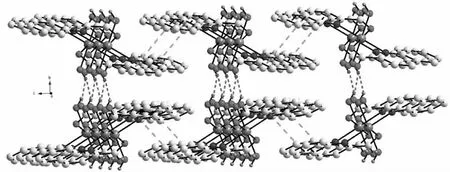
图5 配合物的三维结构图
2.2 配合物的红外光谱分析
本实验用KBr压片法在红外光谱仪上对配体和配合物进行测试,其工作扫描波数范围为400~4 000 cm-1。配体和配合物的红外光谱见图6和图7。
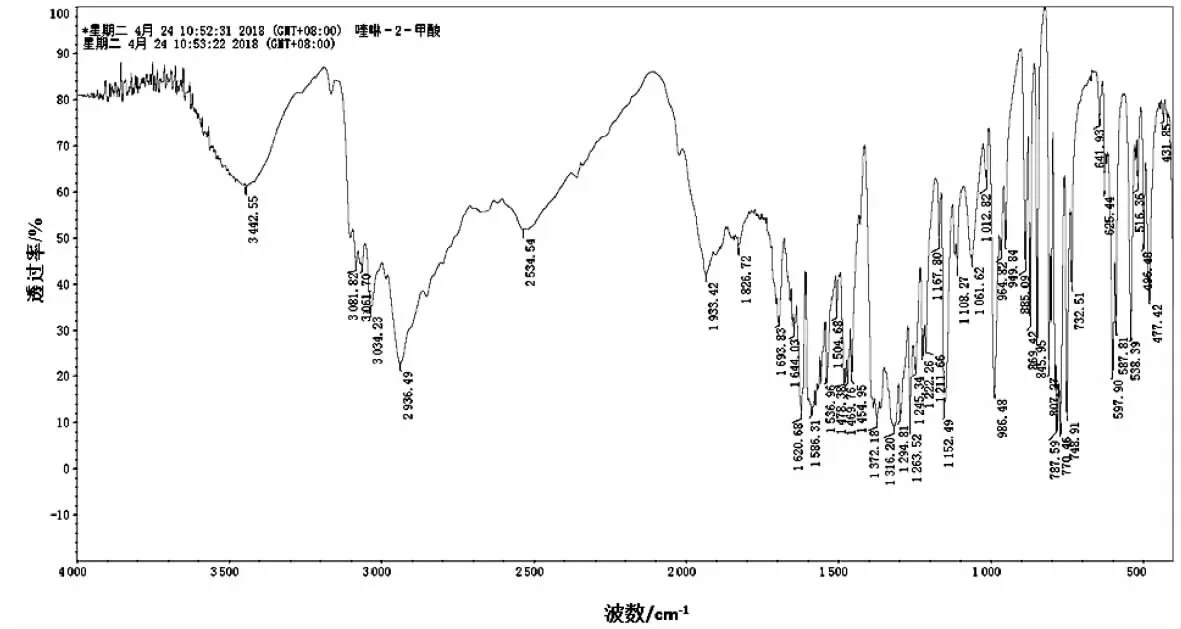
图6 配体的IR谱图
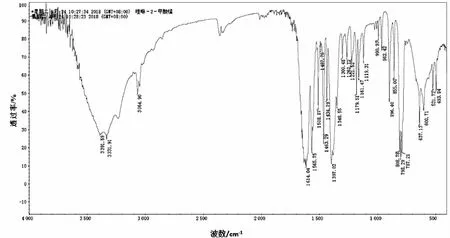
图7 配合物的IR谱图
配合物在3 391.59 cm-1处有一个强且宽的吸收峰,为配位水的—OH振动吸收峰。配体在1 693.83 cm-1处有一个中等强度的吸收峰,为羧基的不对称伸缩振动吸收峰,形成配合物后此峰移至1 614.04 cm-1处且吸收强度增大;同时配体在1 372.18 cm-1处有一个强吸收峰,为羧基的对称伸缩振动吸收峰,生成配合物后此峰移至1 397.02 cm-1处。这说明配体L中的羰基(—COO)与金属离子 Mn(II)配位,该结果与晶体结构解析一致。配体喹啉环上的ν(C—N)吸收峰出现在1 586 cm-1处,形成配合物后喹啉环上的ν(C—N)吸收峰位置移到1 508 cm-1处,△ν=78 cm-1。因氮原子参与配位,氮原子上的孤对电子被拉向金属离子,故检测到的 ν(C—N)向低波数移动[8]。
2.3 配合物的热重分析
配合物的热重分析实验采用TGA Q50 V20.13热分析仪来进行,保护气体为氮气,在30~800℃范围内进行测试。结果见图8。
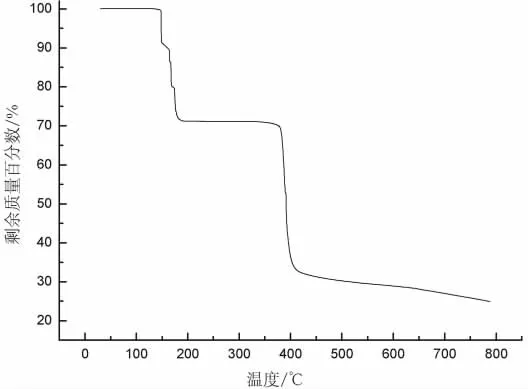
图8 配合物的热重曲线
由图8可知,配合物的失重过程主要分三个阶段。 配合物在 148℃时开始分解,到149℃时有一个拐点,此时的失重率为8.56%,应该为失去2个配位水(理论值为8.27%);紧接着在150℃继续分解,到190℃时失重为20.29%,应为配体喹啉-2-甲酸离子的羧基与喹啉环断裂,并生成CO2而失重(理论值为20.23%);在190~360℃为恒重状态,360℃以后配合物迅速分解,此时喹啉环骨架坍塌断裂,到410℃之后分解仍然继续,但速度相较缓慢,直到796℃处还有下降的趋势,说明此时配合物还未分解完全,此刻残重为24.64%。预测分解到最后,残余物质应该是金属氧化物MnO2(理论值为 20.23%)。
2.4 配体和配合物的荧光光谱分析
在室温下对有机配体喹啉-2-甲酸及其配合物进行荧光测试,以DMF为溶剂,配制浓度为1×10-5mol/L的配体溶液和配合物溶液,测试范围在250~500 nm,且根据荧光光谱原理对测试结果进行分析。测试所得谱图见图9。
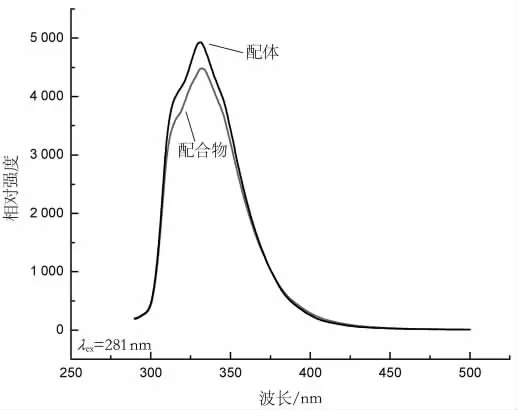
图9 配体和配合物的发射光谱
由图9可见,在281 nm波长的光激发下,自由配体喹啉-2-甲酸在331 nm处和配合物在332 nm处,均有很强的荧光发射峰。配合物与配体喹啉-2-甲酸的荧光光谱相似,说明配合物的荧光发射光谱主要来自配体喹啉-2-甲酸的电荷跃迁,属LLCT发射(配体发射)。配体喹啉-2-甲酸的荧光峰较强,这是因为配体分子中的喹啉环上的原子共面,形成了大的 键,其共轭程度较好。生成配合物后荧光吸收强度稍有减弱,这可能是因为二价锰离子是3d5的电子构型,具有顺磁性,可能产生可逆性的电荷转移作用而导致发生荧光猝灭;但金属锰离子与配体配位后生成的配合物基本为平面结构,使得共轭程度增大,这个作用使配合物的荧光性增强。二者相互作用,使得配合物的荧光强度比配体的荧光强度稍弱[9]。
3 结束语
本文采用水热法合成了喹啉-2-甲酸锰配合物,其分子式为MnL2(H2O)2。采用X射线单晶衍射、红外光谱、热重分析和荧光分析对其进行了表征。该配合物属于单斜晶系,空间群是P21/a;该晶胞参数是:a=0.731 69(4) nm,b=1.310 49(7) nm,c=1.002 63(6) nm,α =90.00(6)°,β=107.3543(16)°,γ=90.00°,V=0.91763(9) nm3,Mr=435.29,Dc=1.575 g/cm3。 以 Mn(II)离子为中心的配位多面体为变形的八面体构型。配合物存在着分子间作用力和氢键作用,其共同将配合物扩展为三维超分子结构。配体和配合物均具有很好的荧光性。

