枸杞多糖改良差示酚硫法测定及其木瓜蛋白酶辅助提取工艺研究*
高建德,师婷婷,范凌云,刘 雄
甘肃中医药大学药学院,甘肃 兰州 730000
枸杞是茄科植物枸杞(Lycium barbarumL.)的干燥成熟果实,始载于2000多年前的《神农本草经》并被列为上品,同时又是国家卫生部公布的药食同源品种,具有补肝肾、益精血、明目之功效。大量研究[1-2]表明,枸杞中含有的多糖类物质为其发挥功效的主要物质之一,具有增强免疫力、抗癌、抗氧化、防衰老、增加造血功能、防止遗传损伤和细胞突变等作用。因此,提取枸杞多糖、提高枸杞多糖的提取率对开发枸杞资源具有重要意义。目前有关枸杞多糖的提取主要有水浸法、碱液提取法、超声波萃取法、微波法、酶解提取法等[3-4]。但水浸法提取周期长,提取率低,需要多次重复浸泡提取才能提高产率,且提取的多糖纯度不高[5];碱液提取后液体需要中和,后期处理繁琐,容易使部分多糖发生水解,破坏多糖的活性结构、减少多糖得率[6]。超声波萃取法和微波法虽能提高枸杞多糖提取率,但耗能大,成本高。而酶辅助提取条件温和,提取时间短、能耗低、成本低廉,有利于保持有效成分原有的药效,因此,酶辅助提取可作为一种新技术为中药提取提供新途径[7]。有关枸杞多糖的酶辅助提取虽已有文献报道[8-9],但有关木瓜蛋白酶辅助提取枸杞多糖的文献鲜见报道。
目前测量多糖含量文献报道的方法主要有蒽酮硫酸法和苯酚硫酸法,其中苯酚硫酸法测定的实验数据稳定性、准确性优于蒽酮硫酸法,故测定多糖含量更多应用苯酚硫酸法,但苯酚硫酸法存在数据波动较大,重复性差等缺点[10]。因此,对苯酚硫酸法进行改进,以提高该方法的准确性和重复性显得较为重要。改良差示酚硫法是对苯酚硫酸法的改进,可用于含有杂质的多糖样品的定量分析,既能简化多糖样品预处理,避免繁琐操作,减少非糖杂质的干扰,又能克服原有方法在显色反应中因浓硫酸放热而导致的诸多难点,从多方面减少测量误差,提高分析结果的准确性、重复性和稳定性[11]。为此本研究在改良差示酚硫法测定枸杞多糖的基础上,研究木瓜蛋白酶辅助提取枸杞多糖的工艺,为更精准地测定枸杞多糖及更好地开发利用枸杞资源提供科学依据。
1 材料
1.1 仪器 UV Blue Star B型紫外-可见分光光度计(LabTech,北京莱佰泰科技有限公司);DD-5M离心机(湘仪离心机仪器有限公司);AL104型电子天平(METTLER TOLEDO,瑞士);电热恒温水浴锅(浙江省余姚市检测仪表厂);AKRYUP-1816超纯水机(成都唐氏康宁科技发展有限公司)。
1.2 试药 枸杞(购于兰州市黄河药材市场,产自宁夏)样品经甘肃中医药大学药学院晋玲教授鉴定为宁夏枸杞;葡萄糖(中国食品药品检定研究院,批号:110833-200904);木瓜蛋白酶(购于宁夏和氏壁生物技术有限公司);无水乙醇、石油醚、浓硫酸、苯酚及其他试剂均为分析纯。
2 方法与结果
2.1 枸杞多糖含量测定方法的建立
2.1.1 枸杞粗多糖的制备 精密称取干燥枸杞药材20.0g,粉碎至适宜粒度,置于回流装置中,加8倍量石油醚脱脂2次,2 h/次,回收溶剂,枸杞药渣真空干燥后加10倍量水煎煮2次,2h/次,水提液浓缩后加乙醇使含醇量达30%,低温静置24小时后离心,上清液加乙醇使含醇量达85%,静置离心,取沉淀真空干燥的枸杞粗多糖。
2.1.2 供试品溶液的制备 精密称取枸杞粗多糖粉末适量,依次用石油醚、乙醚、乙醇洗涤、离心,真空干燥枸杞粗多糖,得精制的枸杞多糖样品,再加蒸馏水溶解,制成0.25 mg/mL多糖供试液储备待用。
2.1.3 对照品溶液的制备 精密称取置五氧化二磷真空干燥箱干燥24小时的葡萄糖25 mg,加蒸馏水溶解并定容至50 mL容量瓶中,制成0.50 mg/mL葡萄糖贮备液,备用。
2.1.4 检测波长的选择 取“2.1.2”项下所得多糖供试品溶液1.0 mL置具塞试管中,加入1.0 mL 0.05 g/mL苯酚溶液,混匀,快速滴加5.0 mL 84%的硫酸溶液,振摇2分钟,置沸水浴加热30分钟,取出,流水冷却至室温,补加1.0 mL蒸馏水,摇匀后在紫外-可见分光光度计400~600 nm波长范围内扫描,以蒸馏水相同操作作为空白对照,各波长下测得吸光度值A1。另取“2.1.2”项下所得多糖供试品溶液1.0 mL置具塞试管中,加入1.0 mL蒸馏水,混匀,快速滴加5.0mL 84%的硫酸溶液,振摇2分钟,置沸水浴加热30分钟,取出,流水冷却至室温,补加1.0 mL 0.05 g/mL的苯酚溶液,摇匀后在紫外-可见分光光度计400~600 nm波长范围内扫描,以蒸馏水相同操作作为空白对照,各波长下测得吸光度值A2。ΔA样=A1-A2。取对照品溶液按同样的方法操作,于400~600nm波长范围内扫描测定各波长下吸光度值A11和A22。ΔA对=A11-A22。以ΔA样和ΔA对各点做吸收曲线L样和L对。结果显示,L样和L对在484 nm处均有最大吸收,因此,选择484 nm进行测定。
2.1.5 标准曲线建立 精密吸取“2.1.3”项下葡萄糖对照品溶液,置于具塞试管中,分别加蒸馏水,配制成质量浓度分别为 0.025、0.05、0.075、0.1、0.125、0.15 mg/mL的葡萄糖对照品溶液。按“2.1.4”项下方法测定吸光度值A1和A2,计算出对应的吸光度差值ΔA(A1-A2),由质量浓度C对ΔA进行线性回归,得回归方程:
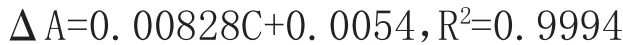
结果表明葡萄糖浓度在0.025~0.3 mg/mL范围内与吸光度呈良好线性关系。
2.1.6 精密度实验 精密吸取“2.1.2”项下样品溶液1 mL,按“2.1.4”项下方法操作,平行测定5次,得RSD值为1.83%,结果表明该方法精密度良好。
2.1.7 重复性实验 精密吸取“2.1.2”项下样品溶液5份,每份1 mL,按“2.1.4”项下方法操作测定吸光度值,得RSD值为2.45%,结果表明该方法重复性良好。
2.1.8 回收率实验 精密吸取同一供试品溶液1 mL,取9份,每3份分别精密加入样品含多糖量的 80%、100%、120%的葡萄糖对照品,按“2.1.4”项下方法操作测定吸光度值,计算回收率,得平均回收率为 98.76%,RSD 为 2.24%。
2.1.9 样品测定 按照“2.1.4”项所述方法测定吸光度值,求得ΔA样,由“2.1.5”项下回归方程计算样品液中的单糖质量浓度(C),按下式计算枸杞多糖含量。枸杞多糖含量(%)=C·D/W×100%
式中C为样品最终测定液中单糖质量浓度(mg/mL),D为枸杞多糖样品溶液的稀释倍数,W为枸杞样品质量(mg)。
2.2 均匀设计实验
2.2.1 均匀设计与结果 在酶辅助提取工艺中酶用量、pH、酶解时间及酶解温度为酶辅助提取必须考察的因素,在选取木瓜蛋白酶的基础上加均匀实验,对素酶用量(X1)、pH(X2)、酶解时间(X3)及酶解温度(X4)4个因素进行考察,考察其对枸杞多糖提取率的影响,见表1。
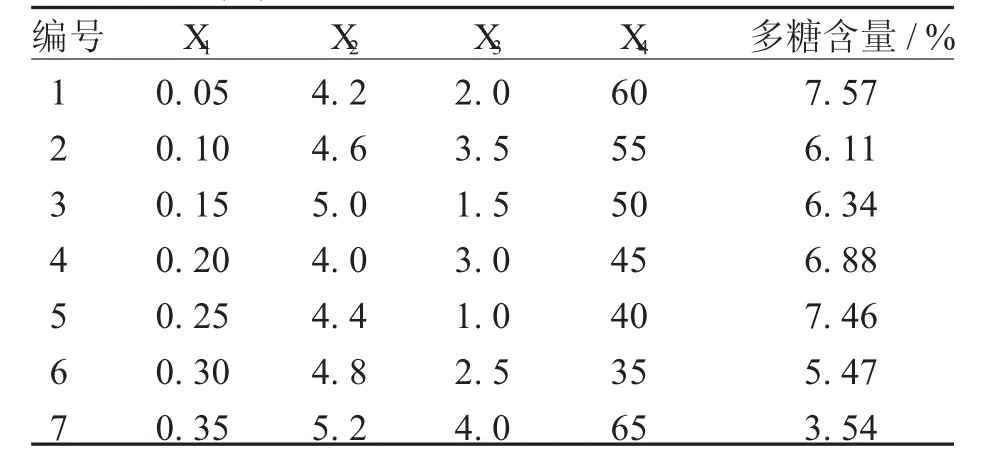
表1 U*7(74)木瓜蛋白酶辅助提取枸杞多糖均匀设计
2.2.2 均匀设计实验结果 利用SPSS 19.0统计软件对表1中的数据进行回归分析,得回归方程为:Y=16.455-3.678X1-1.712X2-0.659X3,其中Y为枸杞多糖含量;X1为酶用量;X2为pH值,X3为酶解时间,对回归方程进行检验所得复相关系数R=0.983,检验值F=113.320,临界值F(0.05,3,3)=9.28.检验值F>F(0.05,3,3),P<0.05,说明回归方程具有显著性意义。回归方程中酶用量(X1)、pH(X2)、酶解时间(X3)的回归方程系数为负值且为显著性影响因素,其取值应为极小值;酶解温度(X4)没有纳入回归方程,其取值可以为极小值至极大值之间的任意值。根据回归方程并结合专业知识,确定枸杞多糖木瓜蛋白酶酶解提取的最佳工艺条件为:酶用量为0.2%,pH为4.2,温度为40℃,酶解时间为1.0小时。将优化值代入回归方程得Y=8.60%。
2.2.3 工艺参数验证实验 精密称取枸杞药材3份(20,20,20 g),粉碎至适宜粒度,石油醚脱脂,按优选出的最佳提取工艺条件在pH 4.2、木瓜蛋白酶用量0.2%、酶解时间1.0小时、酶解温度40℃的条件下进行酶解提取,测定枸杞多糖的含量,不加酶作为空白对照,结果见表2。

表2 工艺参数验证结果
从表2可以看出,按优化工艺进行验证实验,枸杞多糖提取率平均值为8.50%,与均匀设计实验预测结果(8.60%)基本接近,并且与传统枸杞水煎(4.77%)相比,木瓜蛋白酶辅助提取能明显提高枸杞多糖提取率。
2.3 木瓜蛋白酶辅助酶解提取液相对黏度分析 相对黏度的测定按《中国药典》2015版二部附录VIG中乌氏黏度计测定相对黏度方法进行测定。取不同浓缩比例的枸杞粗多糖提取液一定量置乌氏黏度计内,将黏度计垂直固定于25℃恒温水槽中,使枸杞多糖提取液温度与水浴温度达到平衡,保温25分钟。记录枸杞多糖提取液在乌氏黏度计中的流出时间(t),并以蒸馏水作为对照,记录蒸馏水在乌氏黏度计中流出的时间(t0),运用相对黏度(E0)公式E0=t/t0计算枸杞多糖提取液的E0,分析比较传统水煎提取与酶解辅助水提枸杞多糖提取液不同浓缩比的相对黏度。结果表明,木瓜蛋白酶解提取液与传统提取液的相对黏度均随浓度的增大呈上升趋势,但经木瓜蛋白酶辅助提取后其提取液相对黏度较传统提取相对液黏度增大,尤其当浓缩比达1∶2时,酶解提取液的相对黏度较传统提取液的相对黏度增加,而传统提取液浓缩比为1∶3与1∶2时两者相对黏度差异较小,见图1。
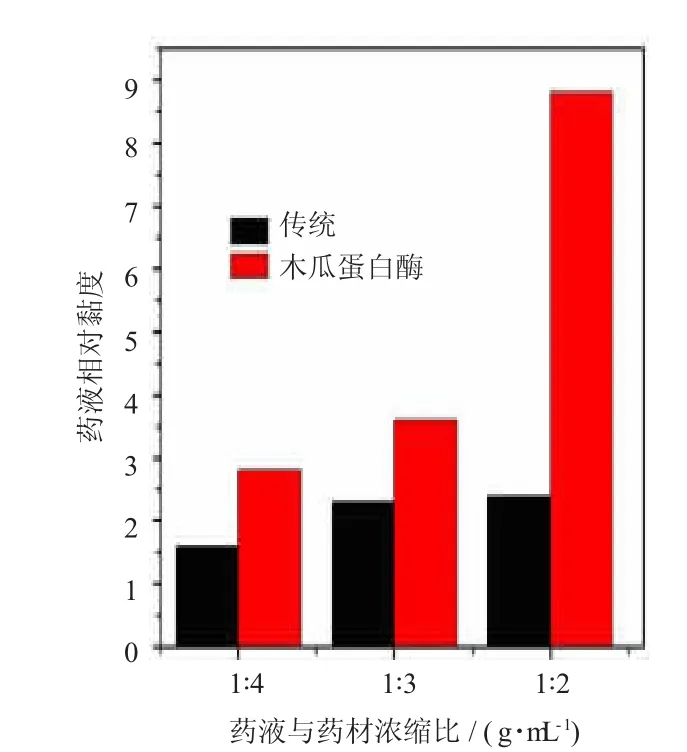
图1 传统与木瓜蛋白酶酶解提取液相对黏度
2.4 木瓜蛋白酶提取枸杞粗多糖的体外抗氧化活性测定
2.4.1 枸杞粗多糖总还原力的测定[12]称取一定量的枸杞药材,按枸杞多糖木瓜蛋白酶酶解提取的最佳工艺条件提取,得到的枸杞提取液按“2.1.1”项下方法处理,质量浓度按原药材重量计算,配制成浓度为 2、4、8、12、16 mg/mL 的供试液,量取不同浓度的供试液 2.0 mL,各加pH 6.6的磷酸缓冲液 (0.2 mol/L)2.5 mL和1%铁氰化钾溶液2.5 mL,混匀,混合液在50℃恒温条件下反应20分钟,取出后迅速冷却,再加入10%三氯乙酸溶液2.5 mL,混匀后在3 000 r/min条件下离心10分钟,取上清液2.5 mL于试管中,加蒸馏水2.5 mL后加0.1%三氯化铁溶液0.5 mL,混合均匀,室温静置10分钟,于700 nm处测定其吸光度A,不加木瓜蛋白酶作空白对照,结果见图 2。

图2 木瓜蛋白酶辅助提取枸杞多糖还原能力
2.4.2 枸杞粗多糖D PPH·清除率测定[13]称取一定量的枸杞药材,按枸杞多糖木瓜蛋白酶酶解提取的最佳工艺条件提取,得到的枸杞提取液按“2.1.1”项下方法处理,质量浓度按原药材重量计算,配置成浓度为 2、4、8、12、16 mg/mL 的供试液,量取不同浓度的供试液2.0 mL,各加入1mL用无水乙醇配制的DPPH·溶液,并使DPPH·终浓度为0.8 mmol/L。用力振摇混匀后置暗室中静置30分钟,于517 nm波长处测定吸光度,不加木瓜蛋白酶作空白对照。DPPH·清除率测定公式为:DPPH·清除率(%)=[A0-(A1-A2)]/A0×100%。式中 A1为加枸杞多糖溶液后DPPH·溶液吸光度值;A2为枸杞多糖溶液在测定波长的吸光度值;A0为未加枸杞多糖溶液DPPH·溶液吸光度值,结果见图3。
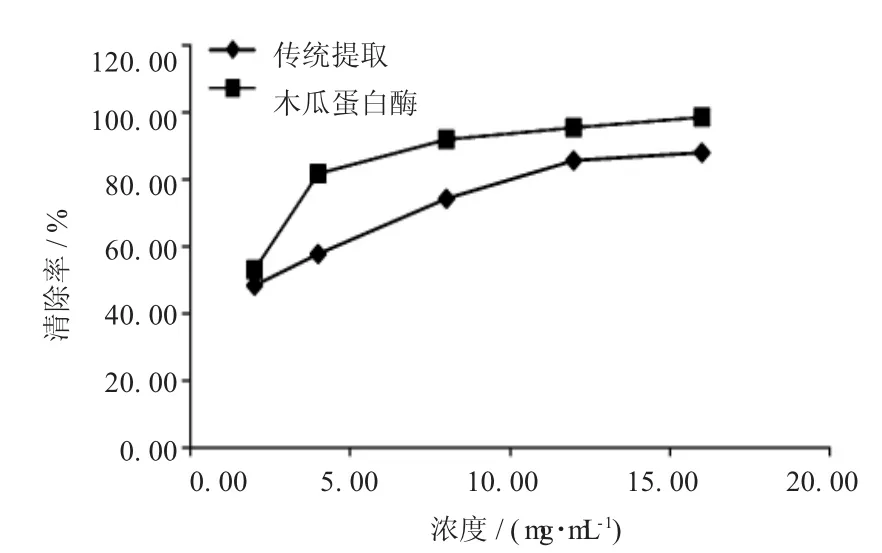
图3 木瓜蛋白酶辅助提取枸杞多糖D PPH·清除率
3 讨论
通过改良差示酚硫法的方法学考察可知,该方法用于枸杞多糖含量测定,具有简单、准确、重复性好等优点。改良差示酚硫法与传统苯酚硫酸法相比,是将硫酸、水和苯酚预先混匀,放置室温后再加入样品液,有效克服了传统方法加入浓硫酸放热的条件下进行显色反应导致的多种误差,且可用于测定含有杂质的多糖样品,减少了样品中非糖杂质的干扰,具有很好的实用价值。
均匀设计主要在实验范围内考虑实验点均匀散布以求通过最少的实验来获得最多的信息,因而其实验次数较正交设计明显减少,均匀设计特别适合于多因素多水平的实验和系统模型完全未知的情况。木瓜蛋白酶是一种来源广泛的植物蛋白酶,在酸性、中性、碱性环境下均能保持较高的活性,对蛋白质、氨基酸酯以及酰胺等化合物的水解反应具有良好的催化活性[14]。枸杞水煎液中有蛋白质,蛋白质在提取过程中遇热凝固,影响其他有效成分的浸出。因此,采用木瓜蛋白酶对枸杞进行预处理,可将蛋白质水解成多肽及氨基酸类,遇热不再凝固,从而促进各种有效成分的增加。实验选用均匀设计对多因素影响下的酶反应工艺条件进行优化,相对于正交设计来说能减少实验次数,快速发现最佳工艺条件:木瓜蛋白酶用量为0.2%,pH为4.2,温度为40℃,酶解时间为1.0小时。相同药材条件下按此最佳工艺木瓜蛋白酶辅助提取枸杞多糖提取率为8.50%,而传统提取率为4.77%。同时比较酶解提取液与传统提取液的相对黏度发现,提取液相对黏度随稠度及枸杞多糖浓度升高而增加,相同条件下,木瓜蛋白酶辅助提取后提取液可能由于枸杞多糖提取率升高而表现出较高的相对黏度。此外,检验枸杞多糖样品的还原力及DPPH·清除率,结果显示枸杞多糖具有显著的抗氧化性和DPPH·清除能力,木瓜蛋白酶辅助提取法可通过提高枸杞多糖提取率有效提高枸杞多糖的还原力及DPPH·清除率。该结果将为枸杞进一步开发和利用提供重要的参考价值。

