静电纺丝技术制备载药缓释敷料的研究进展
姜 坤, 陈 彤
(1.淮南联合大学 化工系,安徽 淮南 232038;2.淮南市科学技术情报研究所,安徽 淮南 232001)
皮肤是人体最大的器官,是阻止微生物入侵和维持体内环境稳定的天然屏障[1].因包覆在人体表面容易受到创伤、烧烫伤、糖尿病变等损伤,若被微生物感染则导致皮肤溃烂、坏死[2].
1 敷料发展
自远古时代起,人们就知道将浸渍于油中的亚麻绳作为敷料覆盖伤口,用来协控出血、防止感染和吸收分泌物,促进伤口快速愈合,使机体免受到更大的损伤[3].棉花、纱布、绷带等是传统临床上使用的主要敷料[4].这类敷料被渗出液浸透后易感染,容易与伤口粘连,换药量大.1962年,英国科学家Winter提出“湿性创面愈合”理论,从此开启了现代敷料研究,相继开发出薄膜类、液体类、泡沫类、喷雾类、水胶体类、水凝胶类和海藻酸盐类等敷料[5].在伤口愈合的过程中,这些敷料创造的微环境实现了对组织液的吸收和维持了伤口的湿润,却忽略了新生细胞生长需要吸入氧气和坏死组织自溶需要排出二氧化碳,即敷料的通透性[6].往往导致伤口散发出恶臭,增加了伤口感染的风险[7].
2 缓释临床意义
传统的给药方式,因药物进入伤口后只能短时间的维持在有效浓度区间,所以需要频繁给药,导致伤口药物浓度高低波动较大(如图1),当超过患者药物耐受的最高剂量(峰),可产生副作用甚至中毒;当低于有效剂量(谷),则无法达到疗效.小剂量频繁的给药虽然可以调节伤口药物的浓度,避免了“峰谷”现象,但患者难以接受过于频繁的给药次数,且因换药容易造成二次损伤,实施起来困难较大.因此,实现药物以合适的浓度长效持续稳定地释放出来,成为新型药物传输系统研制的根本所在[8].
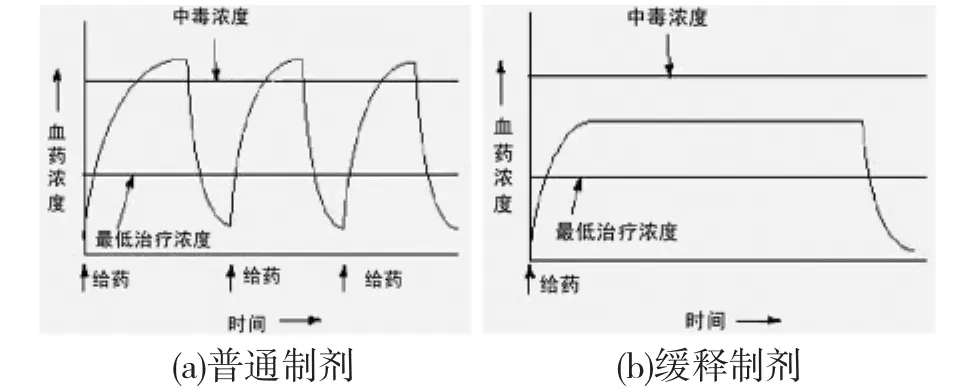
图1 普通制剂和控释制剂给药时血药浓度示意图[9]
3 载药电纺技术
理想敷料应具有以下特点:①保湿性,为伤口创造一定湿度,利于上皮组织形成;②吸水性,能够吸收伤口多余的渗出物;③通透性,便于伤口与外界进行气体交换,④载药性,可载药释药,达到抗菌、消炎的作用[10].纳米纤维具有直径小、比表面积大等特性,有利于药物的负载,能模拟天然ECM的结构和功能,是理想敷料[11].
1934年,美国人Formhals发明了静电纺丝的方法,其专利公布了由高压电源、计量泵、喷头和接收器4个部分(如图2)组成的静电纺丝装置[12].该装置通过静电斥力可简单有效、连续的制备直径为50~500nm纤维[13].但当时这项技术未被重视,直到1991年美国Reneker科研团队[14]才对静电纺丝的机理和制备技术进行了研究.2001年,美国人Ignatious和Baldoni将静电纺丝技术引入到载药领域[15],发现载药膜具有制备方便、对药物活性影响小、可控释缓释等诸多优点.
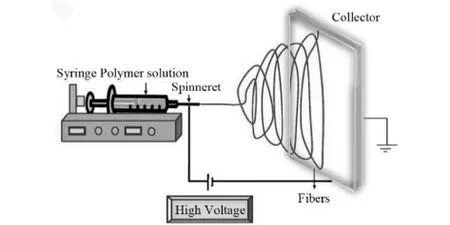
图2 静电纺丝制备纳米纤维装置示意图[16]
3.1 单喷头纺丝
单喷头的纺丝液将活性药物与聚合物溶液混合后直接进行纺丝,可得到具有药物释放功能的纤维[17],该装置简单、制备载药纤维膜有效,但是药物释放的初级阶段会有突释现象,科研人员通过以下方法进行控制药物释放的速率.
3.1.1 交联法
谢红[18]等将盐酸莫西沙星、聚乙烯醇和海藻酸钠混溶于水中进行共混纺丝,成膜后用戊二醛交联改性,对释药性能进行考评,发现交联时间越长,药物缓释性能越好,在体外释药4h时,未交联和交联1h、3h和20h的累积释放率分别约为67%、58%、41%和12%.是因为通过交联减小了纤维丝之间的孔隙,延缓了药物溶出的速度.
此法虽能提高了缓释的效率,但效果有限且交联剂的残留有潜在的危害.
3.1.2 夹心法
Jingwen Qin[19]等通过静电纺丝发制备载药量为20%的多层结构的药纳米纤维膜:聚乳酸/醋酸纤维素-单宁药/聚乳酸(如图3).对释药性能进行考评,与非夹心膜相比释药初期即达到48.5%,而夹心膜约为5%,10h分别约为68%、18%,35h分别约为82%、30%,70小时夹心膜累积释药量还未到40%.这是因为聚乳酸层起到缓释作用,一是聚乳酸层增加了药物的扩散距离;二是更厚的聚乳酸层更紧密,孔隙更小,这些都是药物缓释的原因[20].Jaworek A使用双通道装载不同的纺丝液,同时实施静电喷雾和静电纺丝,复合了纤维膜的结构[21],改进了夹心法,提高了制备效率.
此法大幅度提高了缓释的效率,但制备的效率较低.

图3 夹心法制备载药复合纤维膜[26]
3.1.3 乳液法
Cai等[22]通过油酸包裹万古霉素分散在聚乳酸溶液中形成乳液(W/O),通过静电纺丝制备皮芯结构的纳米纤维,对释药性能进行考评(如图4),发现药物可持续释放600h,累积释放量还未到60%,同时力学性能也得到了明显的加强,和纯聚乳酸电纺纤维膜对比,该膜增加了57%的拉伸强度和提高了36%的断裂伸长率.是因为药物在释放的过程中要突破壳层纤维,增加了药物的扩散距离,延缓了药物溶出的速度.
此法大幅度提高了缓释的效率,但油包水体系应用有限,且活性剂的残留有潜在的危害.
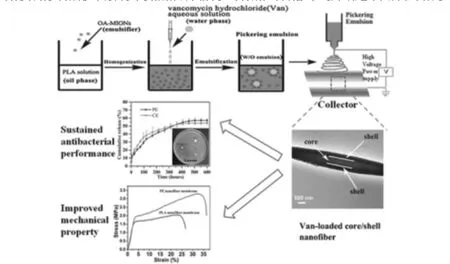
图4 乳液法制备芯壳载药复合纤维及测评[22]
3.2 同轴法载药纤维膜
同轴法的原理和普通电纺相同,只是在装置上将传统的喷丝头改成同轴两层通道的喷头[23],芯层溶液和壳层溶液分装在两个注射器中与同轴喷头连接,分别由两台计量泵精确控制(如图5).两种不同的纺丝液分别从两层通道流出,在喷嘴处汇合纺成核壳结构的纤维(如图6)[24].
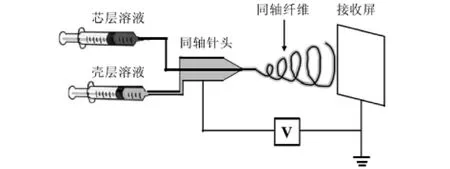
图5 同轴静电纺丝示意图[23]
Cui Jing[25]以聚乙烯醇-苯乙烯吡啶盐/玉米醇溶蛋白为壳层,盐酸四环素的无水乙醇溶液为芯层进行同轴纺丝,成膜后进行光交联.对两种膜进行药物缓释性能考察,发现同轴载药膜1h的药物释放量仅为21.2%,12h后药物累积释放量为58.1%,而共混载药膜(对照组,同条件)1h内,药物释放量达到62.3%.通过对比,同轴静电纺载药纳米纤维更能起到药物缓释的效果.对两种膜进行力学性能考察,发现同轴载药膜的断裂强度约为8.52MPa,优于共混载药膜且断裂伸长率也大于共混载药膜.这是因为药物在释放的过程中要突破壳层纤维,增加了药物的扩散距离,延缓了药物溶出的速度.此外同轴纺丝也可进行芯-壳双载药.
此法大幅度提高了缓释的效率,应用范围较广,但设备较复杂,工艺参数不易控制.
4 总结与展望
相对传统敷料而言,静电纺丝制备的载药缓释敷料在临床治疗中有着很大的优势.虽然目前还不成熟,无法进行工业化生产,相信随着静电纺丝理论和技术的发展,载药缓释敷料必将走向市场,为皮肤损伤患者带来福音.

