宁夏红果枸杞多糖提取及其体外抗氧化活性研究
孙玉姣,侯淑婷,鱼喆喆,崔湘怡,谭梓杉,戚歆宇,康雨芳
(陕西科技大学 食品与生物工程学院,陕西 西安 710021)
0 引言
细胞在正常的代谢和生长过程中会产生一系列活性氧(reactive oxygen species,ROS),例如超氧阴离子(superoxide anion,O2-),羟自由基(hydroxyl radicals,·OH)和过氧化氢(hydrogen peroxide,H2O2)等.它们能够破坏脂质、蛋白质和核酸等生物大分子,导致癌症、糖尿病、神经退行性疾病和组织炎症等许多疾病的发生[1,2].一些食物的变质也与食品中的脂质或者不饱和脂肪酸的氧化有关.由ROS引起的脂质氧化会引起脂类食品营养价值的降低,不仅造成食物外观受损,还会增加食品安全的风险.抗氧化剂可以延缓或者阻止过量自由基和活性氧类物质的形成,也可以阻止ROS同生物大分子发生反应,保护身体免受ROS的损害,因而对人类身体健康有积极的作用.许多化学合成的抗氧化剂已经被商品化,被广泛用于阻止氧化反应和过氧化过程.
目前,常用的合成抗氧化剂有二丁基羟基甲苯(butylated hydroxytoluene,BHT)、二丁基羟基茴香醚(butylated hydroxyanisole,BHA)、叔丁基对苯二酚(tert-butylhydroquinone,TBHQ)和没食子酸丙酯(propyl gallate,PG)等.然而,越来越多的研究发现一些合成抗氧化剂会对人体的肝、脾、肺等器官产生不利影响,具有致癌的风险[3-5].因此,寻找安全性高、无毒副作用和抗氧化性强的天然抗氧化剂受到了人们的广泛关注.目前开发的天然抗氧化剂有维生素类、酚类、类胡萝卜素类、黄酮类和甾醇类等,但这些天然抗氧化剂往往耐热性不好,遇高温容易挥发分解,导致失去抗氧化能力[6].多糖的结构相对稳定,并且来源广泛,无毒副作用,因此多糖有望成为新型的天然抗氧化剂.
宁夏枸杞主要分布在中国西北地区,具有滋肾、润肺、补肝、明目之功效,现有研究表明枸杞多糖具有促进免疫、抗衰老、抗肿瘤、清除自由基等多种生物活性,是枸杞发挥功效的重要物质基础[7].但这些研究多集中在对枸杞粗多糖的活性评价上,对枸杞多糖各单一组分的活性研究较少,阻碍了其构效关系的深入研究.
本研究拟在前期枸杞多糖提取纯化等相关研究[8]基础上,采用纤维素柱色谱法分离得到枸杞多糖的4个单一组分(LBP 1-4),采用羟自由基清除能力、超氧离子自由基清除能力、二苯代苦味酰基自由基(DPPH)清除能力、还原力、脂质抗氧化能力、ABTS自由基清除能力等六种不同方法评价其体外抗氧化活性的差异,为阐明枸杞多糖抗氧化活性的构效关系奠定理论基础,并对枸杞多糖作为新型天然抗氧化剂的开发利用提供科学依据.
1 材料与方法
1.1 材料与仪器
(1)主要材料与试剂:宁夏红果枸杞,购于西安万寿路中药材市场;乙醇;碳酸氢钠;葡萄糖;浓硫酸;氢氧化钠;盐酸;苯酚;1,1-二苯基-2-苦基肼(DPPH);铁氰化钾(K3Fe(CN)6);三氯乙酸(TCA);硫代巴比妥酸(TBA);磷酸氢二钠、磷酸二氢钠;抗坏血酸(Vc);甲醇;三氯化铁(FeCl3);双氧水;石油醚;乙醇;ABTS 过硫化钾;荧光素钠盐;AAPH;冰醋酸;D-半乳糖;氯仿;正丁醇;硫酸亚铁(FeSO4);水杨酸;邻苯三酚;以上试剂均为国产分析纯.
(2)主要仪器:CP 213 电子天平,奥豪斯仪器(常州)有限公司;UV-2600系列分光光度计,尤尼柯(上海)仪器有限公司;DF-101S集热式恒温加热磁力搅拌器,巩义市予华仪器责任有限公司;冷冻干燥机,西安比郎生物科技有限公司;KQ-250DE型数控超声波清洗器,昆山市超声仪器有限公司;THERMO Varioskan Flash全波长扫描式多功能酶标仪,赛默飞世尔科技有限公司;RE 52-99旋转蒸发器,上海亚荣生化仪器厂;BS-100A 自动部分收集器,上海沪西分析仪器厂有限公司;DEAE-52型纤维素离子交换柱,上海三爱思试剂有限公司.
1.2 实验方法
1.2.1 枸杞多糖的提取
将200 g枸杞粉浸泡在1 800 mL的蒸馏水中,超声预处理40 min.在40 ℃放置6 h后,过滤,将浸出液浓缩旋转蒸发到体积为200 mL.滤渣再溶于1 800 mL的蒸馏水中,重复提取一次,浓缩旋转蒸发到体积为200 mL.将两次的浓缩液合并.加入4倍体积的95%(v/w)乙醇,然后过夜放置于4 ℃环境下醇沉后,溶液于4 ℃离心,收集沉淀,沉淀部分再溶于100 mL的蒸馏水中,采用Sevag法[9]除去游离蛋白,将除蛋白后的溶液用玻璃纸在活的自来水下透析2天,将透析好的溶液用旋转蒸发仪在60 ℃下浓缩到200 mL,进行冻干,冻干12 h后得枸杞粗多糖LBP.
1.2.2 枸杞多糖的分离纯化
枸杞多糖(LBP)经DEAE-52纤维素离子交换柱层析进行分离[10],依次用蒸馏水、0.05 mol/L、0.10 mol/L、0.25 mol/L NaHCO3溶液分步洗脱,用自动部分收集仪收集洗脱样品,调节洗脱液流速1 mL/min,每管收集10 mL,收集好后用苯酚-硫酸法测糖含量于490 nm处隔管测定吸光值,以管数为横坐标,以吸光值为纵坐标,绘制洗脱曲线.
1.2.3 测糖含量
总糖含量的测定采用苯酚-硫酸法[11].以葡萄糖为标准,绘制标准曲线.将葡萄糖配制成浓度为0.2 mg/mL的标准溶液,分别吸取0.2 mL、0.4 mL、0.6 mL、0.8 mL和1.0 mL于试管中,每管用蒸馏水补到2.0 mL.依次加入50μL的80%(w/v)苯酚溶液和2.5 mL的浓硫酸.摇匀后,在室温下放置20 min,用紫外分光光度计于490 nm处测定光吸收值.用2 mL的蒸馏水作为空白对照,同样按不同方法操作.平行做三份,求出各个浓度吸光度的平均值.将得到的结果制作标准曲线,横坐标(X)为标准单糖质量,纵坐标(Y)为平均吸光度值(下同),进而得糖含量标准曲线.
样品的总糖含量测定:将枸杞多糖配制成浓度为2 mg/mL的溶液,吸取各样品溶液0.2 mL(平行三份),按以上操作方法测定其吸光度值.根据回归方程计算各个样品的总糖含量.
1.2.4 体外抗氧化活性试验
(1)羟自由基清除能力的测定
采用水杨酸比色法[12],取1 mL不同浓度的待测液分别于10 mL的试管中,依次加入1 mL 9 mmol/L FeSO4溶液、1 mL 9 mmol/L水杨酸-乙醇溶液,最后加入1 mL 8.8 mmol/L H2O2启动反应,震荡混匀,于37 ℃下水浴30 min,冷却,以水作参比在510 nm下测定吸光值A1,每个样品重复测定3次,取平均值.
羟自由基清除率计算按公式(1)进行:
(1)
式(1)中:A1-待测液在510 nm下的吸光值;A0-以H2O代替待测液在510 nm下的吸光值.
(2)超氧离子自由基清除能力的测定[13]
取1 mL不同浓度的待测液,依次加入3 mL 50 mmol Tris-HCL缓冲溶液(pH=8.2),30 ℃水浴20 min,冷却,加入3 mL 7 mmol/L的邻苯三酚溶液,震荡混匀,反应3 min,加入1 mL浓盐酸终止反应,在320 nm下测定吸光值A1,每个样品重复测定3次,取平均值.
超氧自由基清除率计算按公式(2)进行:
(2)
式(2)中:A1-待测液在320 nm下的吸光值;A0-以H2O代替待测液在320 nm下的吸光值.
(3)DPPH自由基清除能力的测定[14]
取1 mL 0.2 mmol/L DPPH乙醇溶液于10 mL具塞试管中,加入1 mL不同浓度的待测样液,震荡均匀,室温下避光反应30 min,在517 nm下测定吸光值A1,每个样品重复测定3次,取平均值.
DPPH清除率计算按公式(3)进行:
(3)
式(3)中:A1-待测液在517 nm下的吸光值;A0-以H2O代替待测液在517 nm下的吸光值.
(4)还原力的测定[15]
将不同浓度的样品溶液1 mL置于比色管中,加入1 mL 0.2 mol/L磷酸盐缓冲液(pH=6.6)和 0.125 mL的1%(w/v)的铁氰化钾,在50 ℃下反应20 min,反应结束后,加入0.125 mL 的10%(w/v)的三氯乙酸(TCA)终止反应,最后加入1.5 mL的0.1%(w/v) FeCl3显色,摇匀后,于700 nm处测定吸光值.空白参比为蒸馏水代替样品溶液,Vc作为对照组.吸光值越强表明寡糖的还原能力越强.
(5)脂质抗氧化[16]
取0.4 mL 10%蛋黄,加入50μL不同浓度样品溶液,再加入 50μL 40 mmol/L AAPH,混匀,37 ℃温浴1 h,再加入1 mL 10% TCA(三氯乙酸),1 mL 0.67% TBA(硫代巴比妥酸),50μL 2 mol/L盐酸,2 mL 0.1 mol/L PBS(pH=7.4),混匀,沸水浴15 min,立即放入冰水浴,冷却,5 000转离心10 min,取上清液,于532 nm处测吸光值A1,每个样品重复测定3次,取平均值.
脂质抗氧化能力计算按公式(4)进行:
(4)
式(4)中:A1-待测液在532 nm下的吸光值;A0-以H2O代替待测液在532 nm下的吸光值.
(6)ABTS自由基清除能力测定
参照Marcin等[17]改进后进行实验:以去离子水将ABTS自由基和过硫酸钾分别溶解14 mmol/L和4.9 mmol/L,等体积混合,在室温避光条件下静置.测定时,将ABTS自由基储备液以0.1 mol/L PBS溶液(pH=7)稀释,使其在734 nm处吸光度达0.70,形成ABTS自由基测定液.测定时将200 uL ABTS自由基测定液和50 uL不同浓度待测液加入到96孔板中,振荡30 s,测定反应20 min后于734 nm处的吸光值A1,以PBS为空白对照代替样品测量A0.ABTS自由基清除率计算按公式(5)进行:
(5)
式(5)中:A1-待测液在734 nm下的吸光值;A0-以H2O代替待测液在734 nm下的吸光值.
2 结果与讨论
2.1 枸杞多糖洗脱曲线
用蒸馏水、0.05 mol/L、0.10 mol/L、0.25 mol/L NaHCO3溶液分步洗脱,用自动部分收集仪收集洗脱样品,用苯酚-硫酸法分析,得图1所示洗脱曲线,得对应四个组分:LBP1、LBP2、LBP3、LBP4.
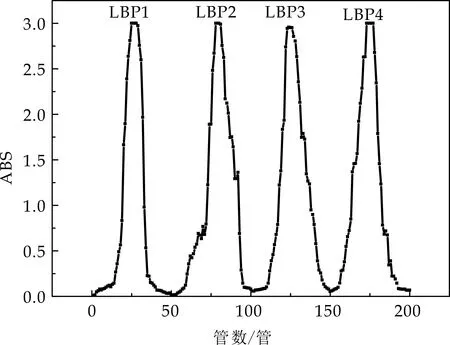
图1 枸杞多糖洗脱曲线
将所得各组分糖溶液冷冻干燥得到多糖组分,多糖得率计算按公式(6)进行:
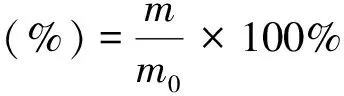
(6)
式(6)中:m-枸杞多糖LBP1-4各组分质量;m0-枸杞多糖LBP上样量.
计算得各枸杞多糖组分得率分别为0.012%、0.008%、0.007%和 0.015%.
2.2 枸杞多糖糖含量测定
图2为通过苯酚-硫酸法测得葡萄糖含量标准曲线,所得标准曲线对应方程为Y=10.57X+0.041 7,R2=0.999 3,在0~0.20 mg内线性关系良好.
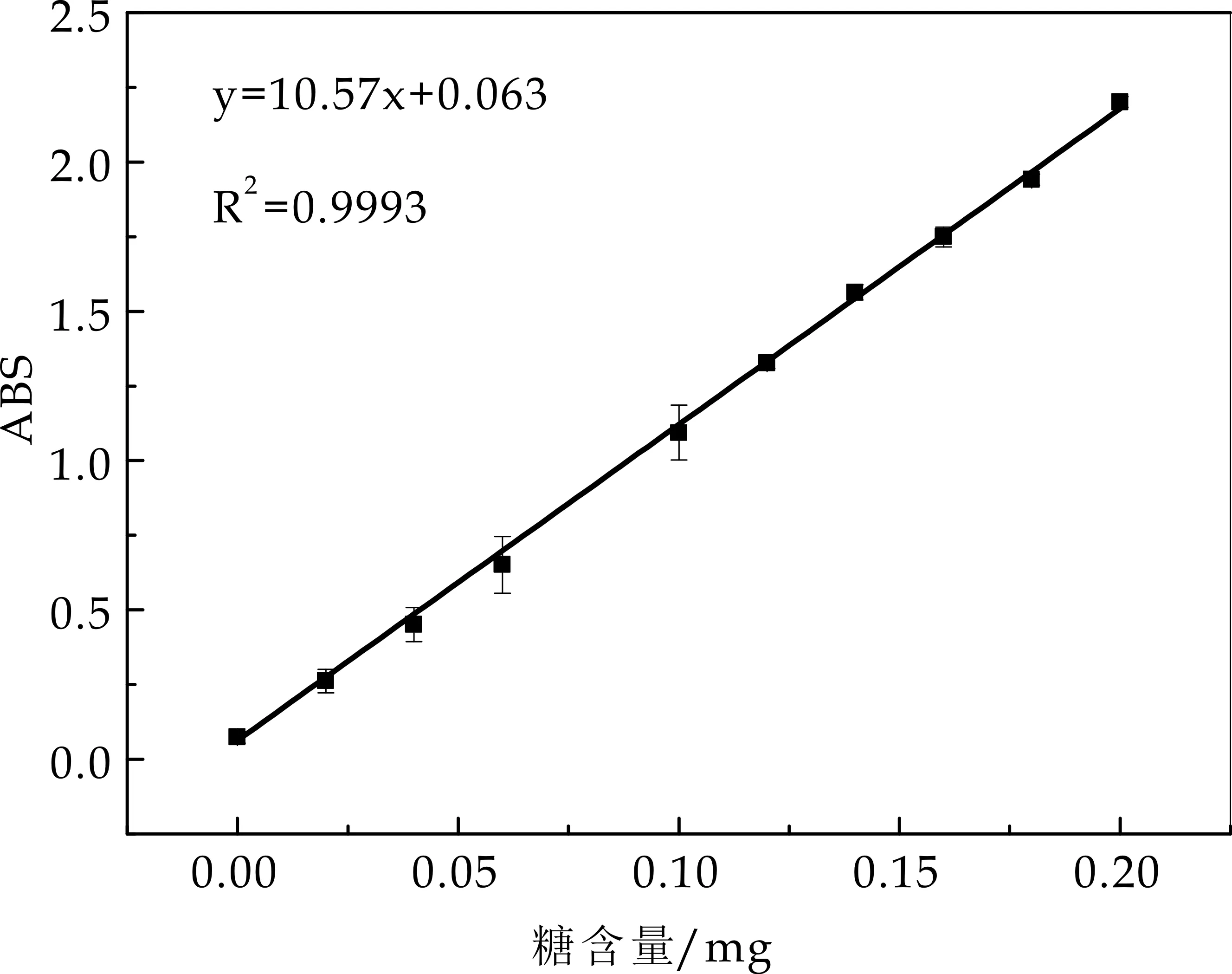
图2 苯酚-硫酸法测糖含量标准曲线
将枸杞多糖测得吸光值代入上述方程计算得各组分糖含量如表1所示.

表1 枸杞多糖各组分糖含量
2.3 枸杞多糖体外抗氧化
2.3.1 羟自由基清除能力的测定
由图3可知,枸杞多糖有显著的清除羟基自由基的能力,且表现出良好的剂量依赖关系.随着质量浓度的升高其清除能力增强,且羟基自由基清除效果增强,当多糖浓度达到3 mg/mL时,LBP1对羟基自由基清除率达65.81±1.31%,LBP2对羟基自由基清除率达77.13±1.14%,LBP3对羟基自由基清除率达76.50±0.92%,LBP4对羟基自由基清除率达74.15±0.89%,VC对羟基自由基清除率达62.58±0.44%.结合表2半数有效抑制浓度(IC50)分析可知,四种多糖羟自由基清除能力与VC比较,其能力由强到弱为LBP4>LBP3>LBP1>LBP2>VC.

表2 羟自由基清除半数有效抑制浓度
*代表有显著性差异(p<0.05)
2.3.2 超氧离子自由基清除能力的测定
由图4可知,枸杞多糖有显著的清除超氧离子自由基的能力,且表现出较好的剂量依赖关系.随着质量浓度的升高其清除能力增强,超氧离子自由基清除效果增强.当多糖浓度达到3 mg/mL时,LBP1对超氧离子自由基清除率达60.14±1.13%,LBP2对超氧离子自由基清除率达76.27±0.85%,LBP3对超氧离子自由基清除率达64.51±0.95%,LBP4对超氧离子自由基清除率达85.13±1.55%,结合表3半数有效抑制浓度(IC50)分析可知,四种多糖超氧离子自由基清除能力与VC比较,其能力由强到弱为:LBP4>VC>LBP2>LBP3>LBP1.
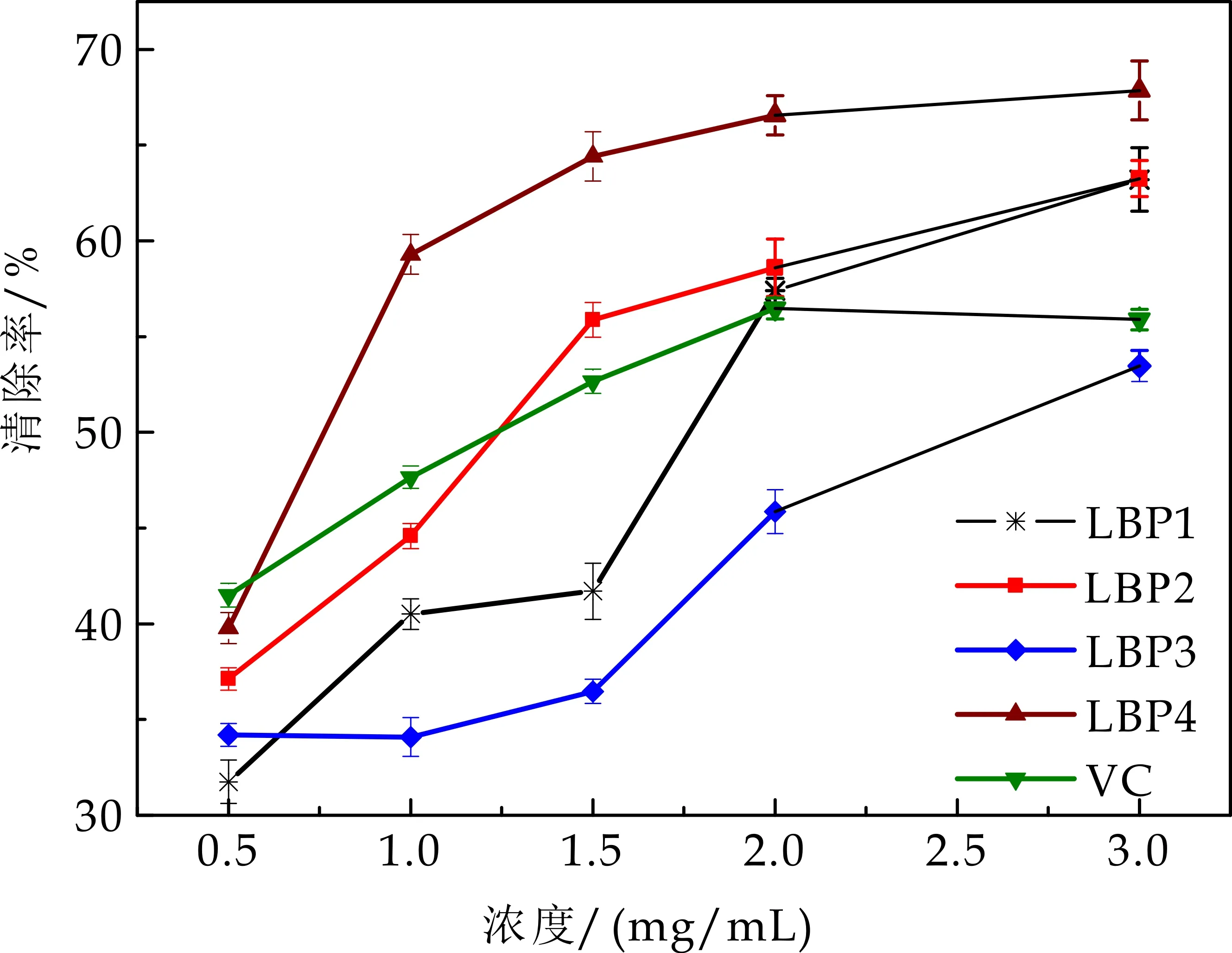
图4 超氧离子自由基清除能力评价
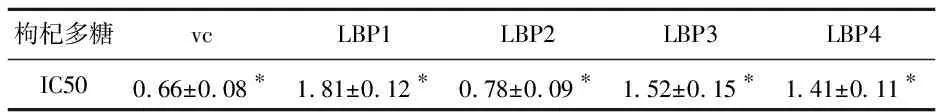
表3 超氧离子自由基清除半数有效抑制浓度
*代表有显著性差异(p<0.05)
2.3.3 DPPH自由基清除能力的测定
由图5可知,枸杞多糖对DPPH自由基有较好的清除能力,且表现出良好的剂量依赖关系.随着质量浓度的升高其清除能力增强.当多糖浓度达到3 mg/mL时,LBP1对DPPH自由基清除率达80.41±2.14%,LBP2对DPPH自由基清除率达50.13±1.58%,LBP3对DPPH自由基清除率达51.85±1.02%,LBP4对DPPH自由基清除率达52.29±0.78%.VC对DPPH自由基清除率达94.92±0.34%,结合表4半数有效抑制浓度(IC50)分析可知,四种多糖对DPPH自由基清除能力与VC比较,其能力由强到弱为:VC>LBP1>LBP3>LBP2>LBP4.
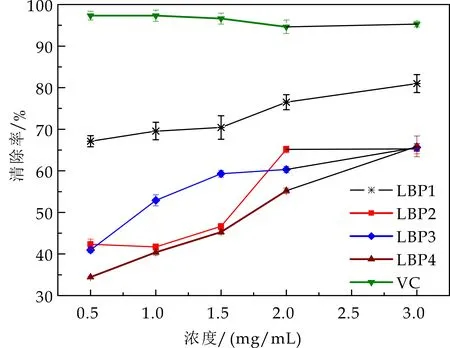
图5 DPPH自由基清除能力评价

表4 DPPH自由基清除半数有效抑制浓度
*代表有显著性差异(p<0.05)
2.3.4 还原力的测定
由图6可知,枸杞多糖有一定还原力,且LBP2表现出较好的质量依赖性,当多糖浓度达到3 mg/mL时,其还原力与VC近似,此时LBP1、LBP2、LBP3、LBP4、VC吸光值分别为0.135±0.34,2.946±2.41,0.909±0.78,1.433±1.13,2.896±2.87.
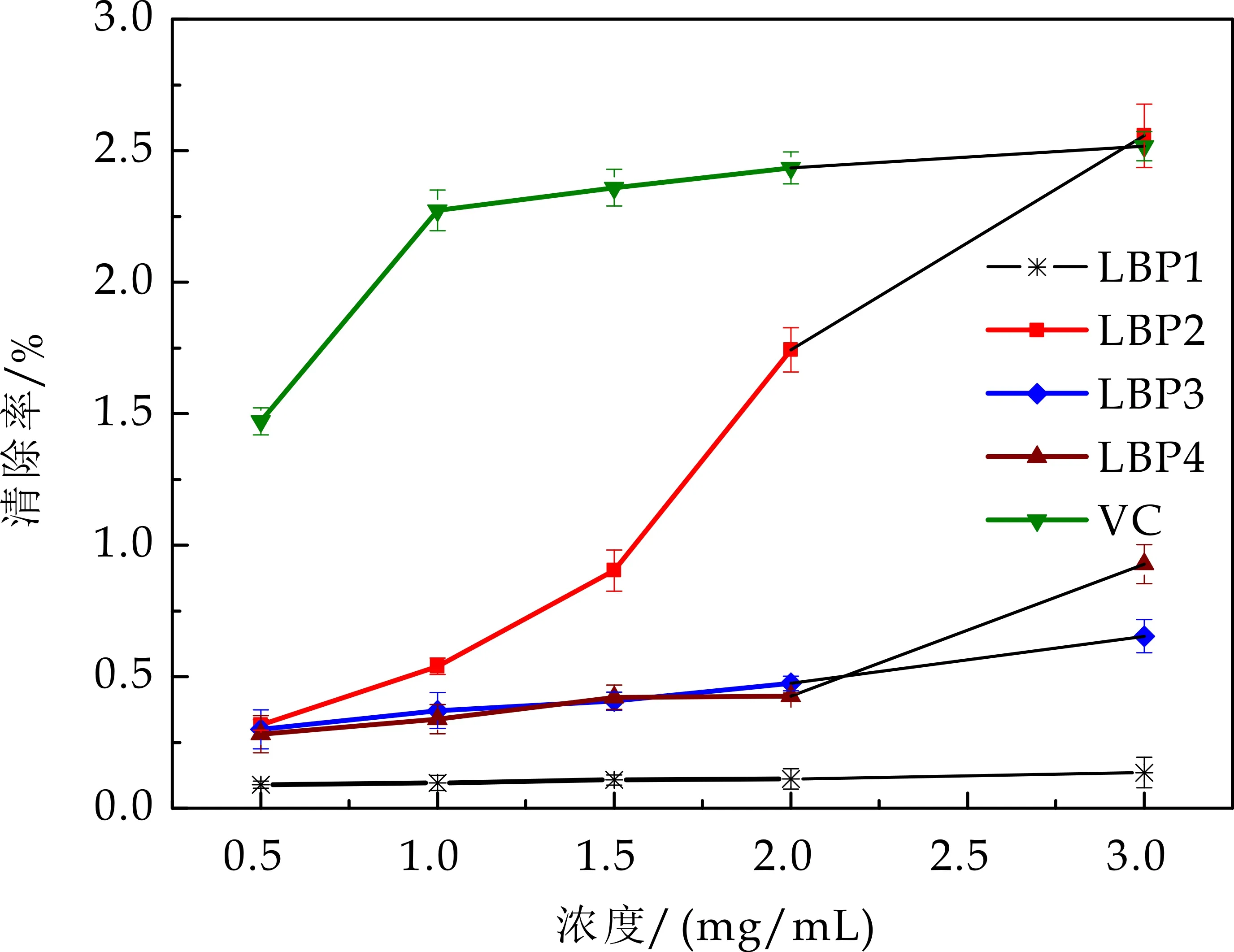
图6 还原力评价
2.3.5 脂质抗氧化能力的测定
由图7可知,枸杞多糖有良好的鸡蛋脂质抗氧化,且表现出良好的剂量依赖关系.随着质量浓度的升高其清除能力增强,当多糖浓度达2 mg/mL时,LBP1对鸡蛋脂质氧化物清除率达61.6%±1.55%,LBP2对鸡蛋脂质氧化物清除率达61.0%±2.15%,LBP3对鸡蛋脂质氧化物清除率达65.87%±1.46%,LBP4对鸡蛋脂质氧化物清除率达62.85%±1.57%,四组分对鸡蛋脂质氧化物清除能力相近.
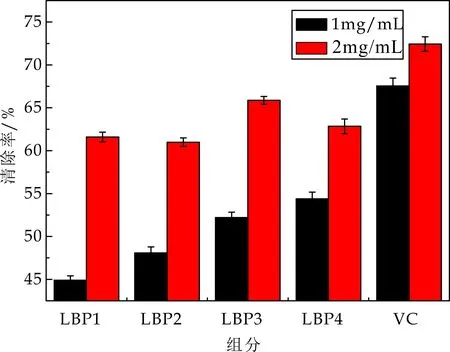
图7 脂质抗氧化清除能力评价
2.3.6 ABTS自由基清除能力测定
由图8可知,枸杞多糖对ABTS自由基有良好的清除能力.随着时间推进,溶液体系吸光值显著下降,表明枸杞多糖对ABTS自由基有一定清除能力,且随着浓度加大其清除能力明显增强;当LBP1浓度达0.4 mol/L时,其在60 min时对ABTS清除率可达56.1%;当LBP2浓度达0.4 mol/L时,其在60 min时对ABTS清除率可达62.7%;当LBP3浓度达0.4 mol/L时,其在60 min时对ABTS清除率可达63.2%;当LBP4浓度达0.4 mol/L时,其在60 min时对ABTS清除率可达52.9%,四个组分ABTS自由基清除能力相近.四组分纵向对比发现LBP3对ABTS自由基清除能力最强.
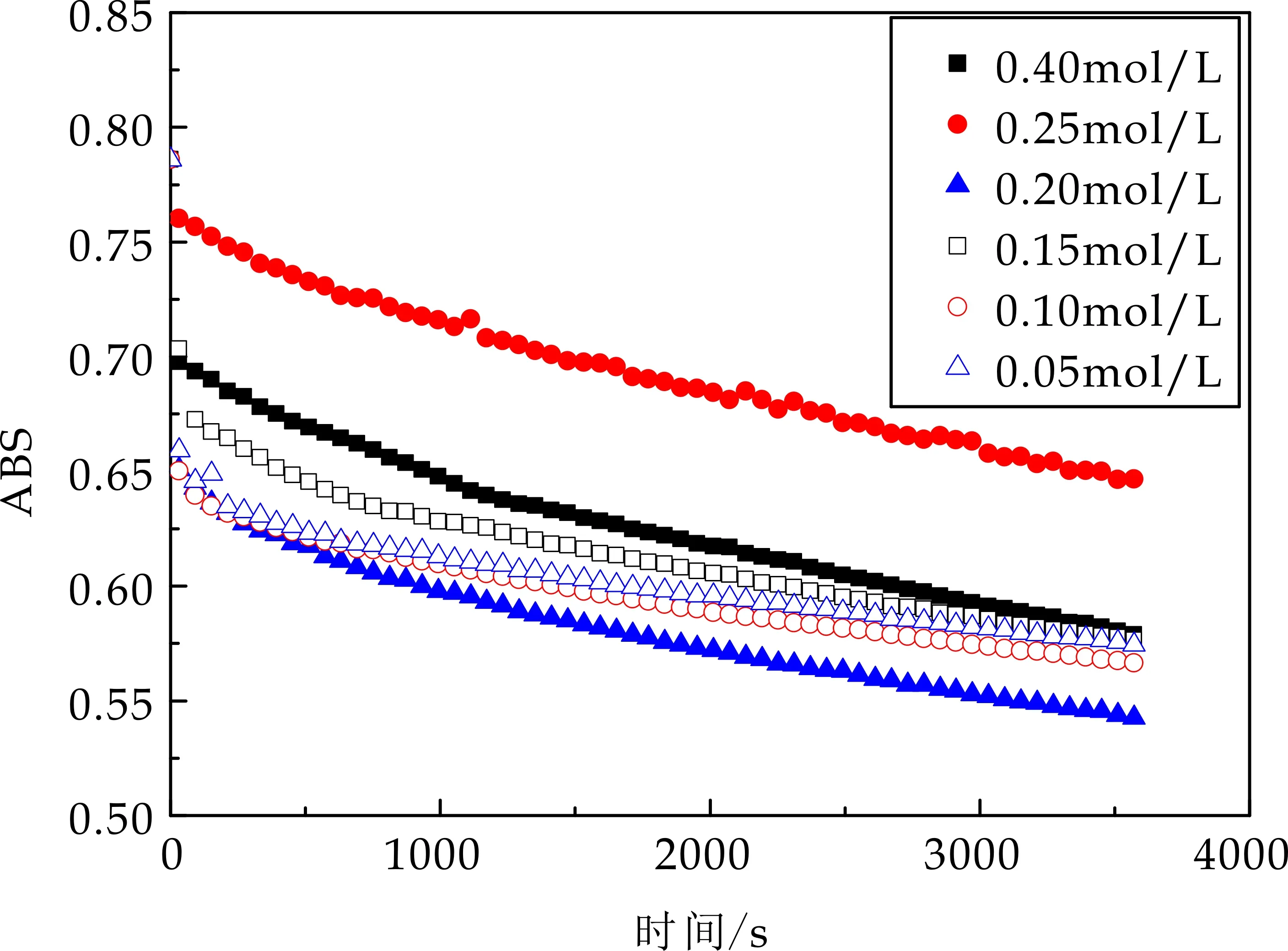
(b)LBP2 ABTS自由基清除能力评价
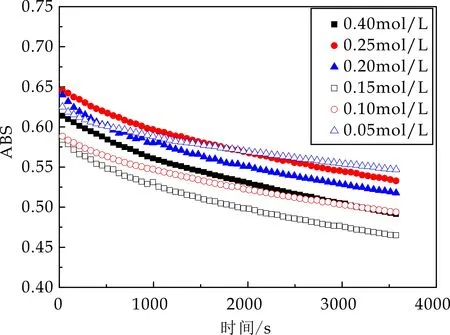
(c)LBP3 ABTS自由基清除能力评价
3 结论
细胞在正常的代谢和生长过程中产生的一系列活性氧(reactive oxygen species,ROS),如超氧阴离子(superoxide anion,·O2-)、羟自由基(hydroxyl radicals,·OH)和过氧化氢(hydrogen peroxide,H2O2)等是毒性很强的自由基,能诱导膜系统的氧化损伤,会使膜的通透性增加,从而对细胞造成损伤.近年来,天然抗氧化物质的研究开发成为热点,目前,从中药材提取活性多糖、黄酮、多酚类、维生素类等成分来清除氧自由基,抑制氧化应激受到广泛关注[18,19].
本文通过评估枸杞多糖对·O2-、·OH、DPPH和ABTS自由基的清除能力以及枸杞多糖的还原能力和脂质抗氧化活性,考察了4个枸杞多糖组分的抗氧化活性.研究结果表明,4个枸杞多糖组分对·O2-、·OH、DPPH和ABTS自由基有较好的清除能力,同时具有较好的还原能力与脂质抗氧化活性,有望被开发成天然抗氧化剂应用于食品与医药领域.相比于黄芪多糖、山药多糖、海带多糖等其他药食同源多糖,枸杞多糖表现出优越的抗氧化活性,常与其他具有抗氧化的多糖复合配伍,产生正协同效应,提高抗氧化活性[20-22].综上所述,鉴于枸杞多糖良好的抗氧化活性,后续研究将集中于其在更多真实食品体系的抗氧化能力评价,为枸杞多糖的深入开发利用提供理论依据.

