四磺化酞菁锌与白蛋白复合物的制备、光谱性质与光动力活性研究
张丽娟,郑碧远,李洪才,黄剑东*
(1.福建生物工程职业技术学院 药学系,福建 福州 350002;2.福州大学 化学学院,福建 福州 350116)

图1 ZnPcPS4的分子结构Fig.1 Molecular structure of ZnPcPS4
光动力疗法(Photodynamic therapy,PDT)作为一种新兴的癌症治疗手段,因独特的优点而显示出良好的临床应用前景[1-5]。酞菁因具有光敏化能力强、暗毒性低和易于结构修饰等优点,被广泛用作新一代抗癌光敏剂[6-9]。研究发现,酞菁配合物虽光敏活性较强,但对肿瘤组织的选择性和富集能力有限[10]。血清白蛋白是一种运载蛋白,可与许多化合物结合,在体内起到转运的作用,且对某些类型的癌细胞具有一定的靶向作用[11]。因此,研究酞菁配合物与白蛋白的相互作用及两者复合物的制备,对提高光敏剂的光敏活性和靶向性具有重要意义[12-14]。本课题组合成了具有光敏活性的1,8,15,22-四(4-磺酸基苯氧基)酞菁锌四钠盐(记为ZnPcPS4,结构式见图1)[15]。本文重点研究了ZnPcPS4与白蛋白的相互作用,制备了两者的非共价复合物,比较了复合前后光谱性质的变化,并研究了复合物对人肝癌细胞HepG2的光动力抑制作用,以期为构建具有靶向功能的酞菁基光敏剂提供参考。
1 实验部分
1.1 仪器与试剂
FL900/FS920型荧光光谱仪(英国Edinburgh公司);UV-2450 紫外可见分光光度计(日本Shimadzu公司);TCS SPE荧光共聚焦显微镜(德国Leica公司)。
牛血清白蛋白(BSA)和人血清白蛋白(HSA)均为北京鼎国昌盛生物技术公司产品;色谱柱所用填料为Sigma公司葡聚糖G-100凝胶;ZnPcPS4为本实验室合成,并经核磁共振、质谱和元素分析等表征确定。
1.2 磺化酞菁与白蛋白相互作用的光谱研究
1.2.1电子吸收光谱在室温下,取2.0 mL PBS溶液于1 cm石英比色皿中,滴加8 μL浓度为2 mmol·L-1的磺化酞菁溶液(终浓度为8 μmol/L),以PBS溶液为参比,对体系的电子吸收光谱进行测定,然后在上述体系中滴加一定浓度梯度的白蛋白溶液,考察体系中的电子吸收光谱变化情况[16-17]。
1.2.2稳态荧光光谱用移液器取2.0 mL白蛋白溶液于1 cm石英比色皿中,逐次滴加一定浓度的磺化酞菁溶液(累加体积小于220 μL,以减少体积变化引起的影响),依次测定混合溶液中的蛋白质荧光发射光谱,激发波长为280 nm,扫描范围为300~500 nm。记录白蛋白的荧光强度随酞菁浓度递增的变化幅度,计算结合常数和结合位点数。
1.2.3相互作用常数根据文献方法[18],在静态猝灭情况下,根据下式估算酞菁配合物与白蛋白的结合常数和结合位点数。
其中,F0为不存在猝灭剂(指磺化酞菁配合物)时蛋白质的内源荧光强度,F为加入猝灭剂后的荧光强度,CQ为猝灭剂的浓度,KA为结合常数,n为结合位点数。由线性关系作图,通过直线的截距和斜率分别求出酞菁配合物与蛋白质的结合常数KA和结合位点数n。
1.3 复合物制备
参照文献方法[19],通过温育交换法制备磺化酞菁锌与白蛋白的非共价复合物。磺化酞菁锌与白蛋白以一定的摩尔比在PBS缓冲溶液(pH 7.4)中混合均匀,于37 ℃下在气浴摇床上温育过夜后,通过G-100葡聚糖凝胶色谱分离纯化,以PBS缓冲液为流动相,由电子吸收光谱监控洗脱成分,收集复合物对应的洗脱组分,并通过冷冻干燥除去溶剂。复合物中白蛋白的含量通过考马斯亮蓝法(CBB法)测定,磺化酞菁含量则通过电子吸收光谱法测定(将其稀释于N,N-二甲基甲酰胺(DMF)溶液中,通过Q带的吸光度计算)。
1.4 离体光动力抗癌活性
按文献方法[20],将复合物ZnPcPS4-BSA先用PBS溶解,配制成约80 μmol/L的母液,然后过0.22 μm滤膜;ZnPcPS4则先溶于DMF中配制成1 mmol/L溶液,用PBS稀释至80 μmol/L,再用培养基稀释至相应的浓度进行实验。采用3-(4,5-二甲基噻唑-2)-2,5-二苯基四氮唑溴盐(MTT)法,检测磺化酞菁及其白蛋白复合物的离体光动力抗癌活性。
1.5 荧光成像法测试细胞摄取


图2 ZnPcPS4电子吸收光谱随BSA浓度的变化(A)及CBSA/CZnPcPS4比值与ZnPcPS4 Q带最大吸收强度的关系(B)Fig.2 Change in electronic absorption spectra of ZnPcPS4 with BSA concentration(A)and Q band maximum absorbance insentity of ZnPcPS4 with CBSA/CZnPcPS4(B)CZnPcPS4=8.0 μmol/L;CBSA:0,0.87,1.75,2.61,3.48,4.34,5.21,6.08,6.95,7.82,8.69,17.38 μmol/L;PBS solution

图3 ZnPcPS4对BSA荧光光谱的影响Fig.3 Change in fluorescence spectrum of BSA concentration with ZnPcPS4(excited at 280 nm)PBS buffer;insert:fitting curve of fluorescence quenching caused by ZnPcPS4;CBSA=20.4 μmol/L,CZnPcPS4=0,0.91,1.82,2.72,3.63,4.54,5.45,6.36,7.26,8.17,9.08 μmol/L
采用荧光共聚焦显微镜测试酞菁在细胞内的荧光成像情况。将处于对数生长期的HepG2细胞接种于放置有洁净无菌盖玻片的培养板中,每板约1×105~2×105个细胞,在37 ℃、5%CO2条件下培养24 h后,弃去旧培养基,分别加入400 μL含磺化酞菁及其白蛋白复合物(2 μmol/L)的培养基继续培养2 h后,用PBS洗涤细胞2次,再用400 μL PBS覆盖后进行荧光共聚焦显微镜拍照。光敏剂用635 nm激发,收集645~750 nm的荧光。图片用SPE ROI荧光分析软件进行处理,每个样品计数20个细胞的荧光强度。
2 结果与讨论
2.1 白蛋白对ZnPcPS4吸收光谱的影响
磺化酞菁ZnPcPS4在PBS溶液中存在单体和聚集体的平衡(图2A),表现在650 nm处有较强的聚集体吸收峰,692 nm处则为单体特征吸收峰。随着BSA浓度的增大,酞菁的存在状态由聚集体向单体转化,说明酞菁和BSA之间存在相互作用,而光敏剂以单体形式存在才能有效发挥其光敏活性。同时随着BSA的加入,ZnPcPS4的Q带最大吸收波长从692 nm红移至696 nm,光谱红移有利于光动力治疗。
图2B为酞菁ZnPcPS4在696 nm的吸收强度与CBSA/CZnPcPS4的关系图。从图中可见,当CBSA/CZnPcPS4=1时,ZnPcPS4在696 nm的特征吸光度接近最大,当浓度比大于1之后,随着BSA的加入,酞菁的特征吸光度增加缓慢,说明ZnPcPS4和BSA的非共价结合组成比可能为1∶1。另外,笔者发现,ZnPcPS4与HSA的相互作用和非共价结合比,均与ZnPcPS4和BSA类似。这说明可以用来源丰富且价格较低的BSA代替HSA,模拟酞菁与白蛋白的相互作用。
2.2 ZnPcPS4对白蛋白荧光光谱的影响
考察了酞菁ZnPcPS4对BSA内源荧光的影响。结果显示,在ZnPcPS4逐滴加入BSA溶液的过程中,BSA在340 nm的特征荧光强度呈规律性的减弱(见图3),这说明酞菁对BSA有一定的猝灭作用。BSA的最大荧光发射峰波长均发生蓝移,特征荧光峰的位置和强度发生了明显变化,表明ZnPcPS4与BSA之间存在较强的相互作用。实验考察表明,ZnPcPS4对HSA内源荧光的影响与BSA类似。
按照静态猝灭公式lg[(F0-F)/F]=lgKA+nlgCQ,对ZnPcPS4猝灭白蛋白荧光数据进行拟合,结果见图3插图。分别通过直线的截距和斜率,求出ZnPcPS4与白蛋白相互作用的结合常数KA和结合位点数n。ZnPcPS4与BSA的结合常数为6.72×106L/mol,结合位点数为1.30;ZnPcPS4与HSA的结合常数为4.36×106L/mol,结合位点数为1.30。KA值均较大,说明ZnPcPS4与白蛋白之间存在较强的相互作用。
近年来本课题组合成的酞菁锌与白蛋白的非共价结合常数和结合位点数见表1[21-22]。由表1可见,ZnPcPS4与两种白蛋白的结合能力最强,磺化酞菁与白蛋白的相互作用显著。十六羧基酞菁锌ZnPc(COOH)16比单羧基酞菁锌ZnPcC1的结合常数大,其与白蛋白的相互作用强于单羧基酞菁锌。结果表明,酞菁环上取代基的结构和数目对酞菁与白蛋白的相互作用能力有显著影响。

表1 酞菁和BSA(HSA)的结合参数Table 1 The parameters of complexes binding to BSA and HSA
2.3 ZnPcPS4在白蛋白中的结合位点
参照文献方法[23],应用竞争点位标记置换法研究了酞菁与白蛋白相互作用的结合位点。分别用氯化血红素(Hemin)、水杨酸钠(NaA)及布洛芬(ⅠB)作为蛋白质亚域ⅠB、亚域ⅡA(位点Ⅰ)和亚域ⅢA(位点Ⅱ)的竞争位点标记物。如图4所示,ZnPcPS4在PBS中的荧光强度较弱,而BSA的加入促使酞菁聚集体向单体转化,荧光强度显著增强。但将Hemin加至ZnPcPS4-BSA体系后,荧光强度大幅降低,在相同条件下,水杨酸钠和布洛芬则对ZnPcPS4-BSA体系的荧光光谱无影响。采用电子吸收光谱测定,也得到类似结果。这表明Hemin置换了与BSA结合的ZnPcPS4,即ZnPcPS4和BSA相互作用的结合位点主要为亚域ⅠB。

2.4 ZnPcPS4与白蛋白复合物的制备
以摩尔比约为4∶1将ZnPcPS4和牛血清白蛋白均匀混合,通过温育交换法制备复合物。图5为复合物ZnPcPS4-BSA在凝胶色谱中的分离洗脱曲线。其中,洗脱体积为12~18 mL时洗脱液呈绿色的组分既有696 nm的酞菁特征吸收峰,又有340 nm的白蛋白特征荧光发射峰,应为酞菁-白蛋白非共价复合物。采用相同方法制备ZnPcPS4-HSA复合物,其洗脱体积13~18 mL的馏分为复合物。

图5 ZnPcPS4-BSA复合物的流出曲线Fig.5 Elution profiles of ZnPcPS4-BSA conjugate as monitored absorbance at 696 nm and fluorescence emission at 340 nm upon excitation at 280 nm

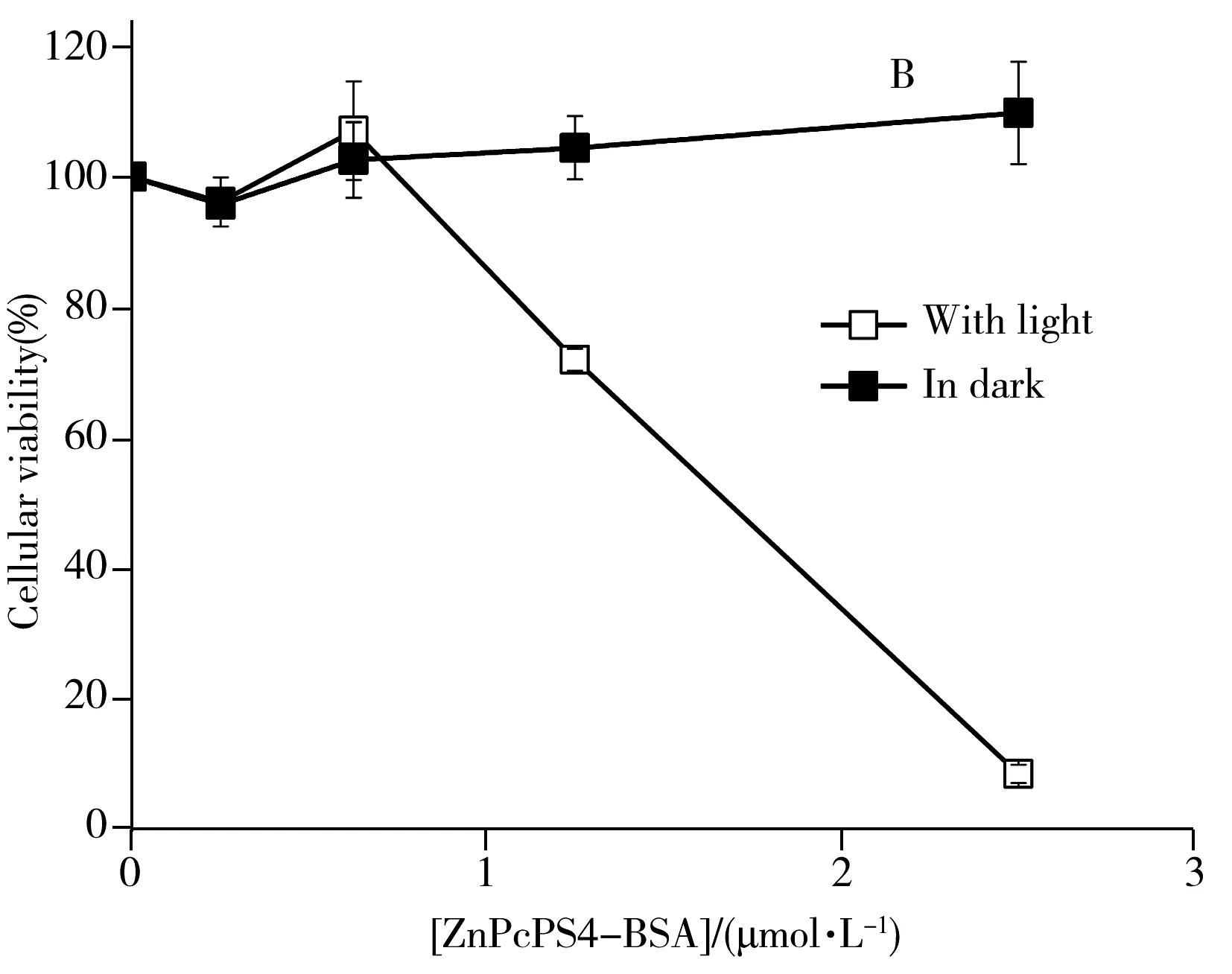
图6 ZnPcPS4(A) 和ZnPcPS4-BSA(B)对肝癌细胞HepG2的细胞毒性Fig.6 Cytotoxic effects of ZnPcPS4(A) and ZnPcPS4-BSA(B) conjugates on HepG2 cells
对于分离纯化后的非共价复合物,分别通过电子吸收光谱和考马斯亮蓝法测定酞菁ZnPcPS4和白蛋白的含量,求得复合物中酞菁和白蛋白的摩尔比约为1∶1。
2.5 复合物的光谱性质
以复合物 ZnPcPS4-BSA为例,比较了复合物ZnPcPS4-BSA(11.0 μmol/L)与游离ZnPcPS4(11.0 μmol/L)在PBS缓冲液中的电子吸收光谱。与游离的酞菁相比,复合物中酞菁的Q带吸收峰较强且相对尖锐,说明在复合物中酞菁主要以单体形式存在,聚集程度降低。ZnPcPS4-BSA的Q带吸收波长发生红移(从692 nm红移至696 nm),原因可能是酞菁和白蛋白相互作用,使酞菁环之间的π-π堆积程度降低,从而使酞菁部分解聚,单体酞菁含量增高。另外,由于波长越长的光越能够更好地穿透人体组织,因此光谱红移有益于光动力治疗。
2.6 离体抗癌活性研究
进一步比较了复合物ZnPcPS4-BSA和其对应的游离ZnPcPS4对人肝癌细胞HepG2的光动力抑制作用(图6)。在测试浓度内,化合物对HepG2细胞均无暗毒性,而在光照条件下,均对HepG2细胞具有明显的生长抑制作用,且抑制作用呈浓度依赖性。表明该化合物无化疗作用,只有在光激发下才产生毒性杀死癌细胞,采用特定波长的激光照射肿瘤组织,可靶向杀死癌细胞,减少副作用。复合物ZnPcPS4-BSA的IC50值仅为1.68 μmol/L,活性明显高于其对应的游离ZnPcPS4(IC50=2.73 μmol/L)。这说明复合物的抗癌活性比其对应的游离酞菁强。
为进一步研究导致ZnPcPS4 和ZnPcPS4-BSA抗癌活性出现明显差异的原因,利用荧光共聚焦显微镜研究了其细胞摄取。如图7所示,ZnPcPS4-BSA在细胞内的荧光强度明显强于其对应的游离ZnPcPS4,为后者的4.4倍。由于ZnPcPS4-BSA在生理条件下的Q带最大吸收强度仅比ZnPcPS4略大(增大不足2倍),因此它们在细胞内荧光强度的4.4倍差别也反映了其细胞摄取差异,即ZnPcPS4-BSA复合物被肝癌细胞摄取的能力明显高于单纯的ZnPcPS4,这可能是因为白蛋白可通过癌细胞表面受体进行主动转运。因此,复合物ZnPcPS4-BSA相比于游离ZnPcPS4具有较高的光动力抗癌活性,可归因于其具有更高的癌细胞摄取率。
3 结 论
本文通过电子吸收光谱和荧光光谱研究了α位四磺化酞菁锌ZnPcPS4与白蛋白的相互作用。结果表明,ZnPcPS4和白蛋白之间存在较强的相互作用,结合常数为106数量级,结合位点数为1.30,白蛋白可使ZnPcPS4的聚集体向单体转化。并通过温育交换法制备了ZnPcPS4和白蛋白的摩尔比约为1∶1的ZnPcPS4-BSA和ZnPcPS4-HSA复合物。光谱研究表明,ZnPcPS4与白蛋白复合后展现出比游离ZnPcPS4更明显的单体特征吸收峰,复合物的Q带最大吸收波长红移,这将有利于光动力治疗作用。复合物ZnPcPS4-BSA对HepG2细胞的光动力抑制效应结果表明,复合物ZnPcPS4-BSA的IC50值为1.68 μmol/L,活性明显高于其对应的游离ZnPcPS4,这可能是由于白蛋白对某些癌细胞的靶向性,使得复合物具有更高的癌细胞摄取率。研究表明该类复合物有望发展为具有靶向功能的抗癌光敏剂,为新型靶向抗癌光敏剂的开发提供有益参考。


