生物催化合成阿瑞吡坦关键手性中间体研究进展
,,,
(浙江工业大学 药学院,浙江 杭州 310014)
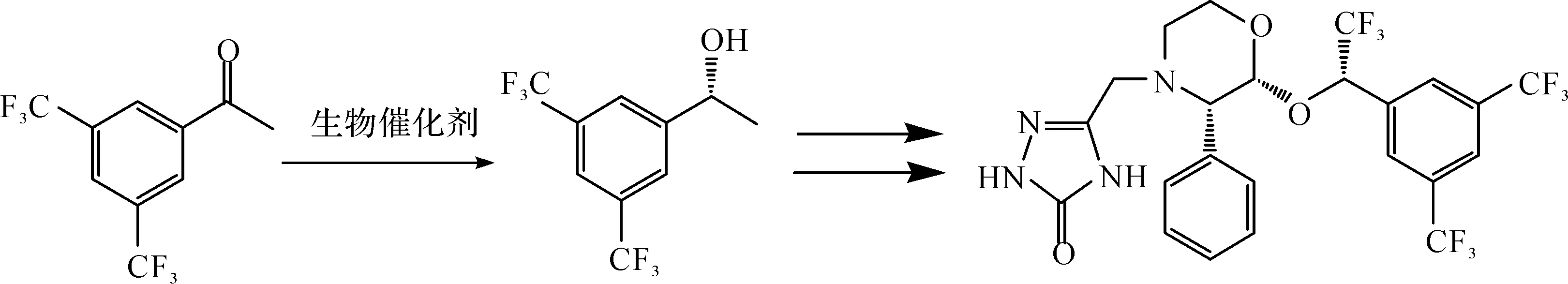
阿瑞吡坦(Aprepitant),商品名:Emend®,化学名称:5-[2(R)-[1(R)-[3,5-二(三氟甲基)苯基]乙氧基]-3(S)-(4-氟苯基)吗啉基-4-甲基]-3,4-二氢-2H-1,2,4-三唑-3-酮,是2003年由美国FDA批准上市的神经激肽-1(NK-1)受体抑制剂,可用于治疗肿瘤患者化疗相关性恶心呕吐(CINV),在癌症临床治疗中应用广泛,具有良好的市场前景[1].
(R)-3,5-双三氟甲基苯乙醇((R)-BTPE)是合成阿瑞吡坦药物的关键手性中间体,制备对映体纯(R)-BTPE在阿瑞吡坦合成工艺路线中至关重要.目前其合成方法主要包括化学催化不对称合成、手性源法、化学拆分法、色谱拆分法和生物不对称合成等[2].在化学催化不对称加氢还原法中,通常需使用昂贵的重金属如钯(Pd)、铑(Rh)和钌(Ru)等与配体形成的络合物作催化剂,反应条件较为苛刻,存在安全隐患以及产物中重金属残留等问题[3].目前也有文献报道了以酶或全细胞为催化剂,通过生物催化3,5-双三氟甲基苯乙酮(3,5-BTAP)不对称还原制备阿瑞吡坦关键手性中间体(R)-BTPE,包括微生物菌种筛选、重组工程菌构建和基于介质工程研究对反应过程的强化等.该方法反应条件温和,过程绿色环保,而且生物催化剂具有较高的立体选择性[4].笔者主要综述了酶催化制备(R)-BTPE,以及利用不同微生物细胞不对称还原3,5-BTAP制备(R)-BTPE的研究现状,概述了新型介质体系下生物催化制备(R)-BTPE的研究进展.
1 生物不对称还原制备(R)-BTPE
在生物催化3,5-BTAP不对称还原制备阿瑞吡坦手性中间体过程中,生物催化剂遵循反-Prelog规则不对称还原制得(R)-BTPE.由于大部分酶和微生物细胞遵循Prelog规则进行还原反应,因而从自然界中获得具有高立体选择性且遵循反-Prelog规则的生物催化剂存在一定的困难[5].生物催化制备路线为
生物催化3,5-BTAP不对称还原制备(R)-BTPE涉及氧化还原反应,反应过程中需要辅酶和酶共同完成催化反应.辅酶NAD(P)H参与的羰基化合物不对称还原的主要反应过程包括:辅酶和底物与酶结合,底物被还原而辅酶被氧化,辅酶和产物与酶分离.辅酶上的氢进攻羰基有两种方式,从si-面进攻形成(R)-醇,即遵循反-Prelog规则,从re-面进攻形成(S)-醇,则遵守Prelog规则,这取决于底物与酶的结合状态[6].辅酶NAD(P)H上氢传递到底物羰基的立体化学模式为
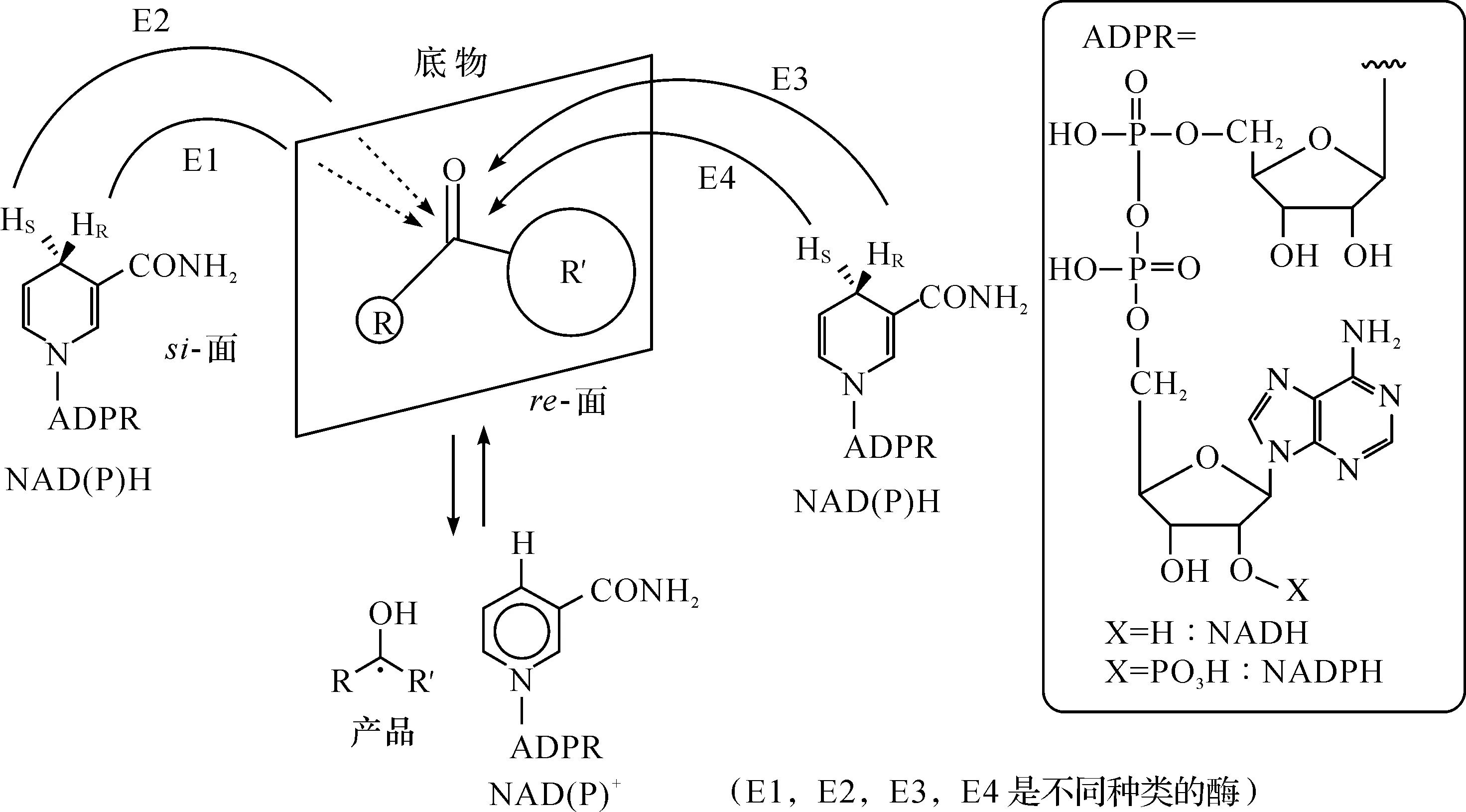
氧化还原酶的辅酶依赖类型主要有NADH,NADPH,FMN,FAD,辅酶不仅价格昂贵,而且稳定性较差.在构建生物不对称还原辅酶再生系统中,底物偶联法是最为简单、经济的方法,它只需在反应体系中添加一些醇或糖类作为辅助底物,就可实现辅酶的原位再生[7].
1.1 酶催化不对称还原制备(R)-BTPE
酶催化在不对称还原反应中具有较好的优势.酶在含有机溶剂反应体系中的稳定性不高,且游离酶重复利用较困难,采用固定化酶可有效解决上述问题.Li等[8]报道了利用酮还原酶(KRED)在正己烷为萃取剂的两相体系中进行3,5-BTAP的不对称还原制备(R)-BTPE,该反应过程得到了实际的工业应用.由于游离酶KRED易在有机溶剂中失活,难以回收利用,反应中容易形成乳化,导致产物难以分离,作者将KRED通过共价结合固定于聚合树脂EC-HFA,使酶在有机溶剂中具有较好的活性和操作稳定性,并且可以重复利用.固定化KRED用于连续反应系统中,在φ(正己烷)∶φ(异丙醇)∶φ(水)=50∶40∶10体系中,3,5-BTAP质量浓度为50 g/L,反应10 h产率为98%,e.e.值大于99%.固定化酶在连续反应系统中反应7 d,仍能保持94%的初始酶活性.
提纯酶催化不对称还原反应具有反应专一强、副产物少、产物易于分离纯化和反应易于连续化操作等优点,但反应体系中需要添加昂贵的辅酶因子NAD(P)H,成本较高.
1.2 微生物全细胞催化不对称还原制备(R)-BTPE
在氧化还原反应中,微生物细胞是较为理想的生物催化剂,细胞内含有多种氧化还原酶,酶在胞内环境中不易失活,可省去繁杂的酶分离纯化过程,反应过程中无需添加昂贵的辅酶因子NAD(P)H[9-10].目前已有文献报道了从土壤中筛选得到一些细菌和真菌菌株,能高选择性地催化3,5-BTAP不对称还原制备(R)-BTPE.
1.2.1 细菌催化不对称还原制备(R)-BTPE
细菌繁殖速度快,培养相对简单,可作为理想的生物催化剂.Wang等[11]以3,5-BTAP为唯一碳源,从土壤中筛选到可将3,5-BTAP高选择性地转化为(R)-BTPE的雷弗松氏菌(Leifsoniaxyli)HS0904.以葡萄糖为辅助底物,在pH 8.0的磷酸缓冲液中催化还原70 mmol/L的3,5-BTAP,反应30 h后产率为62%,e.e.值为99.4%.Ouyang等[12]进一步研究发现,以异丙醇作为辅助底物,可增加底物溶解性和改善细胞膜通透性,为还原3,5-BTAP最合适的氢供体.在最优条件下,催化的底物3,5-BTAP浓度提高到200 mmol/L,反应30 h,产率达91.8%,e.e.值为99.9%.盖萍等[5]筛选到一株氧化微杆菌(Microbacteriumoxydans)C3,能反-Prelog规则催化3,5-BTAP不对称还原,当底物质量浓度为5 g/L时,反应40 h,底物转化率为95%,e.e.值大于99%.利用该氧化微杆菌还原1-[3-(三氟甲基)苯基]乙酮和1-[4-(三氟甲基)苯基]乙酮等含氟苯乙酮衍生物同样有较好的对映体选择性和较高的转化率.
1.2.2 真菌催化不对称还原制备(R)-BTPE
与细菌相比,真菌胞内酶系统相对完善,产酶量高,生物催化不对称还原的应用较为广泛.同时,真菌培养基成分相对简单,仅需葡萄糖、酵母提取物、KH2PO4和蛋白胨;真菌在培养过程中不易被其他微生物污染;丝状菌丝体易从发酵液中分离获得.Li等[13]从土壤中分离获得一株能高立体选择性还原3,5-BTAP的棘孢木霉(Trichodermaasperellum)ZJPH0810,通过采用新型的乙醇和甘油作为双辅助底物系统,有效提高了该反应产率和e.e.值.在浓度为50 mmol/L的3,5-BTAP下,添加体积分数为6.0%的乙醇和体积分数为0.5%的甘油作为双辅助底物,产率为93.4%,e.e.值大于98%.Kurbanoglu等[14]利用微生物深层培养还原3,5-BTAP,从中筛选出高立体选择性的青霉菌(Penicilliumexpansum)EBK-9,可还原17 mmol/L的BTAP,产率为76.4%,e.e.值大于99%.
土壤是微生物资源的宝库,蕴含着大量的天然生物催化剂资源.尽管目前从土壤中筛选得到的细菌和真菌催化3,5-BTAP不对称还原的反应效率相对较低,尚不能满足工业应用需求,但这些微生物菌种为后续羰基还原酶的分子改造,构建有工业应用价值的重组工程菌提供了宝贵的信息库.
1.3 重组工程菌全细胞催化不对称还原制备(R)-BTPE
以从土壤中筛选得到的野生菌为催化剂催化还原潜手性酮制备手性醇,存在反应速率不高和底物负载量低等问题,限制了其应用.利用基因工程技术构建含羰基还原酶的重组大肠杆菌,同时共表达醇脱氢酶或葡萄糖脱氢酶,可实现3,5-BTAP的高效还原.
Wang等[15]以实验室筛选得到的可选择性还原3,5-BTAP的雷弗松氏菌(Leifsoniaxyli)HS0904为研究对象,分离提取胞内羰基还原酶,经纯化350 倍后比酶活力为13.2 U/mg,该酶是由24 kDa的亚基组成的同源二聚体,其分子量约为49 kDa.在此基础上从雷弗松氏菌基因组中成功克隆出羰基还原酶编码基因,实现了在大肠杆菌E.coliBL21(DE3)的异源表达,得到大肠杆菌粗酶液的比酶活为1.54 U/mg,为野生菌粗酶液比酶活(0.024 9 U/mg)的62倍.利用易错PCR和定点突变技术对重组酶进行分子改造,突变酶对3,5-BTAP表现出更高的催化活性.以突变后的重组大肠杆菌作为全细胞催化剂,可还原1 000 mmol/L的3,5-BTAP,反应12 h后产率可达82.5%,e.e.值大于99%[16].
Liu等[17]从土壤中筛选出能高效不对称还原3,5-BTAP为(R)-BTPE的金黄杆菌(Chryseobacteriumsp.)CA49,通过对短链脱氢酶的基因序列分析得到的基因序列在大肠杆菌中表达,得到具有高活性和立体选择性的酶ChkRED20.将冻干的重组酶用于不对称合成(R)-BTPE,在以异丙醇为辅助底物,150 g/L底物质量浓度下反应24 h,产率大于99%,e.e.值大于99%.
Chen等[18]利用基因挖掘技术将来源于Lactobacilluskefir的能高立体选择性还原3,5-BTAP为(R)-BTPE的羰基还原酶LkCR与来源于Bacillussubtili的葡萄糖脱氢酶BsGDH在大肠杆菌细胞中EscherichiacoliBL21(DE3)共表达,得到的重组大肠杆菌,全细胞不对称还原3,5-BTAP,在1.1 mol/L的底物浓度下,反应48 h,产率为96.9%,e.e.值大于99.9%,时空产率不理想仅为5.73 g/(L·h).为了提高催化效率,他们采用不同蛋白偶联的方式将LkCR的N-端与BsGDH的C-端用一条多肽连接,在构建的重组工程菌(E.coli/pET-BsGDH-ER/K(10 nm)-LkCR)还原3,5-BTAP,时空产率提高到29.7 g/(L·h),在1.2 mol/L底物浓度下反应10 h,产率为96.7%,e.e.值大于99%.该反应为生物法制备(R)-BTPE的最高水平.Yu等[19]通过基因挖掘,找到了能立体选择性还原3,5-BTAP的来源于Burkholderiacenocepacia的短链脱氢酶,其分子量为26 kDa,并在大肠杆菌中成功表达.
与野生菌相比,利用基因重组技术构建高效表达羰基还原酶的重组工程菌催化不对称还原3,5-BTAP,实现了在高底物浓度下,高选择性地制备(R)-BTPE.目前报道的几株重组工程菌催化3,5-BTAP的反应均具备工业化应用价值.表1为几株重组工程菌催化不对称还原3,5-BTAP制备(R)-BTPE水平比较.
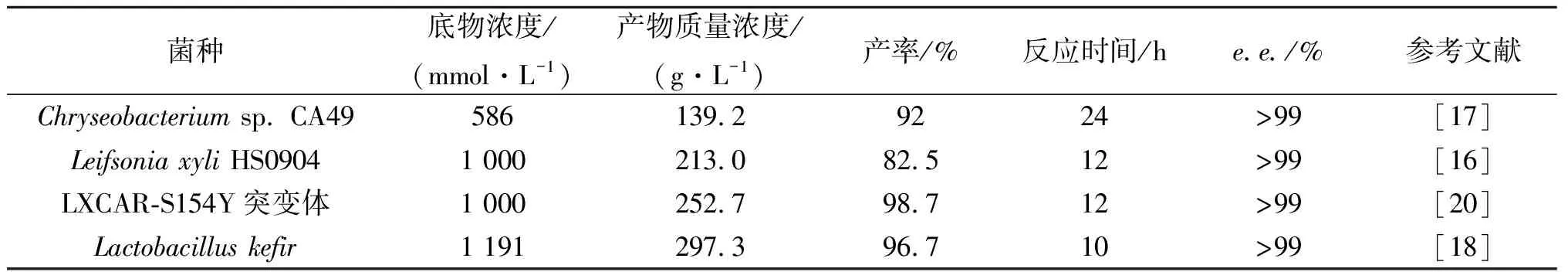
表1 重组工程菌催化不对称还原3,5-BTAP制备(R)-BTPE水平比较Table 1 Comparison of recombinant E.coli-catalyzed bioreduction of 3,5-BTAP to(R)-BTPE
2 酶催化拆分制备(R)-BTPE
除不对称还原外,利用生物催化动力学拆分也可制备得到(R)-BTPE.该方法是以外消旋体为底物,利用生物酶高选择性地对其中一种构型进行拆分,另一构型不被拆分,得到醇酯混合物,继而分离醇酯得到单一构型的手性醇.王亮等[21]利用少根根霉(Rhizopusarrhizus)脂肪酶对(R,S)-BTPE进行拆分,以乙酸乙烯酯作为酰基供体,底物浓度为100 mmol/L,40 ℃下反应30 min,转化率为50%,经分离纯化得到e.e.值接近100%的(R)-BTPE.
3 新型介质体系下的全细胞催化不对称还原制备(R)-BTPE
生物催化反应中,底物多为非天然化合物,其自身在水相的难溶性以及高底物浓度对催化反应的抑制成为限制生物催化反应效率的主要因素.3,5-BTAP为水难溶性化合物,Ouyang等测得3,5-BTAP在0.2 mol/L pH8.0磷酸盐缓冲液中的溶解度为0.017 3 g/L,在水中溶解度为0.024 1 g/L,反应体系中加入辅助底物异丙醇具有底物增溶作用[12].此外,通过构建合适的反应介质体系,也是解决限制催化反应效率的关键所在.通常在由疏水的有机溶剂或离子液体构成的两相体系中进行反应,来解除底物和产物对反应的抑制.或者在反应体系中添加一些表面活性剂或亲水性离子液体作为共溶剂,增加底物在水相中的溶解度,改善细胞膜的通透性,以强化过程的传质[22].
近年来已有一些关于基于介质工程的全细胞催化3,5-BTAP不对称还原的研究报道.Li等[23]设计了四甲基铵[N1,1,1,1]与半胱氨酸[Cys]组合成的离子液体[N1,1,1,1][Cys],将其作为共溶剂引入棘孢木霉(T.asperellumZJPH0810)催化不对称还原3,5-BTAP制备(R)-BTPE的反应介质中,[N1,1,1,1][Cys]在不对称还原过程中具备强化辅酶再生功能,在含离子液体的反应介质中,有效提高了反应中的底物耐受性,提高了反应产率.同样Wang等[20]将[N1,1,1,1][Cys]作为共溶剂用于重组大肠杆菌催化不对称还原3,5-BTAP制备(R)-BTPE的反应中,[N1,1,1,1][Cys]具有较好的生物相容性,能适当增加细胞膜通透性,在含[N1,1,1,1][Cys]的反应介质体系中,1 mol/L的底物浓度下反应12 h,产率由缓冲液体系中的82.5%提高到99%,e.e.值大于99%.
4 结 论
(R)-BTPE是合成阿瑞吡坦药物的重要手性中间体,目前采用的化学催化不对称合成法制备工艺存在反应条件苛刻、需要昂贵的手性催化剂和环境不友好等缺点.以从土壤中筛选得到的一些细菌和霉菌细胞作为催化剂,能高效催化3,5-BTAP不对称还原制备(R)-BTPE,该法具有立体选择性好、收率高、制备工艺安全和环保等优点.特别是构建的重组大肠杆菌细胞催化的不对称还原反应可获得较高的产物浓度,具有较好的工业化应用价值.今后还可通过分子生物学和蛋白质工程等技术不断对生物催化剂进行改造,提高催化效率,解决生物催化反应中底物负载量低、反应速率慢等问题.此外,介质工程的研究也为解决生物催化反应中存在的上述问题提供了新途径.

