EGCG抑制HBV复制的分子机理研究
王平 刘国辉 詹森林 袁静 吴其恺
518112深圳市第三人民医院
表没食子儿茶素没食子酸酯(epigallocatechin gallate,EGCG)是绿茶中茶多酚的主要组成成分。在干的绿茶叶子中,EGCG的含量占据所有茶多酚的59%左右[1]。EGCG具有广谱抗病毒作用,可有效抑制乙肝病毒(hepatitis B virus,HBV)、丙肝病毒(hepatitis C virus,HCV)、登革病毒(dengue virus,DENV)、基孔肯雅病毒(chikungunya virus,CHIKV)、寨卡病毒(zika virus,ZIKV)、EB 病毒(Epstein-Barr virus,EBV)、人类免疫缺陷病毒(human immunodeficiency virus,HIV)等多种病毒的复制[1]。 在抗 HBV方面,有研究报道,EGCG可阻止 HBV与其受体NTCP 结合[2],并抑制 HBV DNA 复制、HBV RNA 和HBV cccDNA合成等多个过程[3-4]。然而,EGCG调控宿主细胞因子,进而抑制HBV复制的分子机理却鲜 有 报 道[5]。 HNFs(hepatocyte-enriched nuclear factors)是宿主肝细胞中调控基因表达的一类转录因子的总称。有研究报道,在众多的HNFs蛋白亚型中,HNF4α在HBV复制的细胞模型中表达上调,并促进HBV的复制[6]。考虑到EGCG可调控基因转录[7-9],此次研究了EGCG对HNF4α表达的影响以及HNF4α在EGCG介导的抗HBV信号通路中的作用。研究发现:(1)EGCG显著下调HepG2.2.15细胞中HNF4α的表达;(2)在Hep.2.15细胞中,利用siRNA沉默HNF4α的表达,显著降低HBV DNA的含量;(3)在 siRNA介导的 HNF4α沉默的细胞中,EGCG对HBV复制的抑制作用变弱。综上所述,本研究提示,EGCG通过下调HNF4α的表达可能是其发挥抗HBV作用的一种重要途径。
1 材料与方法
1.1 材料 EGCG(CAS:989-51-5)购自百灵威科技公司;CCK-8检测试剂盒(C0037)购自Beyotime公司;GAPDH 抗体 (#5174)和 HNF4α 抗体(#3113)购自 Cell Signaling Technology公司;特异沉默 HNF4α 编码基因的 siRNA(siRNA ID:144546)和对照 siRNA(siRNA ID:142980)采购自 Thermo Fisher公司;引物购自上海生工;逆转录试剂和荧光定量PCR试剂购自TaKaRa公司;DMEM培养基、胎牛血清(FBS)、青霉素和链霉素、胰蛋白酶、Opti-MEM培养基、转染试剂 lipofectamine 2000购自Thermo Fisher公司;细胞培养板购自康宁公司。
1.2 Hep G2.2.15细胞的培养 HepG2.2.15细胞接种于DMEM细胞培养基(DMEM+10% 胎牛血清+1% 青霉素和链霉素)中,置于37℃ 5%CO2细胞培养箱中培养。
1.3 EGCG处理Hep G2.2.15细胞 EGCG溶解于DMSO中,4℃ 避光保存。HepG2.2.15细胞培养24 h后,去除细胞培养基,并用PBS洗两遍。在细胞培养板中加入含有25μmol/L EGCG的DMEM细胞培养基,于37℃细胞培养箱中培养48 h,分别收集细胞培养基和细胞备用。
1.4 基因沉默实验 将HepG2.2.15细胞接种于不含抗生素的DMEM培养基中(DMEM+10%FBS)培养12 h,用PBS缓冲液清洗细胞两次后将细胞培养基换成Opti-MEM。每个12孔中Opti-MEM的体积为0.5 ml。在细胞转染时,每个孔的siRNA用量为80 pmol,lipofectamine 2 000的用量为1.5 μl。加入转染试剂后,在37℃ 细胞培养箱中培养6 h,然后在每个孔中补加Opti-MEM,至终体积1 ml。继续在37℃ 细胞培养箱中培养细胞48 h后,分别收集细胞和培养基,进行下一步实验。
1.5 HBV病毒颗粒的纯化和检测 HBV病毒颗粒的纯化参照前人发表的文章[10]。根据HBV病毒颗粒在细胞内和细胞外分布的不同,HBV DNA的提取步骤稍有不同。细胞培养基中HBV病毒颗粒的纯化步骤如下:收集细胞培养基,2 000×g离心力的条件下,室温离心2 min,去除细胞残渣。在500 μl的细胞培养基中,加入等体积的沉淀剂(20%PEG 8000 +1.5 mol/L NaCl),4 ℃过夜沉淀,16 000×g离心30 min,所得沉淀即含有HBV颗粒。将HBV 颗粒重悬于缓冲液中(40 mmol/L Tris-HCl,pH 8.0,10 mmol/L MgSO4,1 mmol/L CaCl2),并加入DNase I(终浓度为2U),37℃水浴加热30 min后,65℃加热10 min。在上述溶液中加入10%体积的2%的 SDS和蛋白酶 K(终浓度为 0.5 mg/ml),55℃ 水浴加热1 h后,用磁珠法纯化HBV DNA(详见天根磁珠纯化试剂盒DP710说明书)。细胞中的HBV病毒颗粒的纯化方法如下:细胞经RIPA裂解液(碧云天)裂解后,于12 000×g离心力下离心30 min,取上清液200μl,加入等体积的沉淀剂沉淀。后续操作与培养基中HBV颗粒的纯化方法相同。通过荧光定量PCR的方法检测HBV DNA的含量。HBV特异性引物序列参照文献[10],具体序列如下: HBV-f(5’-AGTGTGGATTCGCACTCCT-3’),HBV-r(5’-GAGTTCTTCTTCTAGGGGACCTG-3’)。PCR反应体系和方法参照TaKaRa公司SYBR Premix Ex Taq试剂盒说明书。
1.6 RNA的提取、逆转录以及HNF4αmRNA水平检测 本研究中,采用相对荧光定量PCR的方法,检测 HNF4α在转录水平的相对含量。利用TRIZOL试剂提取细胞中的总 RNA,经逆转录(TaKaRa,RR047a)合成cDNA。荧光定量 PCR所用的引物序列参照文献[6],具体序列为:HNF4α-f(5’-CAGGACCCACCAGACACGTC-3’), HNF4α-r(5’-TCGAGGCACCGTAGTGTTTG-3’), GADPH-f(5’-GATTCCACCCATGGCAAATTCCA-3’), GAP DH-r(5’-TGGTGATGGGATTTCCATTGAT GA-3’)。荧光定量PCR参照TaKaRa荧光定量PCR试剂(RR82LR)说明书进行。
1.6 Western blot实验 细胞经RIPA裂解液裂解后,4℃,16 000×g离心30 min。利用12%的SDSPA GE胶分离蛋白质并转移到PVDF膜上。用含有5%脱脂牛奶的PBS过夜封闭。一抗按照1∶1 000的比例稀释,二抗按照1∶5 000的比例稀释,经过显色、曝光、压片步骤后,检测 HNF4α、GAPDH的含量。
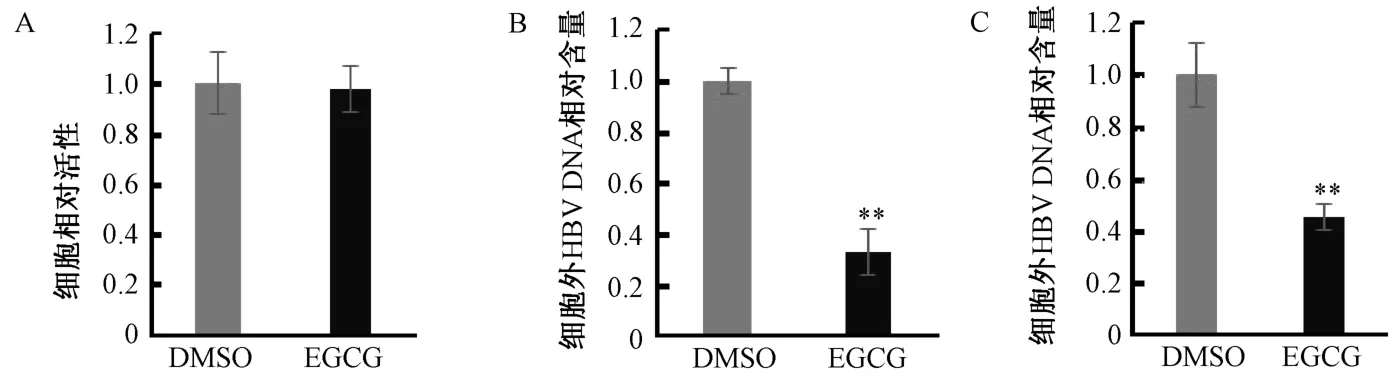
A:细胞活性实验(CCK-8);B:细胞内HBV DNA相对含量(QPCR);C:细胞外HBV DNA相对含量(QPCR)图1 EGCG处理降低细胞内外HBV DNA的含量A: Cell viability was analyzed by CCK-8 Kit; B and C: In vivo and in vitro HBV DNA level was tested by QPCRFig.1 EGCG treatment significantly decrease HBV DNA amount both in vivo and in vitro
2 结果
2.1 EGCG显著抑制HBV复制 首先研究EGCG对HepG2.2.15细胞复制的影响。如图1 A所示,与对照组(DMSO)相比,经25μmol/L的 EGCG处理48 h后,细胞活力不受影响。实验结果表明,25 μmol/L的 EGCG对 HepG2.2.15细胞没有毒性。接下来研究EGCG对HBV复制的影响。如图1B和1C所示,与对照组相比,EGCG处理HepG2.2.15细胞48 h后,细胞内外HBV DNA的含量显著下降,表明EGCG显著抑制HBV复制。
2.2 EGCG显著下调HepG2.2.15细胞中HNF4a的含量 研究表明,在HBV复制的肝细胞中,转录因子 HNF4α表达上调并促进 HBV DNA复制[6]。考虑到EGCG可调控基因转录,且EGCG调控HNFs的研究尚未有报道,此次研究了EGCG对转录因子HNF4a的调控作用。如图2 A和2B所示,分别利用荧光定量 PCR和 Western blot方法检测了HepG2.2.15细胞中HNF4αmRNA和蛋白表达水平。研究发现,EGCG处理显著降低HNF4α的表达,表明EGCG处理可显著下调宿主细胞中HNF4α的表达。
2.3 沉默HNF4a编码基因的表达导致EGCG抗HBV作用减弱 进一步研究了HNF4α在EGCG介导的抗HBV信号通路中的作用。利用siRNA沉默HNF4α的表达后,研究了HNF4a沉默表达对EGCG抗HBV作用的影响。如图3 A和图3B所示,沉默HNF4α的表达后,EGCG抗HBV复制作用显著减弱,表明EGCG通过下调HNF4α的表达,抑制HBV复制。

A:利用荧光定量PCR方法检测HNF4αmRNA相对含量;B:利用Western Blot检测HNF4α的蛋白表达水平图2 EGCG下调HepG2.2.15细胞中HNF4α的表达A:HNF4α mRNA expression was tested by QPCR;B:Western Blot was used to test HNF4α protein expressionFig.2 EGCG treatment down regulates HNF4αexpression in HepG2.2.15 cells

A:利用siRNA沉默HNF4a的表达;B:沉默HNF4α基因表达后,用荧光定量PCR方法检测细胞内外HBV颗粒中DNA的含量图3 沉默HNF4a基因表达后EGCG抗HBV作用显著减弱A: HNF4α knock down was tested by western blot;B:HBV titers level was tested by QPCRFig.3 EGCG mediated anti-HBV role decreased significantly upon HNF4a knock down
3 讨论
作为绿茶中含量最多的茶多酚,EGCG具有广谱抗病毒作用。EGCG抑制HBV DNA复制作用,此前已经有大量文献报道。比如,Xu等[4]以HepG2-N10为细胞模型,研究了EGCG的抗HBV作用。研究发现,EGCG处理可显著抑制HBV的复制和转录并降低HBsAg和HBeAg的含量。亦有研究者发现,低浓度的EGCG 可抑制 HBV mRNA转录[3],阻止HBV颗粒进入细胞[2],或通过改变细胞微环境,阻止HBV复制[11]。然而,上述有关EGCG抗HBV作用的研究对象多集中病毒层面,很少涉及到EGCG对宿主细胞内在因子的影响。有研究发现,HCV非结构蛋白NS5A与HSC70相互作用,并招募HNF1α形成复合体结构,进而调控HNF1α的表达和以及HCV的复制[12]。在这一过程中HNF1a是促进HCV复制的关键细胞因子。考虑到EGCG同时具有抗 HCV作用[13],且在乙肝细胞模型中,HNF1α与HNF4α协同作用,此次研究了HNF4α在EGCG抗HBV信号通路中的作用。
HNF4α是HNFs家族成员中唯一的促进HBV复制 的 转 录 因 子[6]。 Raney 等[14]研 究 发 现, 在HepG2.1细胞中过表达HNF4α,可使HBV preS1转录水平提高9倍。而Yu等[15]研究发现,在肝细胞HuH7中,过表达HNF4α则会增加pgRNA的表达至原来的14倍。这些研究显示,HNF4α是细胞中重要的抗HBV因子。本研究利用HBV复制的细胞模型HepG2.2.15,研究了EGCG对HBV复制的影响。研究发现 EGCG可下调 HNF4α表达,并且抑制HBV DNA复制。利用siRNA沉默HNF4α的表达后,EGCG介导的抗 HBV作用几乎消失,表明HNF4a是EGCG抗HBV信号通路中的重要细胞因子。 利用基因敲除实验,Yu等[15]发现,HNF4α 可结合到HBV的基因组上,进而调控基因表达。其中HBV基因组上preS1和核心蛋白的两个编码区(nt1992-2435和 nt2830-3068)是 HNF4α的结合位点[16]。这一结果提示,EGCG介导的HNF4a的表达下调,可能会减少HNF4α与HBV基因组结合,进而降低HBV基因的转录,相关实验正在开展中。值得注意的是,EGCG在细胞中稳定性是限制其成药的一个重要的因素,因此科学工作者开发了大量的EGCG类似物以增加其稳定性[1]。这些EGCG类似物是否具有更好的抗HBV作用,未来值得探索。另外,考虑到EGCG的毒副作用较小,我们拟在接下来的工作中探索EGCG和核苷类药物联合用药的可能性。
利益冲突 无

