引起某禽类养殖场疫情的H3N2亚型流感病毒全基因组进化分析
徐春雪 刘伟 焦伯延 王震 刘倜 孙林 张钦凤 王显军
271000泰安,泰山医学院(徐春雪、张钦凤);272000济宁市疾病预防控制中心(刘伟、焦伯延);272100济宁市兖州区疾病预防控制中心(王震);250014济南,山东省疾病预防控制中心山东大学预防医学研究院山东省传染病重点实验室(徐春雪、刘倜、孙林、王显军)
H3N2流感病毒能引起季节性流行,抗原变异频繁、传染性强,经常发生抗原漂移或抗原转变,每隔2~3年在人群中流行一次,造成人群感染,甚至造成死亡[1]。在某些情况下季节性H3N2流感病毒能与其他种属流感病毒发生基因重组,产生新的流感亚型,引起暴发、流行,甚至流感大流行。H3N2流感病毒不仅感染人,也能感染禽和猪并导致发病[2]。1998年在美国猪群中流行的H3N2猪流感病毒是人、猪和禽间的三源重组病毒[3];2012年在美国人群中流行的H3N2猪流感变异株含有甲型H1N1流感病毒的M基因片段,至少导致400人感染[4]。H3N2流感病毒定期会有一定的流行,而疫苗株对已经发生抗原突变的菌株不能产生有效的保护,因此对流行病毒株的分子变化进行监测至关重要。2015年9月监测到山东省一禽类养殖场工人间发生1起流感样病例(influenza-like illness,ILI)暴发疫情,为了解所致病原及其变异特点,本研究开展了流行病学调查、病毒分离、全基因测序和进化分析。
1 材料与方法
1.1 病例定义 ILI定义:发热(体温≥38℃),伴咳嗽或咽痛之一者。暴发疫情的定义:指同一地区或单位内在较短时间内出现异常增多的流感样病例。
1.2 流行病学调查 2015年9月3日,山东省某市报告一起在禽类养殖场工人间的流感样病例暴发疫情,现场调查包括对所有从业人员进行登记、对病例进行个案调查、对密切接触者进行医学观察、调查该禽类养殖场基本信息、养禽情况、人员流动情况、采集标本等。暴发调查按照中国疾病预防控制中心《流感样病例暴发疫情处置指南》[5](2012年版)开展。
1.3 标本采集及PCR检测 规范采集所有ILI的咽拭子标本,立即送实验室提取标本RNA(RNA提取试剂盒:Qiagen 74104),应用荧光定量RT-PCR试剂盒(Qiagen 204443)开展流感病毒亚型鉴定检测,包括甲型流感、乙型流感、甲型 H1N1流感病毒、H3N2流感病毒及禽流感H5、H7和 H9亚型。引物、探针按照中国疾病预防控制中心发布的《全国流感监测技术指南》提供的序列在上海生工进行合成,荧光定量RT-PCR反应体系及反应条件均按照《全国流感监测技术指南(2012版)》提供的方案进行。
1.4 病毒培养及鉴定 在BSL-2级实验室内将处理好的核酸检测阳性标本0.5~1 ml,接种于75%~90%单层成片生长MDCK细胞,收集病毒液,用1% 人“O”型血红细胞进行血凝试验(HA),检测病毒的存在及滴度。HA≥8的病毒液做血凝抑制试验(HI)测定滴度及用国家流感中心下发的流感鉴定试剂盒进行分型鉴定;HA<8的培养液继续盲传二代细胞培养。
提取分离到的流感病毒RNA,利用Promega反转录试剂盒(Promega A3500)反转录成cDNA后直接送至上海生工进行二代全基因组测序。测序完成后对序列进行拼接,运用EditSeq和MEGA5.05软件对流感病毒基因核苷酸序列进行比对和分析,核苷酸序列来源于GISAID及NCBI数据库。采用MEGA5.0中自带的Clustal W软件进行比对,采用邻接法(Neighbour-Jioning)法构建种系进化树,比较分析变异情况,Bootsrap检验重复值设为1 000。以WHO推荐的 2015—2016年流感疫苗株 A/Switzerland/9715293/2013(H3N2)[6]作为参考毒株。
2 结果
2.1 暴发点基本情况 发生暴发点的禽类养殖厂养殖单一品种肉食鸡,约有种鸡10万只,采取封闭式管理。工作人员43人,多为外来打工人员,平时吃住在厂,近期无新从业人员招入,但几乎每日有本场人员外出购买食材。厂内消毒设施齐全、操作流程比较规范。
此次疫情涉及暴露人群43人,ILI病例15人,罹患率为34.88%;所有患者均出现发热、咽痛,其中6例出现咳嗽,部分伴有乏力、肌肉酸痛等症状;发热最高体温在38~39℃的有8例,超过39℃的2人,其余在38℃以下。无重症、死亡病例,无住院病例,未发现有合并症患者。所有人员过去一年中均未接种流感疫苗,其中2人接触过死禽。
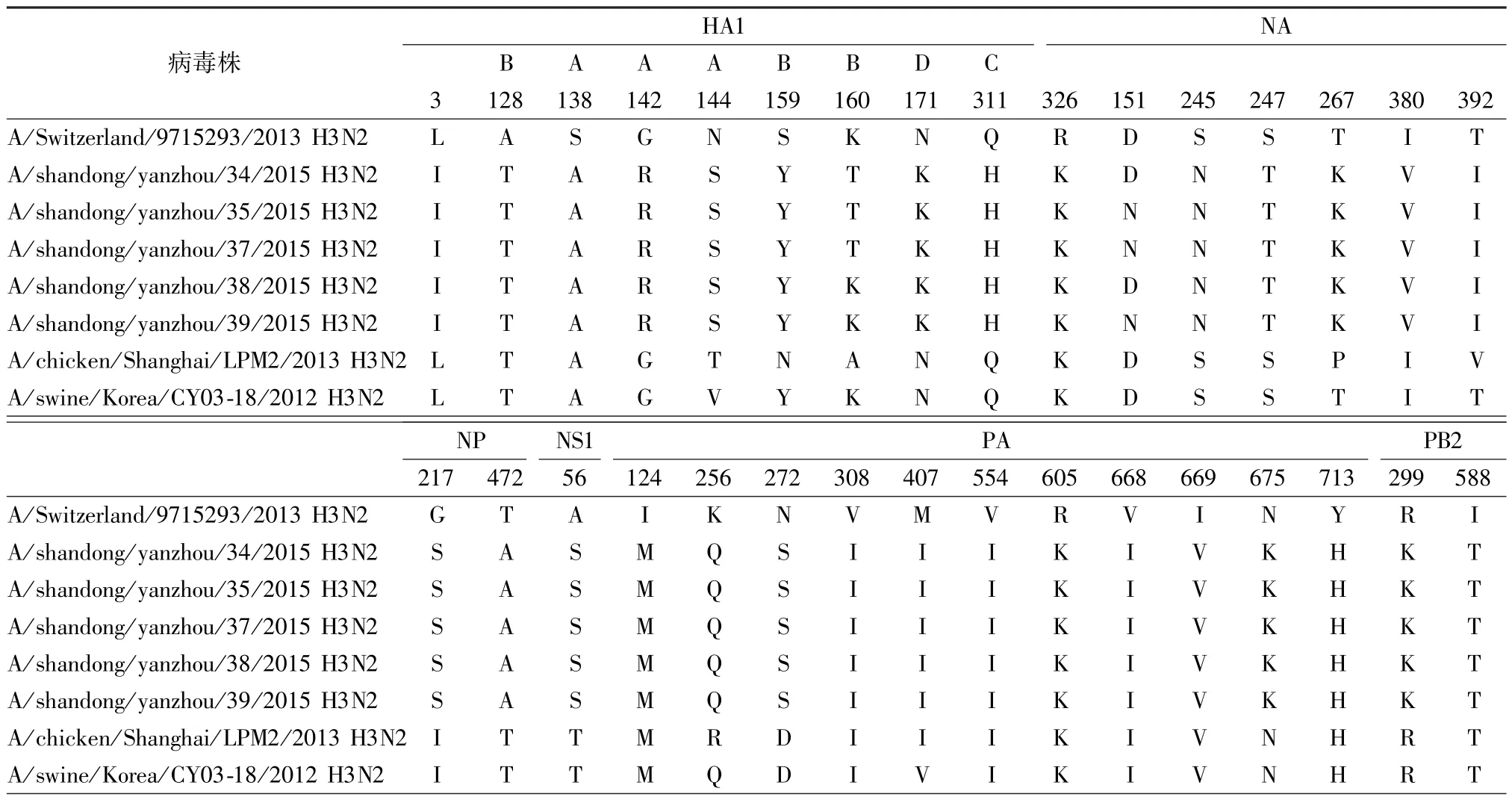
表1 H3N2病毒基因氨基酸序列分析Tab.1 Analysis of amino acid sequences of H3N2 influenza virus
首发病例发生在2015年9月3日,其中发病病例数分布在3日2例、4日2例、5日7例、6日4例。男性9例,女性6例。
2.2 病原学检测 采集15例ILI患者咽拭子标本,采用荧光定量RT-PCR检测,阳性11例,阳性率为73.3%;对11份阳性标本进行细胞培养,分离到流感病毒5株,经鉴定均为季节性A(H3N2)亚型流感病毒,分别命名为 A/shandong/yanzhou/34/2015(H3N2); A/shandong/yanzhou/35/2015 (H3N2);A/shandong/yanzhou/37/2015(H3N2);A/shandong/yanzhou/38/2015(H3N2);A/shandong/yanzhou/39/2015(H3N2)。
2.3 全基因组测序及基因进化分析 对本次暴发分离到的5株流感病毒进行了全基因组测序。
2.3.1 同源性分析:与疫苗株 A/Switzerland/9715293/2013(H3N2)相比,5 株 H3N2 流感病毒的8个基因片段的同源性为98.3% ~99.5%;与猪的H3N2 流 感 病 毒 A/swine/Korea/CY03-18/2012(H3N2)相比,8个基因片段的同源性为76.2% ~96.3%;与禽流感病毒 A/chicken/Shanghai/LPM2/2013(H3N2)相比,8个基因片段的同源性为66%~92.1%。除PB1外,其余7个基因片段与猪群和禽类的同源性均在90%以下。
2.3.2 H3N2亚型甲型流感病毒流行株基因进化分析:通过HA、NA进化分析发现,本次暴发流行株均属同一分支,与 2015—2016年度疫苗株 A/Switzerland/9715293/2013(H3N2)同属一分支,差异性小,同源性近。同时利用流感病毒6个内部基因构建进化树,发现山东暴发流行株6个内部基因均属同一分支,与 2015—2016年度疫苗株 A/Switzerland/9715293/2013同属一分支,差异性小,同源性近;6个内部基因与猪流感病毒和禽流感病毒的内部基因差异较大,同源性较远,未见禽流感病毒与人季节性流感病毒基因重组。具体见图1。

图1 H3N2亚型毒株的8个基因片段进化树Fig.1 Phylogenetic tree of H3N2 influenza virus 8 genes
2.3.3 H3N2病毒基因核苷酸序列及氨基酸序列分析:与2015—2016疫苗株HA蛋白相比,本次暴发的5株H3N2流感病毒共有14个氨基酸位点发生了替换,变异率为(2.47%),丢失糖基化位点NSS160-162,同时发生了144(A-T)变异,新增糖基化位点NWT142-144;有8处变异发生在抗原决定簇区,其中S138 A、G142R、N144S位于A抗原决定簇,A128T、S159Y、K160T位于B抗原决定簇中,Q311H位于C抗原决定簇,N171 K位于D抗原决定簇,而且128、138处氨基酸位点变异与禽类相同。NA蛋白共有7个氨基酸位点发生了替换,变异率为(1.64%),新增糖基化位点 NRT151-153、NAT245-247。 未发现 H274Y、R292 K、I222R/K/V 等神经氨酸酶抑制剂耐药突变,提示其对达菲类药物敏感。对测定株的位于M基因的S31 N、V27 A等M2离子通道抑制剂耐药位点进行分析,全部毒株的第31位均为N,提示其对金刚烷胺类药物耐药。氨基酸推测显示:PB2共2个氨基酸位点发生了替换,其中I588T位点氨基酸变异与禽类相同;PA共10个氨基酸位点发生了替换,有8处氨基酸变异与禽类相同;NS1共2个氨基酸位点发生了替换,其中I124 M位点氨基酸变异与禽类相同;NP共2个氨基酸位点发生了替换;PB1未发现氨基酸位点发生替换。具体见表1。
3 讨论
本次禽类养殖场流感暴发疫情是由季节性A(H3N2)流感病毒引起,共报告流感样病例15例,罹患率为34.88%,确诊病例11例。所有病例均为上呼吸道症状,未出现并发症,无死亡病例。
季节性A(H3N2)流感病毒自从1968年引起全球大流行以来,不断发生变异和抗原转变。虽然本次H3N2流感疫情范围小,但从病毒HA蛋白的抗原决定簇来看,部分抗原决定簇的相关位点已经发生变异,且以A抗原决定簇和B抗原决定簇最多,而A和B抗原决定簇在抗原转变中发挥重要的作用[7]。研究发现HA1蛋白主要抗原决定区中142、144、159位点氨基酸发生 G142R,N144S,S159Y 突变,引起HA蛋白抗原性漂移,通常认为HA1区蛋白分子上至少应有4个以上的氨基酸发生了替换且这4个替换必须分布在2个以上抗原决定簇内有可能形成具有流行病学意义的新变种[8],本文研究发现A-D区决定簇均存在氨基酸位点变异,此突变病毒株可能引起此次暴发流行。流感病毒主要抗原决定区是由HA1的受体结合位点(receptor bindingsite,RBS)[9]边侧的 7 个氨基酸位点组成,其中HA1氨基酸144位点的变异可以引起流感病毒抗原性的改变,以逃避机体已产生的特异性免疫应答保护作用[10]。本研究中观察到的突变可能是至关重要的,并且与 Mo/H3N2 毒株[11]一样,可能有助于改变H3N2的抗原性和毒力。NA能促使病毒从宿主细胞表面释放并进一步向周围细胞扩散,同时也是奥司他韦和扎那米韦2种神经氨酸酶抑制剂药物作用的靶点[12],从NA蛋白来看,5株病毒均没有发生H274Y的突变,说明均对神经氨酸酶抑制剂敏感。M2蛋白仅存在于甲型流感病毒中,为抗流感药物金刚烷胺和甲基烷胺的靶蛋白[13],对5株病毒的M蛋白的第27位和31位进行分析,发现均为M2离子通道抑制剂耐药位点,提示其对金刚烷胺类药物耐药。流感病毒聚合酶是由3个蛋白PA、PB2、NS所构成的异源三聚体,PA与PB2蛋白有多个氨基酸序列发生了变异,其中绝大多数变异与禽类的氨基酸位点相同,由于PA、PB1、PB2在流感病毒各基因组中较为保守,因而其氨基酸序列的突变可能会从侧面提供病毒进化的相关依据[13]。
之前多项研究报道[14-17],禽类养殖是禽流感或猪流感病毒突破种属限制感染人的危险因素,可在一定程度上发生重组,并导致病毒的毒力和致病力增强,2012年在美国猪群中流行的H3N2流感病毒变异株在人群中引起暴发流行就是一个典型的案例[4]。 2015 年 Ma 等[18]研究者在美国的猪群中发现至少有10种不同基因型的新型重组H3N2流感病毒,并均与2009年甲型H1N1流感病毒发生重组,其中有3种重组H3N2流感病毒被证实在猪中是致病的和可传播给人。 Rajão等[19]发现猪 H3N2型流感病毒的血凝素(HA)基因与人季节性 A(H3N2)流感病毒的HA基因类似,且其内部基因与甲型H1N1流感病毒的内部基因相似,表明猪群作为流感病毒的“混合器”,在人或动物中不断发生着重组。相关研究[20]表明中国东部的活禽市场曾发现H3N2禽流感病毒,同时2015年山东省发现了H3N2禽流感病毒(数据未发表)。虽然此次疫情确定了季节性H3N2流感病毒为本次疫情的病原体,但对于禽类职业人群发生流感样病例暴发疫情,仍然需要引起警惕。针对此次疫情,本研究仍有不足,未对2只病死禽及养殖场的禽类开展调查和标本采集,但对病毒分离阳性毒株作了全基因组测序来确定疫情性质,一定程度上弥补了现场资料信息不足的缺憾,为今后发生类似暴发疫情且禽类具体信息不全时的确定疫情性质提供了新思路。
与季节性H1N1流感病毒相比,H3N2流感病毒进化速度更快,更容易发生变异、重配,传播更迅速广泛[21],流感病毒的感染率高[22],本次暴发调查发现,该禽类养殖场的所有工作人员均无流感疫苗接种史,开展禽类养殖场、养猪场等从事与动物流感相关职业的全部人群流感疫苗接种工作、加强职业暴露人群对季节性流感、动物流感的防制知识宣传,也能降低季节性流感病毒与禽流感病毒、猪流感病毒重配的机率。
利益冲突无

