葡萄球菌噬菌体vB-StaM-JTB的分离及其生物学特性研究
王 倩,孙虎芝,刘 爽,闫艳新,潘 强,任慧英
(1.青岛农业大学动物医学院,山东青岛266109 ; 2.青岛诺安百特生物技术有限公司,山东青岛266109)
猪渗出性皮炎又称猪油皮病,是由葡萄球菌引起的猪皮肤表层组织的一种炎症,以全身油脂样渗出为典型特征,形成皮痂并脱落,甚至导致脱水和死亡等临床症状。该病主要侵害哺乳仔猪,尤其是刚出生3~5日龄的仔猪发病率高,传染迅速、死亡率也高。本病传染很快,只要有一头仔猪发病,1~2 d将会波及全窝,经3~5 d扩散到几窝或整座产仔舍。临床上治疗该病通常用庆大霉素、林可霉素等抗菌药物,但往往会导致病猪生长停滞。由于抗生素在养殖过程中大量用于疾病预防及治疗,导致细菌耐药性越来越严重,耐甲氧西林葡萄球菌大量地出现在人医和兽医临床,给疾病的治疗带来巨大的麻烦。因此,需要研发新型的抗菌药物,以控制耐药性细菌引起的感染。
噬菌体作为一种天然的抗菌生物制剂,能够对革兰阳性菌和阴性菌都有裂解作用,特别具有多重耐药性的病原菌都有较好的裂解效果[1-3]。噬菌体与抗生素相比具有以下几个特点:具有相当的种属特异性,只侵染特定的病原微生物,但不会对动物机体造成菌群失调;噬菌体的杀菌过程就是噬菌体的增殖过程,只要有敏感细菌存在,噬菌体就可以在细菌存在部位维持相当的数量[4]。另外,噬菌体较抗生素的研发用时短,且更易从自然界分离获得。噬菌体在医学、兽医学、食品等各个领域越来越受到重视[4-5]。本研究以猪源葡萄球菌为宿主菌,进行烈性噬菌体的分离,并对其生物学特性进行研究,以期为猪渗出性皮炎的噬菌体治疗奠定基础。
1 材料与方法
1.1 材料 猪源葡萄球菌菌株由课题组分离鉴定并保存。分离噬菌体用的污水及垫料来自山东青岛、威海、烟台等地猪场。
1.2 方法
1.2.1 样品处理 将污水与污物加入到200 mL无菌LB肉汤中,取2 mL宿主菌JTB1-3到200 mL肉汤中,37 ℃摇床过夜培养,自然沉淀3 h,取上清,10 000 r/min离心10 min后用0.22 μm的滤器过滤,收集滤液。
1.2.2 双层平板法分离噬菌体 将滤液与葡萄球菌菌悬液各200 μL混合后,37 ℃温箱中孵育5 min,将混合液加入含有0.7%琼脂的LB上层琼脂中混匀,将上层琼脂倒入到下层的营养琼脂上,于37 ℃温箱中过夜培养,观察有无噬菌斑[1]。
1.2.3 噬菌体的纯化 抠取单个噬菌斑与1 mL LB肉汤中,40 ℃水浴30 min,10 000 r/min离心5 min,将浸出液适当稀释后与宿主菌铺板,重复抠斑、浸出、离心进行纯化,直到得到大小和形态均匀的噬菌斑。
1.2.4 噬菌体的电镜观察 取20 μL噬菌体增殖液悬滴于微孔铜网上,沉淀15 min,用滤纸吸去多余的液体。在铜网上滴加15 μL的2%磷钨酸(PTA)。染色5 min,用滤纸吸去多余的染液,干燥后用透射电镜观察。
1.2.5 噬菌体最佳感染复数(MOI)的测定 增殖噬菌体和宿主菌,测定噬菌体效价及宿主菌浓度,按照感染复数为10、1、0.1、0.01、0.001、0.000 1、0.000 01的比例各取100 μL分别加入噬菌体的新鲜增殖液和宿主菌,加入到LB液体培养基中,使培养体系的总体积一致。于37 ℃,170 r/min振荡培养至液体变澄清,10 000 r/min离心5 min,取上清用双层平板法测效价,每组做两个平行样,取平均值[1]。
1.2.6 噬菌体一步生长曲线绘制 将200 μL噬菌体与宿主菌混合(噬菌体数多于细菌数),10 000 r/min离心30 s,弃上清,用500 μL LB肉汤洗涤两次并弃上清。用预热的LB肉汤混悬沉淀至5 mL,置于37 ℃,170 r/min震荡培养,从零时刻开始,前2 h每隔10 min,2~8 h每隔30 min,取出200 μL的混合液,10 000 r/min离心3 min取上清测效价,每组做两个平行,绘制一步生长曲线。
1.2.7 噬菌体pH值稳定性试验 取无菌试管中加入不同pH值(2、3、4、5、6、7、8、9、10、11、12、13)的LB肉汤4.5 mL,各3支,然后将试管置于37 ℃的水浴锅中,待温度稳定之后,各加入500 μL噬菌体增殖液,混匀37 ℃水浴作用1 h、2 h、3 h。作用结束之后,向混合液中加入适量的1 mol/L的HCl或者NaOH使混合液的pH值约为7,再连续进行10倍比稀释,用双平板法测定噬菌体的效价,每组做两个平行[5]。
1.2.8 噬菌体热稳定性试验 各取100 μL噬菌体增殖液分装于1.5 mL离心管中,分别于40 ℃、50 ℃、60 ℃、70 ℃、80 ℃水浴中作用20 min、40 min、60 min,每个温度设两个平行组。待作用结束后取出样品,并立即放入冷水中冷却,双层平板法测噬菌体的效价。
1.2.9 噬菌体对氯仿敏感性试验 向5 mL噬菌体加入200 μL氯仿置于37 ℃,170 r/min振荡培养30 min,离心取上清测效价。对照组不加氯仿,加入等量的液体LB,其他处理相同。
1.2.10 噬菌体对病原菌的体外裂解试验 按照感染复数为10、1、0.1、0.01、0.001、0.000 1、0.000 01的比例各取50 μL分别加入噬菌体的新鲜增殖液和宿主菌于96孔细胞培养板中,做阴阳性对照。置于37 ℃,170 r/min振荡培养,前3 h每隔0.5 h,4~12 h每隔1 h,放在酶标仪上读取OD630值。以时间为横坐标,OD630值为纵坐标,绘制曲线。
1.2.11 噬菌体裂解谱的测定 采用单斑法测定噬菌体裂解谱。取100 μL待测菌用无菌棉棒均匀涂在营养琼脂上,待菌液充分吸收后取1 μL噬菌体点到涂好的营养琼脂上,将平板置于37 ℃温箱中培养,10 h后观察结果。
2 结果
2.1 噬菌体分离结果 利用双层平板法从猪场污水中分离到1株噬菌体,形成圆形透明、边缘清晰、直径约为1 mm噬菌斑。
2.2 噬菌体的电镜观察 纯化的噬菌体vB-StaM-JTB经负染后,在透射电镜下的形态如图1所示,噬菌体形态为蝌蚪状,头部为二十面体的立体对称,直径约100 nm,噬菌体有一可伸缩性长尾,长约220 nm。根据2011年国际病毒分类委员会第9次报告提出的噬菌体分类与命名标准,该噬菌体符合有尾噬菌体目(Caudovirales)肌尾噬菌体科(myoviridae)的特征。根据命名原则,将该噬菌体命名为vB-StaM-JTB。
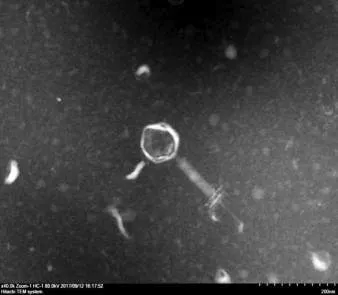
图1 噬菌体vB-StaM-JTB电镜下形态
2.3 噬菌体最佳感染复数 结果见表1。由表1可知感染复数(MOI)= 0.0001时噬菌体感染宿主菌产生子代噬菌体的滴度为3×109PFU/mL,在7个感染复数中噬菌体滴度最高,因此确定噬菌体的最佳感染复数是0.000 1。

表1 噬菌体vB-StaM-JTB感染复数测定结果
2.4 噬菌体一步生长曲线 由图2可见,噬菌体在80 min内数量未见明显增加,该阶段为噬菌体潜伏期;在感染后80 min~5 h,噬菌体的数量呈现上升趋势,该阶段为该噬菌体的暴发期。即该噬菌体的潜伏期约80 min,裂解期约220 min。根据暴发量=暴发末期噬菌体滴度/感染初期宿主菌浓度计算得出,噬菌体的裂解量为77,即每个被感染细菌产生子代噬菌体的平均数量约为77个。

图2噬菌体vB-StaM-JTB的一步生长曲线
2.5 噬菌体pH值稳定性试验 噬菌体vB-StaM-JTB的pH值稳定性结果见图3。噬菌体vB-StaM-JTB在pH值6~9范围内其效价均在108PFU/mL以上,具有稳定和良好的裂解活性。随着pH值的降低或升高,噬菌体活性显著下降,当pH值=2时作用2 h以及pH值=13作用1 h时,噬菌体完全失去感染宿主的能力。
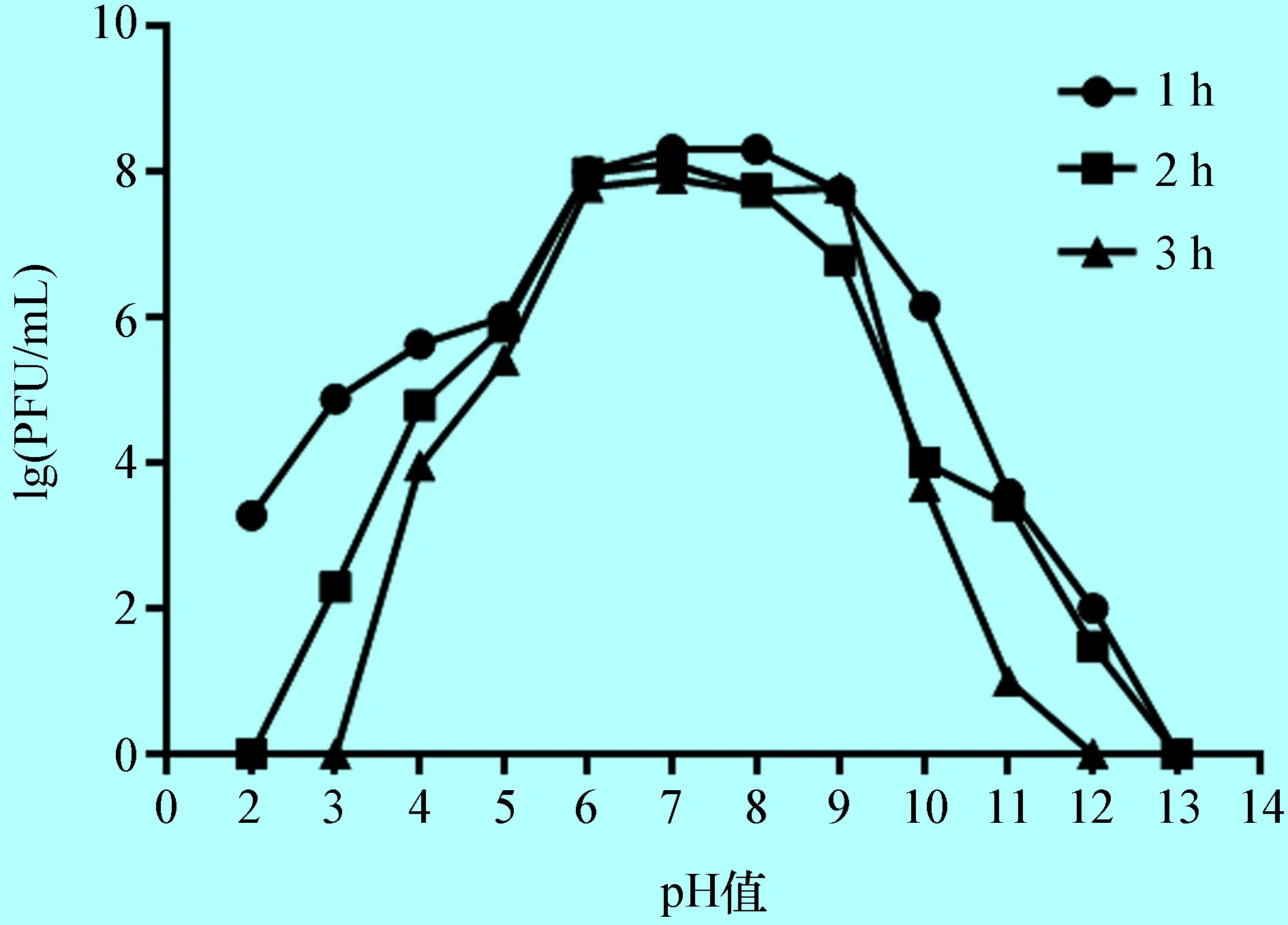
图3噬菌体vB-StaM-JTBpH值稳定性
2.6 噬菌体的热稳定性试验 噬菌体vB-StaM-JTB的热稳定性结果见图4。在40 ℃作用1 h之后基本可以保持原效价,50 ℃作用20 min效价下降4个数量级,60 min基本失活。60 ℃作用20 min完全失活。

图4噬菌体vB-StaM-JTB热稳定性
2.7 噬菌体vB-StaM-JTB对氯仿敏感性试验 通过图5噬菌体vB-StaM-JTB与氯仿相互作用结果发现,氯仿处理后噬菌体,效价下降一个数量级,说明该噬菌体对氯仿敏感。
2.8 噬菌体对病原菌的体外裂解试验 噬菌体与宿主菌以不同感染复数混合培养后,一开始细菌在增殖OD值增大,之后噬菌体在不同MOI下裂解细菌,OD值下降。随着时间的推移,最终OD值都能够下降到只加噬菌体的阴性对照的OD值,在8 h时细菌几乎被裂解完全且12 h无抗性菌产生。不加噬菌体的细菌对照孔的OD值一直上升。如图6所示。

图5噬菌体vB-StaM-JTB氯仿敏感性

图6噬菌体vB-StaM-JTB的体外裂解试验
2.9 噬菌体裂解谱的测定 噬菌体vB-StaM-JTB对实验室保存的171株猪源的葡萄球菌进行噬菌体的裂解谱分析,结果表明,共有124株葡萄球菌可以被噬菌体vB-StaM-JTB裂解,裂解率可以达到71.93%。
3 讨论
本试验从污水中分离纯化出1株肌尾噬菌体vB-StaM-JTB,为了更好地利用噬菌体开展噬菌体治疗,对其生物学特效进行了研究。不同地区分离到的同种细菌的噬菌体以及不同形态的噬菌体生物学特性都可能不一致[6],尤其是在pH值、热稳定性、最佳感染复数、一步生长曲线以及裂解谱等方面存在较大差异。vB-StaM-JTB经50 ℃ 20 min处理后基本失活,而蔡天舒等[7]以金黄色葡萄球菌ATCC6538为宿主菌分离到的长尾噬菌体在60 ℃条件下作用40 min后,其存活率仍在50%。过高的温度会影响噬菌体对细菌的吸附也会造成噬菌体空间结构发生变化失去裂解活性。vB-StaM-JTB对酸碱较敏感,pH值在6~9范围内时,其效价变化不大,但是强酸强碱对vB-StaM-JTB都会产生很大影响,生产中使用时应考虑酸碱消毒剂的配合使用问题。噬菌体vB-StaM-JTB和宿主菌的比例为0.000 1时,所得到的子代噬菌体的效价最高。鞠磊等[8]以S.aureus43300为宿主菌分离得到的金黄色葡萄球菌肌尾噬菌体最佳感染复数为 0.001,与之相比vB-StaM-JTB具有较强的增殖效率。感染复数不同,子代噬菌体的产率也会有较大的差异,这一生物学特性指标为后续噬菌体生产中噬菌体与细菌用量比提供了一个依据。噬菌体vB-StaM-JTB对分离自不同地区的猪源葡萄球菌具有广泛的裂解谱,且具有增殖速度快,抗性菌不易产生等优点。本试验将对葡萄球菌引起的仔猪渗出性皮炎的噬菌体治疗奠定基础。

