结核分枝杆菌外泌体的研究进展
王鑫洋 付英梅 赵雁林 张凤民
自外泌体被发现,其包含的核苷酸和蛋白质可以作为分子标记物来诊断肿瘤的发生,同时也会对宿主免疫方面产生影响。当今,结核病是危害人类的重大疾病,是由结核分枝杆菌感染所引起的慢性传染性疾病。结核分枝杆菌产生的外泌体能够对宿主免疫产生影响,当结核分枝杆菌感染宿主后,宿主所产生的外泌体也能够造成宿主的免疫学改变。当然,在非结核分枝杆菌中也存在外泌体,也会反映宿主免疫方面的变化。因此,对结核分枝杆菌与非结核分枝杆菌外泌体的研究能够区分结核分枝杆菌与非结核分枝杆菌,并促进结核病的诊断与治疗的发展,为临床诊断与治疗提供新思路。
外泌体简介
一、外泌体定义
1983年,Harding等[1]发现,非溶酶体的多泡内含体由于内吞作用富集了大量的标志性转运蛋白,随后与质膜融合并且通过胞吐作用释放出内含于囊泡的结构。之后,Pan和Johnstone[2]用外泌体来命名多泡体释放出的囊泡状结构。
外泌体是由细胞分泌的直径在30~100 nm之间的微小囊泡状结构,内含来源于细胞相关的蛋白质与核苷酸等生物分子。外泌体可由几乎所有类型的细胞分泌,并且在组织细胞生理和病理情况下皆可持续分泌,存在于多种体液当中。
二、外泌体提取与检测
(一)外泌体提取方法
外泌体的提取主要包括以下几种方式:(1)超速离心法。此种方法得到的外泌体量多,纯度不足,易聚集成块;同时此法提出的是微泡,不是外泌体。(2)过滤离心法。这种操作简单、省时,同样存在纯度不足的问题。(3)密度梯度离心法。此方法得到的外泌体纯度高,但是前期准备工作繁杂、耗时、量少。(4)免疫磁珠法。这种方法可以保证外泌体形态的完整,特异性高、操作简单、不需要昂贵的仪器设备,但外泌体生物活性可能受到影响,影响下一步的实验。(5)PS亲和法。该方法与免疫磁珠法相似,获得的外泌体形态完整,纯度最高,且不影响外泌体的生物活性。(6)色谱法。这种方法分离到的外泌体在电镜下大小均一,但设备要求高,应用不广泛。
(二) 外泌体检测
检测外泌体的主要方法为电子显微镜、流式细胞技术、蛋白质免疫印迹(western blot,WB)、动态光散射、酶联免疫吸附试验(enzyme linked immunosorbent assay,ELISA)等[3]。
近年来出现很多新型的检测外泌体方法,如利用具有优良水溶性的单壁碳纳米管(s-SWCNTs)和核酸适体来检测外泌体[4]、表面等离子体共振成像(SPRi)技术[5]、通过表面增强拉曼散射光谱(surface-enhanced Raman scattering,SERS)信号快速检测外泌体[6]等。
三、外泌体功能
研究者首次发现外泌体后,认为是细胞利用其排泄废物的一种方式。随着研究的深入,发现外泌体具有多种多样的功能。
(一)作为诊断生物标记物
外泌体上的CD81蛋白在诊断丙型肝炎和针对丙型肝炎的治疗方面有一定的生物标记作用[7];在卵巢癌患者的卵巢和来源于卵巢癌患者血清分离的外泌体中,作为诊断标记的几种miRNA在健康对照组中并没有被发现,这说明外泌体miRNA可以作为癌症病理诊断的生物标记物[8]。
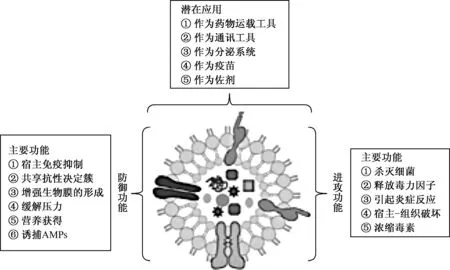
图1 细菌OMVs的功能(原图见文献[14])
(二)作为载体介导细胞间的信息传递[9]
外泌体在发挥信息传递作用时主要通过以下4种方式:(1)利用配体-受体介导的方式刺激受体细胞,进而传递信息;(2)在细胞间转移受体;(3) 将功能蛋白或传染性颗粒转移到受体细胞内;(4)利用膜融合的方式向受体细胞传递遗传信息。
(三)促进肿瘤细胞凋亡
从胰腺肿瘤患者分离的肿瘤细胞外泌体可上调肿瘤细胞Bcl-2相关X蛋白基因(Bcl-2 associated X protein, Bax)的表达水平,进而促进肿瘤细胞凋亡[10],而在晚期肿瘤患者分离的肿瘤细胞外泌体会促进肿瘤的发生发展[11]。
(四)参与机体的免疫应答
与对照外膜囊泡(OMVs)接种动物的脾细胞相比,小鼠接种寨卡病毒(ZIKV)-OMV疫苗后脾细胞的白细胞介素(IL)-2、IL-4和转化生长因子-β(TGF-β)的表达水平更高,说明ZIKV-OMV疫苗接种后产生了免疫应答[12]。
(五)对疾病的治疗作用
在糖尿病肾病大鼠模型中,连续尾静脉注射人尿液来源的外泌体,其尿白蛋水平明显降低[13]。
细菌外泌体
外膜囊泡的特性使得其能够介导DNA片段(自溶素、细胞毒素、毒力因子和各种其他生物分子)的转移。OMVs已被确认在获取营养物质、应激反应、毒素、黏附宿主、毒力因子传递中的作用,以逃避宿主防御系统的攻击(图1)[14]。
一、 OMVs在细菌生理学及致病中的作用
OMVs通过多种途径促进细菌存活,并且能够通过不同的机制增加细菌的致病性。例如,可以在应激条件下从细菌细胞去除有毒化合物(错误折叠的蛋白质等);应激条件可以也增加OMVs的产量;致病革兰阴性菌在感染期间利用OMVs与宿主细胞相互作用;OMVs可以穿过肠道中的黏液屏障并到达肠上皮细胞,将细菌抗原递送至潜在的巨噬细胞,从而引发肠道炎症等[15]。
二、 细菌外泌体对宿主免疫的影响
现已有证据证明,当细菌感染宿主后,细菌OMVs会影响宿主免疫。例如,使用产肠毒素性大肠埃希菌(ETEC)分泌的OMVs免疫小鼠与对照组相比,死亡时间延后,当用低浓度的ETEC对小鼠进行感染时,使用ETEC分泌OMVs免疫小鼠与对照组相比,存活率提高[16];使用牙龈卟啉单胞菌的OMVs感染单核巨噬细胞(THP-1细胞),THP-1细胞中肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α),IL-8,IL-1β的表达随着牙龈卟啉单胞菌OMVs的浓度增加而减少,IL-10的表达随着牙龈卟啉单胞菌OMVs的浓度增加而增加[17]。综上,细菌OMVs能够通过不同的途径引起宿主免疫学的改变。
分枝杆菌与外泌体
分枝杆菌包括结核分枝杆菌与非结核分枝杆菌,均能够分泌外泌体,并且能够诱导宿主免疫。分枝杆菌感染宿主后,宿主产生的外泌体包含有分枝杆菌的组分,同时也能够诱导未感染的细胞产生免疫应答[18]。
一、结核分枝杆菌与外泌体
结核分枝杆菌能够引起结核病的发生,其为细长带弯曲的杆菌,抗酸染色后,镜下观察下为红色,且无芽孢和鞭毛。结核分枝杆菌属于专性需氧菌,最适生长温度为37 ℃,在一般培养基中每18~24 h分裂一代,但营养充足时5 h即可分裂一代。在实验室,采用结核菌素试验和γ干扰素释放试验等方法对结核分枝杆菌的感染进行检测。
结核分枝杆菌能够分泌外泌体,并能对宿主的免疫产生影响。分枝杆菌胞外囊泡(MEV)在10年前首次被观察到[19],其释放是结核分枝杆菌调节宿主免疫反应的一个重要的机制[20]。当然,当结核分枝杆菌感染宿主后,宿主产生的外泌体同样能够产生免疫学影响。
(一) 结核分枝杆菌外泌体对宿主免疫的影响
结核分枝杆菌的微囊泡(microvesicles, MVs)能抑制巨噬细胞和T细胞的功能,但可促进树突状细胞的主要组织相容性复合体(MHC)Ⅱ类抗原呈递[21];现也有研究表明,结核分枝杆菌的膜囊泡可以促进巨噬细胞中细胞因子TNF-α,IL-6,IL-lβ的表达,但不影响IL-10的表达[22];在BCG蛋白脂质体(PLBCG)和BCG免疫的小鼠中,IgG的表达水平接近,但均高于未处理组,同时PLBCG免疫的小鼠相对于未处理组可显示更高的交叉免疫性,表明PLBCG中存在其他相关的MTB抗原,其可能参与诱导针对结核病的交叉保护性免疫[23];结核分枝杆菌细胞外囊泡(EVs)能够诱导人巨噬细胞产生促炎症细胞因子及共刺激分子的表达,其诱导巨噬细胞产生的肿瘤坏死因子(tumor necrosis factor,TNF)-α,IL-6和IL-10表达高,TGF-β表达低,但无法诱导IL-1β表达。结核分枝杆菌EV诱导巨噬细胞上共刺激分子CD86的表达最高,也会明显增加CD80的表达[24];用H37Rv膜囊泡免疫小鼠引起辅助性T淋巴细胞1(Th1)应答强于并优于用BCG 膜囊泡或BCG免疫引起的Th1应答[25]等,都显示出结核分枝杆菌的外泌体能够诱导宿主产生免疫功能改变。
(二) 结核分枝杆菌感染宿主后,宿主产生的外泌体对免疫功能的影响
用表达红色荧光蛋白(DsRed)或Ag85A-DsRed的牛分枝杆菌菌株鼻内感染Rab27a缺陷型小鼠,Rab27a缺陷型小鼠中分离的外泌体中Ag85A-DsRed的丰度比野生型低5倍,且在DsRed刺激后产生IFN-γ的T淋巴细胞数量明显减少,可见宿主来源的外泌体可以在牛分枝杆菌感染期间促进抗原特异性T淋巴细胞应答[26];将BCG感染或未感染的J774细胞的外泌体与从BCG感染的小鼠分离的脾细胞一起培养,来自感染细胞的外泌体能够诱导CD8+和CD4+T淋巴细胞中IFN-γ的表达,而未感染细胞的外泌体未能诱导IFN-γ表达[27];用结核分枝杆菌感染的巨噬细胞的EVs 刺激内皮细胞时,总共37个通路被发现显著上调[28];相对分子质量为19 000的脂蛋白存在于结核分枝杆菌感染的巨噬细胞外泌体上,并至少部分负责外泌体促炎的活性[29];用BCG感染从人外周血中提取的单核细胞,诱导产生巨噬细胞,并提取外泌体,进行RNA测序,发现有与免疫相关的基因[30]。
(三) 结核分枝杆菌外泌体在疾病诊断方面的作用
在结核分枝杆菌外泌体中检测到287个囊泡蛋白,其中有几种与细菌的毒力有关[31]。目前,有研究表明在结核病患者的外泌体中,存在有可以作为区分活动性肺结核和潜伏感染的生物标志物的蛋白多肽[32];通过对外泌体RNA进行测序,为潜伏性和活动性结核病的诊断提供了潜在的生物标志物[33]。
(四) 结核分枝杆菌外泌体在疾病治疗方面的作用
用BCG、带有明矾佐剂的BCG蛋白脂质体(PLBCG-Al)和BCG+PLBCG-Al免疫小鼠,2个月后进行感染刺激,发现3个组的细菌负荷均低于对照组,且BCG+PLBCG-Al组细菌负荷最低,同时肺表面积最小[34];用结核分枝杆菌感染巨噬细胞2 h,然后用EV-聚甲基丙烯酸钠(PMA),EV-N-甲酰-L-甲硫氨酰-L-亮氨酰-L-苯丙氨酸三肽(fMLP)和结核分枝杆菌EV刺激24和48 h,并进行菌落形成单位(CFU)测定,发现结核分枝杆菌EV刺激诱导后,细胞内结核分枝杆菌的数量明显减少[20];也有研究证明H37Rv膜囊泡给予加强的BCG疫苗能够减少结核分枝杆菌感染小鼠脾及肺中的细菌数量[21];
(五) 结核分枝杆菌外泌体其他功能
结核分枝杆菌外泌体不光与免疫有关,在其他方面也发挥着作用。例如,结核分枝杆菌外泌体能够释放分枝菌素,从而促进结核分枝杆菌对铁的吸收能力,促进结核分枝杆菌在宿主的扩散生长[35];于肺炎、肺结核和肺癌的患者体内获得胸腔积液, 并从中获取其外泌体的miRNA进行高通量序列, 发现3个组患者体内的miRNA表达不同[36-39];相对于未处理的内皮细胞,结核分枝杆菌感染巨噬细胞EVs刺激的内皮细胞中有96个基因表达超过2倍或更多倍,相对于结核分枝杆菌未感染巨噬细胞EVs者,结核分枝杆菌感染巨噬细胞EVs刺激的内皮细胞中有75个基因的表达水平超过2倍[21]。由此推断当结核分枝杆菌感染宿主后, 宿主产生外泌体内miRNA的释放会对机体产生影响。
二、非结核分枝杆菌与外泌体
非结核分枝杆菌是指结核分枝杆菌复合群与麻风分枝杆菌以外的分枝杆菌,包括鸟分枝杆菌、耻垢分枝杆菌、海分枝杆菌、龟分枝杆菌,等等。此处以鸟分枝杆菌为例介绍其与外泌体的关系。
鸟分枝杆菌感染的巨噬细胞外泌体中,包含鸟分枝杆菌来源的蛋白质,并且这些外泌体中能够诱导巨噬细胞促炎症细胞因子的产生,即鸟分枝杆菌感染的巨噬细胞外泌体可以产生类似于鸟分枝杆菌感染的免疫应答,但不同于鸟分枝杆菌感染,鸟分枝杆菌感染的巨噬细胞外泌体对细胞凋亡和坏死没有明显影响[40];分析鸟分枝杆菌感染与未感染的巨噬细胞外泌体中的蛋白质,得到12种差异表达的蛋白,其中4种在鸟分枝杆菌感染的巨噬细胞外泌体中表达升高,后通过MALDI-TOF/TOF MS鉴定出5种差异表达的蛋白(表1)[41]。

表1 MALDI-TOF/TOF MS鉴定出的鸟分枝杆菌感染与未感染的巨噬细胞外泌体中差异表达蛋白质[41]
注Mw:蛋白质分子量;pI:蛋白质等电点
小结与展望
现在对外泌体已经有了较为深入的研究,比如影响宿主免疫和作为诊断标记物来诊断疾病等。同时,结核分枝杆菌的外泌体功能也已经得到研究,例如作为疫苗预防疾病,改善宿主免疫等。有研究表明,结核分枝杆菌感染的巨噬细胞释放的EVs包含宿主外泌体的标志物和结核分枝杆菌所包含的分子,如脂多糖、脂蛋白等;但是,其对宿主的免疫学影响是由EVs中所包含的结核分枝杆菌细菌膜囊泡所引起,而不是细胞产生的外泌体[42]。结核分枝杆菌分泌的外泌体中能够引起宿主免疫学改变的组分现在仍然是未知的,需要做进一步深入的研究。现有研究表明外泌体既能够促进宿主免疫的产生,又能促进结核分枝杆菌在宿主体内的扩散生长,需进一步研究其不同的机制。
外泌体中还包含着RNA、DNA、蛋白、脂质等组分,并存在差异表达,已有研究利用其作为诊断标记物。现有研究表明,在结核分枝杆菌感染宿主分泌的外泌体中,也存在差异表达的蛋白质与RNA,也能作为结核病的诊断标记物。
随着研究的不断深入,利用外泌体对结核分枝杆菌进行鉴定及对结核病的发生进行诊断,能够为结核病的临床诊断与治疗提供新思路。非结核分枝杆菌的外泌体现在也得到了研究,通过对其的不断深入研究,可以利用外泌体组分的不同对结核分枝杆菌与非结核分枝杆菌进行鉴定,并可以用于区分结核分枝杆菌感染与非结核分枝杆菌感染,为临床诊断与区分结核分枝杆菌与非结核分枝杆菌感染提供新思路。

