心脏外科围术期应用主动脉内球囊反搏的并发症及危险因素分析
拜合提亚尔·克然木 米娜瓦尔·热合木
主动脉内球囊反搏(intraaortic ballon pump,IABP) 是初期主要应用于冠状动脉旁路移植术术后左心始衰减,随后也应用于急性心肌梗死的治疗。于1968年首先报道应用于临床[1],是最常见的一种左心辅助装置,可以提高动脉舒张压,增加冠状动脉灌注,同时降低收缩压,减轻左心后负荷。目前在临床上,IABP已成为促进冠心病患者心功能恢复、外科和介入治疗中循环支持和心脏移植术前过度治疗的主要手段。但由于该项治疗并发症发生率较高,且针对不同手术的应用时机可能会影响预后。笔者回顾性分析我院收治的心脏外科手术患者应用IABP后并发症发生情况及相关因素,现报告如下。
资料与方法
一、一般资料
回顾分析本院2011年1月至2016年12月心脏外科收治实施手术置入IABP患者80例,其中男性60例,女性20例;年龄55~75岁,平均(58.1±7.8)岁;心功能Ⅲ级以上26例。冠心病62例(单纯性冠心病50例,合并室壁瘤8例,合并瓣膜病4例;急性心肌梗死22例,不稳定心绞痛40例),瓣膜病11例,左房粘液瘤7例。术前置入IABP 26例,术中置入35例,术后置入19例。
纳入标准:(1)冠状动脉旁路移植术术前预防性置入患者。(2)心脏外科手术术中体外循环停机预防患者。(3)术后药物治疗效果不理想且馨排量降低患者。(4)围手术期心肺循坏难以为继的患者。(5)研究经医学伦理委员会审议通过,患者知情同意并配合治疗。排除标准:(1)合并中、重度主动脉瓣反流患者。(2)确诊为主动脉病变不宜置入气囊患者。(3)患者不能有效配合治疗,临床资料不全患者。
置入指征:(1)术前药物治疗控制不稳定型心绞痛效果不理想。(2)冠状动脉主干狭窄在90%以上。(3)心功能(左室射血分数)LVEF<40%。(4)急性心源性休克急诊患者。(5)顽固性室性心律失常。(6)术中或术后合并血流动力学不稳定、低心排血量综合征、心功能不全、血压难以维持等情况。撤除指征:(1)升压药生效后血压稳定,药物用量逐渐降低用量至推荐用量。(2)心率恢复正常,窦性心律稳定。(3)日间尿量正常。(4)患者末梢循环逐步改善。(5)血流动力学稳定。
置入方法:患者均采用Seldinger法置入(股动脉穿刺法),身高162 cm以上患者采用8 Fr 40 cc气囊导管,身高162 cm以下患者采用7 Fr 30 cc气囊导管置入胸骨左缘2至3肋间,应用胸部X线平片确定置入位置(ARROW公司 AUTO CAT2型)置入球囊成功后采取心电出发模式,反搏频率设定(1∶1)。气囊置入期间采用肝素抗凝,以25 KU/L肝素钠盐水1次/h进行冲洗,检测ACT时间(激活全血凝固时间)为160~180 s。
分组方法:根据现有患者资料,存在以下并发症情况的纳入研究组共12例:(1)置入IABP后患者肢体动脉搏动消失,血压下降明显,如进行性加重患者可能出现搏动消失、体温降低等缺血特征。(2)置入IABP穿刺部位出现出血或皮下血肿甚至可能出现循环搏动需立即输血。(3)股动脉-静脉瘘或出现动脉夹层、穿孔甚至栓塞。(4)置入IABP后球囊充盈不良或破裂。未出现上述并发症的患者68例为无并发症组。
二、观察指标
收集两组患者性别、年龄、慢性病史等一般资料,记录IABP置入时间及置入时机,治疗前后平均动脉压(MABP)、中心静脉压(CVP)、心率(HR)、尿量(Urinary-V)、多巴胺(Dopamine)、肾上腺素(Epinephrine)及术后并发症发生情况(包括出血、四肢缺血、血管损伤及置入IABP失效)。
三、统计学分析
应用SPSS 18.0统计软件对研究进行统计学处理,计量资料采用示,比较采用独立样本t检验,组内比较采用方差分析,组间比较采用单因素方差分析,计数资料采用χ2检验。组间比较存在统计学差异的变量纳入Logistic回归分析,以P<0.05为差异有统计学意义。
结 果
一、两组患者一般资料比较
两组在性别、年龄、体质量指数、高血压、脑卒中发生率等方面比较差异无统计学意义(P>0.05),在65岁以上患者、糖尿病发生率、外周血管病发生率及体外膜肺氧合应用率方面比较差异有统计学意义(P<0.05)。研究组65岁以上患者比例(83.33%)、糖尿病发生率(41.67%)、外周血管病发生率(66.67%)及体外膜肺氧合应用率(41.67%)均显著高于无并发症组(表1)。两组IABP辅助时间及置入时机比较差异无统计学意义(P>0.05)(表2)。
二、两组置入前后血流动力学及血管活性变化
两组患者血流动力学指标及血管活性指标治疗前后组内比较差异有统计学意义(P<0.05),治疗后平均动脉压、尿量均显著升高,中心静脉压、心率、多巴胺、肾上腺素显著降低,治疗后血流动力学指标组间比较差异无统计学意义(P>0.05),血管活性指标比较差异无统计学意义(P>0.05)(表3)。
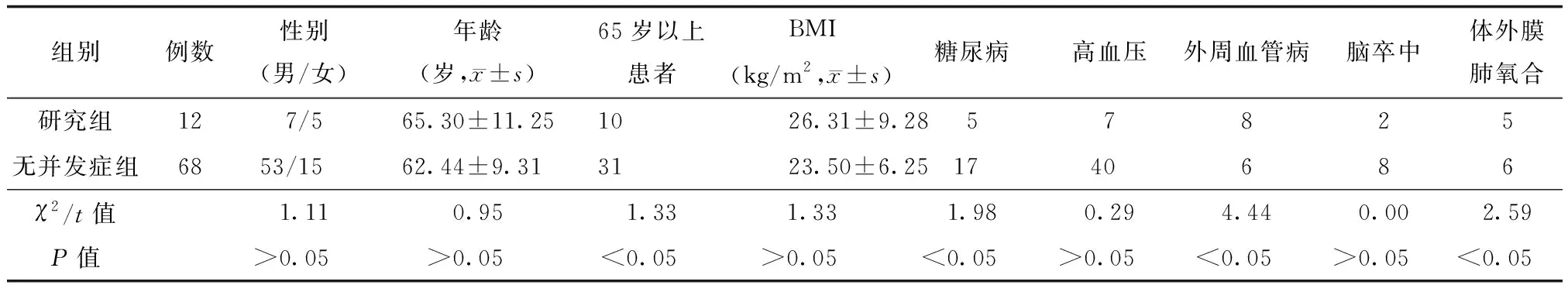
表1 两组患者一般资料比较(例)

表2 两组患者IABP置入时间及时机
注:IABP为主动脉内球囊反搏
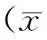
表3 两组置入前后血流动力学及血管活性变化±s)
注:MABP为治疗前后平均动脉压,CVP为中心静脉压,HR为心率,Urinary-V为尿量,Dopamine为多巴胺,Epinephrine为肾上腺素
三、并发症发生情况及危险因素分析
纳入研究患者,术前置入26例,术中置入35例,术后置入19例,并发症发生率为7.69%、11.43%、31.58%,三者间差异无统计学意义(P>0.05),置入后出血发生7例(8.75%),缺血2例(2.5%)其中坏疽1例、骨筋膜室综合症1例,血管损伤2例,IABP置入失效1例(表4)。根据上述指标发现IABP置入并发症发生危险因素为高龄患者(>65岁)、糖尿病、外周血管病及体外膜肺氧合,进行回归分析后发现,以上均为IABP置入后并发症发生的独立危险因素。见表5。
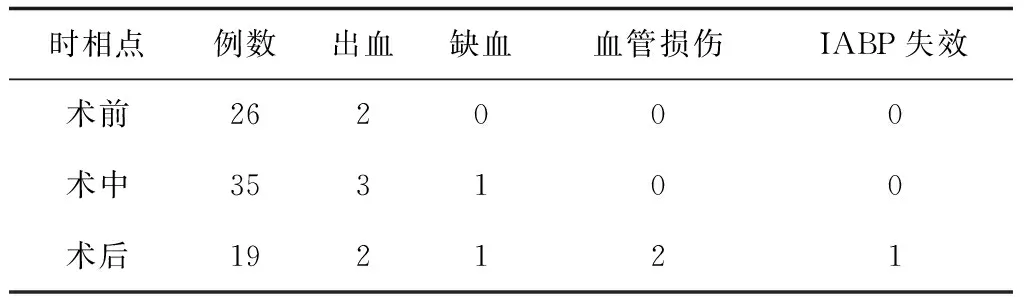
表4 并发症发生情况(例)

表5 并发症发生危险因素
讨 论
IABP在临床应用上一直以来饱受争议,作为心脏辅助装置,能够通过主动脉球囊与心脏周期节律进行同步,通过机械扩张方法增加冠状动脉灌注,减少心脏后负荷,增加心输出量。特别对于围手术期瓣膜病、冠心病、心脏移植等原因出现心排量降低综合征的患者具有提高舒张压、增加冠状动脉灌注等辅助治疗效果[2]。近年来,临床上对IABP的应用主要集中于围手术期的应用时机,现在国内外主要倾向于术前置入IABP[3-4]。随着现代医学技术发展,特别是经皮穿刺技术的不断改进,文献研究证实[5-6],应用IABP后并发症发生率可以控制在13.5%~36.0%。现如今,临床置入IABP后常见的并发症包括动脉损伤、栓塞、下肢及内脏缺血、假性动脉瘤、血管瘘甚至球囊机械原因导致破裂等。
植入后发生肢体缺血主要是由于穿刺后股动脉血流中断时间较长,形成动脉血栓及栓塞。如患者合并糖尿病、高脂血症等慢性疾病将加重外周血管损伤,肢体缺血发生率升高;如球囊导管插入后抗凝不及时、不充分,由于球囊存在于血管内,将诱发血栓形成或造成栓塞;如临床操作不熟、技能较弱,施术时导丝甚至球囊导管进入假腔将造成动脉夹层分离的发生;如置入过程中肝素应用时机不对,加之球囊导管在反搏过程中破坏微小血管,将造成出血、溶血甚至血小板减少等情况发生。而置入IABP过程中一旦发生并发症,而未予以及时治疗将造成患者预后不良甚至发生严重不良后果,因此,对于置入IABP过程中可能出现的并发症高危因素进行研究,将有利于控制并发症发生,改善应用效果。本研究结果显示,纳入研究的患者并发症发生率为15%,其中出血发生率为8.75%,缺血、血管损伤发生率均为2.50%。与单中心2005年至2017年579例心脏外科IABP置入研究比较,本研究并发症发生率偏高,但与国外相关研究报道并发症总体发生率相近[7-8]。在并发症影响因素上,高龄患者、糖尿病、外周血管病及体外膜肺氧合应用均为IABP置入后并发症发生的独立危险因素。
在所有IABP相关并发症中器械穿刺损伤及缺血是最为常见的一类。血管并发症在IABP置入初期发生率较高,约为20%左右,主要是由于糖尿病、高血压等慢性疾病的存在,患者血管脆性增加;置入IABP后肢体缺血发生率超过10%,而发生这一并发症的主要危险因素也与周围血管疾病、糖尿病有关,同时指出穿刺鞘膜也能够直接导致缺血的发生,因此国内提出通过无鞘管置入IABP来减少因器械原因导致的下肢缺血的发生[9]。同时也有研究指出,已患有糖尿病、外周血管病变且病情较重患者,应用IABP会增加肢体缺血的发生几率[10]。本次研究结果显示,肢体缺血发生率为2.5%,其中严重缺血事件发生1例,占50%,无IABP直接相关性死亡。
对于心血管急危重症患者体外膜肺氧合应用越来越广泛,特别是对心外科术后严重低心排综合征、心搏骤停、病毒性心肌炎及心肺移植具有较好的辅助功能,其可以通过有效的心肺功能辅助增加左心室后负荷,增加血液供氧量。联合使用IABP能够通过降低心室负荷、增加冠脉灌注来改善组织灌注效果并有效改善患者预后[11-14]。但两者同时应用将会增加血管并发症发生风险,一项通过机械循环辅助患者的数据分析显示,两者联合辅助患者的肢体缺血并发症发生率较单独应用IABP患者高,两组比较差异显著。本研究结果显示,研究组联合应用体外膜肺氧合患者比例(41.67%)比无并发症组(10.34%)显著升高。相关性分析结果显示,体外膜肺氧合辅助是IABP置入治疗并发症发生的高危因素之一(OR=4.336)。
临床上为了减少IABP置入后出血及血栓形成造成血管栓塞的发生,常规使用肝素进行抗凝,一般维持活化部分凝血活酶时间(APTT)为50 s左右,活化凝血时间(ACT)为150 s左右,如肝素抗凝应用不当可能增加出血风险或血管内栓子形成,因此有选择的肝素抗凝需严格进行监控[15]。对于周围血管病、糖尿病等存在血管损伤高危因素的患者采用有选择的抗凝方式要积极进行监控,时刻把握患者凝血功能改变情况以减少并发症的发生[16]。
随着IABP球囊导管技术的不断发展以及穿刺技术的不断进步,术后监护和护理管理水平不断提升,对于IABP置入时机、辅助置入时间的掌控,以及应用过程中对患者生命体征的监控将会有效控制并发症的发展,同时对高危因素的有效排查能够为临床减少并发症的发生提供有效的遵循。
综上所述,心脏外科手术患者围手术期置入IABP辅助治疗的相关并发症发生率能够通过临床技术的发展得到有效控制,其中穿刺部位局部出血及肢体缺血是发病率较高的并发症。而高龄、糖尿病、周围血管病及体外膜肺氧合辅助是IABP置入后相关并发症发生的高危因素。通过有效的临床检测和规范会治疗及围手术期科学护理管理能够有效减少并发症的发生。

