鸡卡氏杆菌GZ2017株的分离与16 S rRNA序列分析
张升波,温贵兰*,陈绍品,李昌红,林汉卿,徐 丽,管国丹,汪德生*,嵇幸勤,文 明,周碧君,程振涛
(1.贵州大学动物科学学院,贵州贵阳 550025, 2.贵州省动物疫病与兽医公共卫生重点实验室,贵州贵阳 550025)
鸡卡氏杆菌病是由鸡卡氏杆菌(Gallibacteriumanatis)引起的危害蛋鸡重要的传染病之一,临床上常以输卵管囊肿和卵巢炎等为主要特征[1]。1950年,Hansen首次发现卡氏杆菌,1960年被定为溶血性巴氏杆菌,Christensen H等[2]2003年以该细菌的微生物学和分子生物学特征将鸭巴氏杆菌、输卵管炎放线杆菌和溶血性巴氏杆菌合并,组成巴氏杆菌科的一个新属——卡氏杆菌属,并且将禽卡氏杆菌定为该属的代表种。卡氏杆菌具有条件致病菌的典型特征,受细菌和病毒的混合感染、寄生虫感染、应激和激素失调等易感因素的影响[3-4]。有报道认为,卡氏杆菌是不同品种健康禽类的上呼吸道和下生殖道正常菌群之一,但有研究表明卡氏杆菌与产蛋鸡的病理损伤有关[5]。卡氏杆菌能引起产蛋鸡输卵管病变和腹部膨大,使鸡呈企鹅状,造成产蛋量下降,严重感染鸡群产蛋量可下降30%,产蛋鸡最终因输卵管囊肿、卵黄性腹膜炎及贫血、消瘦而导致死亡[6-8]。由卡氏杆菌引起的输卵管炎、腹膜炎的发病机制尚未完全阐明,但也有相关文献报道该细菌的相关毒力因子[9-10]。鸡卡氏杆菌能够引起多种禽类患病,包括鸡、火鸡、鸭、鹅、鹦鹉、鹌鹑和珍珠鸡,给养禽业带来了巨大的经济损失[11-12]。王川庆等[12]在2008年首次报道了我国鸡场中普遍存在卡氏杆菌的感染的情况,相继有报道在四川和辽宁地区也分离到了致病性卡氏杆菌[13-14]。本试验对贵州某白羽蛋鸡养殖场送检的病鸡处理后进行细菌分离培养鉴定,通过药物敏感性试验筛选出了该分离菌株敏感药物,并进行了16 S rRNA序列分析鉴定,最终确定该送检病鸡为鸡卡氏杆菌感染。该研究为该鸡场对鸡卡氏杆菌病的防控提供了理论依据。
1 材料与方法
1.1 材料
1.1.1 病料来源 本次试验病料来源于贵州某白羽蛋鸡养殖场处于产蛋高峰期的3只发病鸡。
1.1.2 主要试剂 牛肉膏、蛋白胨、琼脂粉、琼脂糖、革兰染色剂、抗菌药物药敏纸片、微量生化反应管,杭州微生物试剂有限责任公司产品;胎牛血清,海博生物有限公司产品;细菌DNA提取试剂盒,天根生化科技有限公司产品;2×EsTaqDNA Polymerase,康为世纪公司产品;DNA Marker DL 2 000,宝生物工程(大连)有限公司产品。
1.2 方法
1.2.1 临床表现和剖检病变 观察病鸡的临床表现,并对病鸡进行剖检,观察解剖病理变化,记录结果。
1.2.2 培养基的配制 培养基的配制均参照文献[15]介绍方法由贵州省动物疫病与兽医公共卫生重点实验室自制。
1.2.3 细菌分离培养 无菌操作从送检鸡的心脏、肝脏、脾脏、肾脏和上腭裂等组织器官进行取样,用接菌环接种于鲜血琼脂平板培养基,分别在厌氧与需氧条件下37℃培养24 h后,挑选形态不同的菌落在巧克力培养基和含50 mL/L胎牛血清的培养基上进行纯培养。
1.2.4 细菌革兰染色镜检 分别挑取巧克力培养基和含50 mL/L胎牛血清的普通培养基上的单菌落进行革兰染色,油镜下观察细菌形态特征。
1.2.5 细菌生化试验 在无菌操作台用齿轮将生化管锯开,用接种环将经过纯培养后的细菌接种在细菌生化管内,石蜡封顶后置于37℃培养24 h~48 h之后进行观察记录。
1.2.6 细菌药敏试验 取100 μL纯培养菌液均匀涂抹于含50 mL/L胎牛血清琼脂平板上,用纸片法将30种药敏片粘贴于平板上,于37℃培养24 h,记录所有药敏片的抑菌圈尺寸大小,参照美国临床和实验室标准化协会(CLSI 2016)抗微生物药物敏感试验标准进行药物敏感性判断。
1.2.7 16 S rRNA的PCR扩增与测序 参照细菌基因组DNA提取试剂盒操作说明书提取细菌DNA,提取的细菌DNA置于-20℃冰箱保存。细菌16 S rRNA引物序列为F:5′-AGAGTTTGATCMTGGCTCAG-3′;R:5′-AAGGAGGTGATCCAGCC-3′,预扩增片段长度约为1500 bp,引物由英潍捷基(上海)贸易有限公司测序合成。PCR反应体系25 μL:上、下游引物(10 μmol/L)各1 μL,2×EsTaqDNA Polymerase 12.5 μL,DNA 2 μL,H2O 8.5 μL。PCR反应条件:94℃ 2 min;94℃ 30 s;50℃ 30 s;72℃ 1.5 min,共30个循环;72℃ 10 min。反应结束后经10 g/L琼脂糖凝胶电泳检测PCR产物,并将PCR产物送英潍捷基(上海)贸易有限公司测序。
1.2.8 分离株16 S rRNA序列分析 将所测分离菌株的16 S rRNA序列与GenBank数据库中收录的序列进行比对,运用DNA Star7.0中的MegAlign软件将所测的16 S rRNA序列与巴氏杆菌科中15个属和沙门菌共23株菌的16 S rRNA序列作比对,并应用MEGA5.05软件中的N-J方法构建遗传进化树,参考菌株[14]的详细信息见表1。

表1 参考菌株信息
2 结果
2.1 临床症状和病理变化
该养殖场产蛋率下降,发病鸡精神委顿,食欲下降,脸部轻微肿胀,鼻部有黄色鼻液流出,湿啰音,拉黄白稀粪。静脉放血致死后进行解剖病变观察,发现鸡肝区体表投影处肌肉可见黄色粒状结节干酪样物质,有心包积液,腹腔有充满清亮、透明液体的囊包(图1~图3)。

图1 病鸡脸部水肿、流黄色鼻液

图2 心包积液
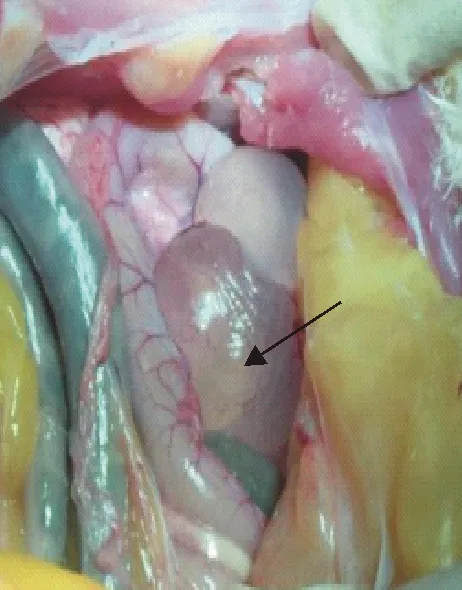
图3 输卵管出现透明液体的囊包
2.2 细菌分离培养结果
挑取鲜血琼脂养基上的单个菌落接种于巧克力培养基固体培养基上,37 ℃培养24 h后观察结果。由图4可知,该分离菌在巧克力培养基上长出表面光滑、湿润、半透明、灰白色、边缘整齐的均一小菌落。

图4 分离菌株在巧克力培养基上的菌落形态
2.3 革兰染色镜检结果
挑取在培养基上经纯培养后的菌落进行革兰染色,镜检结果显示该细菌被染成红色,细菌形态呈两端钝圆的球杆菌,菌体单个散在或成对分布,根据革兰染色结果可判断分离的细菌为革兰阴性球杆菌。
2.4 生化试验结果
生化试验结果见表2,结果显示该分细菌能利用蔗糖、甘露糖、麦芽糖、蕈糖、葡萄糖、蜜二糖和果糖;精氨酸水解酶,硝酸盐还原试验为阳性;不能利用木糖、乳糖、甘露醇、N-乙酰葡糖胺、山梨醇,枸缘酸盐、V-P和尿素酶试验为阴性。
2.5 药敏试验结果
药敏试验结果见表3。由表3可知,该分离菌株对米诺环素和万古霉素极度敏感,对多西环素和头孢哌酮高度敏感,对哌拉西林、羧苄西林、头孢曲松、氧氟沙星、头孢拉定、头孢氨苄、环丙沙星、诺氟沙星、庆大霉素、丁胺卡那和新霉素中度敏感,对头孢唑林、头孢呋辛、呋喃唑酮、多黏菌素和氯霉素低度敏感,对氨苄西林、头孢他啶、红霉素、苯唑西林、卡那霉素、四环素、青霉素、克林霉素、麦迪霉素和复方新若明不敏感。
2.6 16 S rRNA PCR扩增及序列比对结果
PCR扩增出该分离菌株的16 S rRNA基因序列后,将PCR产物送生物公司进行序列测定,测得该分离菌株的16 S rRNA核苷酸序列为1 464 bp,经NCBI比对发现,扩增出来的16 S rRNA核苷酸序列与GenBank上公布的HN-HL-2-XZQ-G(GenBank:HM241884.1)和Yu-ZK-XC-6-XZQ(GenBank:FJ841972)16 S rRNA核苷酸序列同源性高达99%以上,可以判定该分离菌株为卡氏杆菌,并将该分离菌株命名为GZ2017。

表2 分离菌株生化反应结果
注:“十”阳性;“一”阴性。
Note:“+”Positive;“-”Negative.

表3 分离菌株药敏试验结果
2.7 GZ2017株16 S rRNA序列同源性分析结果
采用MegAlign软件中的Cluster W方法对GZ2017分离株与巴氏杆菌科的22株细菌和沙门菌进行16 S rRNA序列同源性分析。同源性分析结果显示(图5),本试验分离的卡氏杆菌GZ2017株与巴氏杆菌科22株细菌16 S rRNA序列同源性为89.2%~99.2%;与Gallibacteriumanatis同源性为98.6%~99.2%,与中国分离株Yu-HL-huang-1-SLG(GenBank:GQ423347)同源性最高,为99.2%;与其他卡氏杆菌属Gallibacteriumsalpingitidis、Gallibacteriummelopsittaci和Gallibacteriumtrehalosifermentans同源性分别为92.1%、94.2%、93.3%;与其他巴氏杆菌科其他属(Pasteurella、Actinobacillus、Haemophilus等)的同源性都低于93.3%,与丹麦分离株Ph13; CCUG 26828(GenBank:AF053901)同源性最低,为89.2%,而与沙门菌的同源性为86.8%。
2.8 GZ2017株16 S rRNA序列遗传进化树分析结果
基于细菌16 S rRNA序列,采用MEGA5.05软件中的N-J方法,将分离菌GZ2017与巴氏杆菌科的22株细菌和沙门菌共24株进行系统进化树分析(图6)。结果显示,P.phocoenarum、Chelonobacteroris和Histophilussomni这3个属单独成一分支,以Gallibacteriumanatis和Haemophilusaegyptius为代表的各成一大分支,分离菌GZ2017同Gallibacterium属细菌同属于一个分支,且与日本分离株PPQC2013-MTSKWH3(GenBank:KU060245)在同一分支上,这表明分离菌GZ2017与日本分离株PPQC2013-MTSKWH3进化关系最近,属于鸡卡氏杆菌。

图5 分离菌株GZ2017株16 S rRNA序列同源性比对

图6 分离菌株GZ2017 16 S rRNA序列系统进化树
3 讨论
近年来,随着畜禽集约化程度不断提高、环境变化等因素的影响,鸡卡氏杆菌病在我国逐渐成为危害禽类特别是产蛋鸡的一种重要疾病。该病传播的常见途径是水平传播,但也能垂直传播[16]。该病临床表现无特异性,主要表现为产蛋量下降,这很难与其他造成鸡产蛋量下降的疾病进行鉴别诊断。有研究表明用副鸡禽杆菌和卡氏杆菌共感染SPF鸡,可引起SPF鸡严重的上呼吸道症状,通过接种灭活疫苗可以减轻由两种细菌共感染引起的临床症状[17]。禽卡氏杆菌对生长营养要求严格,本结果表明该菌在血平板和巧克力培养基上生长良好,能在50 mL/L的胎牛血清普通培养基上生长。本试验采用细菌传统的鉴定方法和16 S rRNA序列分析方法对分离菌进行鉴定,并结合药敏试验筛选出了该分离菌株的敏感药物。试验结果表明该分离菌株为革兰阴性球杆菌,生化试验结果与卡氏杆菌生化试验结果报道基本一致[11,18];药敏试验结果表明,该分离细菌对米诺环素和万古霉素极度敏感,对多西环素和头孢哌酮高度敏感,但对对氨苄西林、头孢他啶、红霉素、苯唑西林、卡那霉素、四环素、青霉素、克林霉素、麦迪霉素和复方新若明不敏感,表明该细菌该菌已对多种抗生素产生了广泛耐药性,在临床用药时应注意联合用药和穿梭用药。
16 S rRNA基因在细菌遗传进化中相对保守,而它的可变区序列因不同细菌而异,是细菌分类的分子基础,反映了物种间的亲缘关系,病原菌分离之后,采用16 S rRNA序列分析确定禽卡氏杆菌感染是可行的[14,19]。本试验分离菌株16 S rRNA序列于NCBI上进行比对后发现该分离株扩增出来的16 S rRNA核苷酸序列与GenBank上公布的其他卡氏杆菌的16 S rRNA核苷酸序列同源性高达99%以上,同源性分析结果显示,分离菌株GZ2017的16 S rRNA序列与中国分离株Yu-HL-huang-1-SLG(GenBank:GQ423347)同源性最高(99.2%),与丹麦分离株Ph13 CCUG 26828(GenBank:AF053901)同源性最低(89.2%),分离菌GZ2017与Gallibacterium属细菌同属于一个分支,且与日本分离株PPQC2013-MTSKWH3(GenBank:KU060245)在同一分支上,这表明分离菌GZ2017与日本分离株PPQC2013-MTSKWH3进化关系最近,属于鸡卡氏杆菌,最终确定该鸡场为鸡卡氏杆菌感染。有学者研究报道,禽呼吸道和生殖道感染是鸡卡氏杆菌重要的感染途径[9],本分离株是从患有呼吸道症状病鸡的上腭裂分离出来的,可以认为病鸡的呼吸道症状是由卡氏杆菌感染引起的,这与郑鹿平推测的结果一致[20]。研究结果可为鸡卡氏杆菌病的防控与治疗提供理论数据。

