固相萃取-气相色谱-负化学离子源质谱法测定运动场所合成材料面层和稀释剂中的短链氯化石蜡
黄绍军, 杜 萍, 刘春侠, 杨 俊, 杨朝芬, 孙 卉, 黄秋玲
(昆明理工大学分析测试研究中心, 云南 昆明 650093)
短链氯化石蜡(short chain chloroparaffins, SCCPs)是指通用分子式为CnH2n+2-yCly(n=10~13)、碳原子数为10~13的多氯代烷烃化合物的统称。短链氯化石蜡已被确认为具有远距离环境迁移能力、持久性、生物蓄积性和生态毒性等持久性有机污染物(POPs)的特性,并已被国际癌症研究机构确认为致癌2B类物质,即对人体有潜在致癌性[1,2];欧盟REACH法规和联合国环境规划署也将SCCPs列为高度关注物质,在全球范围内禁用或严格限制[3]。欧盟POPs指令(EC No 850/2004)规定所有物品中SCCPs的含量不得超过1%[4]。SCCPs常用于增塑剂、纺织品和包装材料的表面处理剂、粘接材料、涂料的改良剂、金属加工润滑剂、皮革制品加工助剂、阻燃剂、密封剂、油漆和橡胶等领域[1,5,6]。
目前,SCCPs的分析主要借助气相色谱(GC)[7-9]或液相色谱(LC)[10-12]分离,利用电子捕获检测器(ECD)[11,13]、电子轰击离子源质谱(EI-MS)[9,14]、负化学离子源质谱(NCI-MS)[9,11]、亚稳态原子轰击高分辨质谱(MAB-HRMS)[9,15]和大气压化学电离源质谱(APCI-MS)[16]进行检测。GC-ECD和LC-APCI-MS方法选择性和特异性不佳,易出现假阳性误判的问题[10,17,18]; GC-EI-MS分析短链氯化石蜡所提取的定性和定量离子同时也存在于中链和长链氯化石蜡中,提取离子不唯一[19,20]; GC-MAB-HRMS设备昂贵,不适合常规分析[1,21]。因此,建立一种快速、准确、灵敏度高的、可靠的SCCPs分析方法迫在眉睫。GC-NCI-MS则对SCCPs的电离程度相对弱,产生的碎片离子较少,因而具有更好的选择性和更高的灵敏度。目前对SCCPs的研究主要集中在土壤、河流和海底沉积物、水体生物、大气、聚氯乙烯塑料、皮革、纺织品、橡胶制品[22-24],尚未有关于运动场地合成材料面层(如塑胶跑道)及其稀释剂中SCCPs检测的研究报道。
1 实验部分
1.1 仪器、试剂与材料
Bruker 456-GC/SCION TQ气相色谱-质谱联用仪,配置有化学离子源(CI)和EI源(美国布鲁克道尔顿公司); KQ-250E型超声波清洗器(昆山市超声仪器有限公司); TDL-40B离心机(上海安亭科学仪器厂); MGS-2200氮气吹扫浓缩装置(南京惠恒科学仪器有限公司);弗罗里硅土固相萃取小柱(1 g/6 mL,广州信谱徕科学仪器有限公司);有机相过滤膜(0.45 μm,天津市津腾实验设备有限公司); Agilent J&W HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm,安捷伦科技(中国)有限公司)。
质量浓度为100.17 mg/L、平均氯含量为55.5%的SCCPs标准溶液购自德国Dr. Ehrenstorfer公司;正己烷(分析纯,国药集团化学试剂有限公司);丙酮、甲苯和二氯甲烷均为分析纯,乙腈为色谱纯,均购自天津市风船化学试剂科技有限公司;高纯氦(纯度≥99.999% ,昆明梅塞尔气体产品有限公司);甲烷(纯度≥99.99% ,佛山市高明区捷和气体有限公司); 5批次硅PU球场样块、5批次稀释剂及其空白样品均由广州杰锐体育设施有限公司提供。
1.2 系列定量标准溶液的配制
将质量浓度为100.17 mg/L、平均氯含量为55.5%的SCCPs标准溶液用正己烷逐级稀释,得到质量浓度分别为40.068、20.034、10.017、5.008 5、0.500 9 和 0.050 1 mg/L 的SCCPs系列定量标准溶液。
1.3 样品前处理
将塑胶样品硅PU球场样块破碎至粒径约为1 mm的细小颗粒(液体样品稀释剂无需加工),准确称取0.5 g样品放入50 mL带刻度的具塞锥形瓶中,用正己烷定容至25 mL并超声提取30 min。弗罗里硅土固相萃取小柱(1 g/6 mL)预先用10 mL正己烷淋洗活化,取2 mL提取液通过弗罗里硅土固相萃取小柱净化,流速控制在约2滴/秒,静置5 min,用5 mL正己烷和丙酮的混合溶剂(体积比3∶1)洗脱,收集洗脱液,将洗脱液在40 ℃时用氮气缓缓吹干,加入2 mL正己烷复溶,混匀。复溶所得溶液用0.45微米有机相过滤膜过滤到色谱进样瓶中待测。
1.4 气相色谱-质谱条件
气相色谱条件如下。进样口温度:300 ℃;升温程序(快速程序升温方式):初始温度80 ℃,以40 ℃/min 的速率升温到300 ℃,保持5 min;载气:氦气(纯度≥99.999% );流速:2 mL/min;进样量:1 μL;进样方式:不分流,0.75 min后开阀;色谱柱:Agilent J&W HP-5MS毛细管柱(30 m×0.25 mm×0.25 μm)。
质谱条件如下。离子源:NCI源;CI反应气:甲烷(纯度≥99.99% ),压力12.0 psi(相当于 82 737 Pa);离子源温度:230 ℃;传输线温度:300 ℃;收集延迟:3.5 min;灯丝发射电流:90 μA;电子轰击能量:70 eV;数据采集方式:选择离子监测模式;选择监测离子:m/z70.40(定量离子)、327.10、361.00、389.11和411.02;监测起止时间:3.5~8.1 min。
2 结果与讨论
2.1 气相色谱-质谱分析条件的优化
2.1.1正、负化学离子源的选择
以100.17 mg/L 的短链氯化石蜡(C10~C13,平均氯化程度55.5%)标准溶液为研究对象,使用气相色谱串联三重四极杆质谱联用仪对标准溶液进行全扫描分析,比较SCCPs总离子流(total ion current, TIC)色谱峰的峰面积。
气相色谱条件同1.4节;质谱条件如下。离子源为CI源,将极性(polarity)设置为正(positive)和负(negative),分别对应于正化学离子源(PCI)和负化学离子源的检测方式;离子监测模式为全扫描方式;其余质谱条件同1.4节。
结果表明,使用正化学离子源所得SCCPs的TIC色谱峰的峰面积为2.908×106,没有出现典型的SCCPs五指峰;而使用负化学离子源所得SCCPs的TIC色谱峰的峰面积为4.667×109,并且出现了典型的SCCPs五指峰。因此,负化学离子源为优选。
2.1.2程序升温方式的选择
使用负化学离子源,并将快速程序升温方式改为慢速程序升温方式:初始温度80 ℃,保持2 min,以20 ℃/min 的速率升温到180 ℃,保持2 min,再以10 ℃/min 的速率升温到300 ℃,保持5 min。
结果表明,慢速程序升温方式所得SCCPs的TIC色谱峰的峰面积为1.619×109,峰形较弥散,保留时间为10~20 min,分析时间长;而快速程序升温方式所得SCCPs的TIC色谱峰的峰面积为4.667×109,簇峰较紧凑,保留时间在4.0~7.5 min,分析时间短。因而快速程序升温方式为优选。
2.1.3灯丝发射电流对色谱峰面积的影响
使用快速程序升温方式,并将灯丝发射电流由90 μA改变为10、20、60、80、100和120 μA,所得SCCPs的TIC色谱峰面积分别为4.075×108、9.430×108、2.978×109、3.420×109、3.824×109和3.812×109(见图1)。灯丝发射电流优选为90 μA。
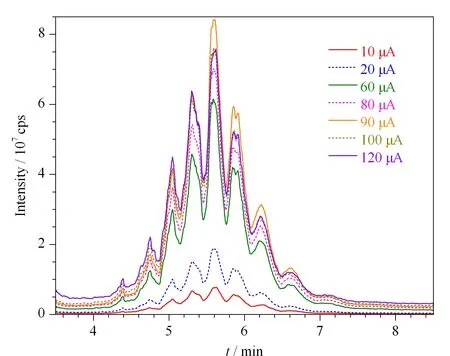
图 1 采用不同灯丝发射电流所检测的SCCPs的总离子流色谱图Fig. 1 Total ion current (TIC) chromatograms of short-chain chloroparaffins (SCCPs) detected with different filament emission currents
2.1.4电子轰击能量对TIC色谱峰面积的影响
灯丝发射电流采用90 μA,并将电子轰击能量由70 eV改变为60、80、90、100和150 eV,所得SCCPs的TIC色谱峰面积分别为4.115×109、4.612×109、4.673×109、4.805×109和4.550×109,色谱图见图2。说明电子轰击能量对TIC色谱峰面积影响不大。接下来的实验皆将电子轰击能量设定为70 eV。
2.1.5定量和定性监测离子的选择
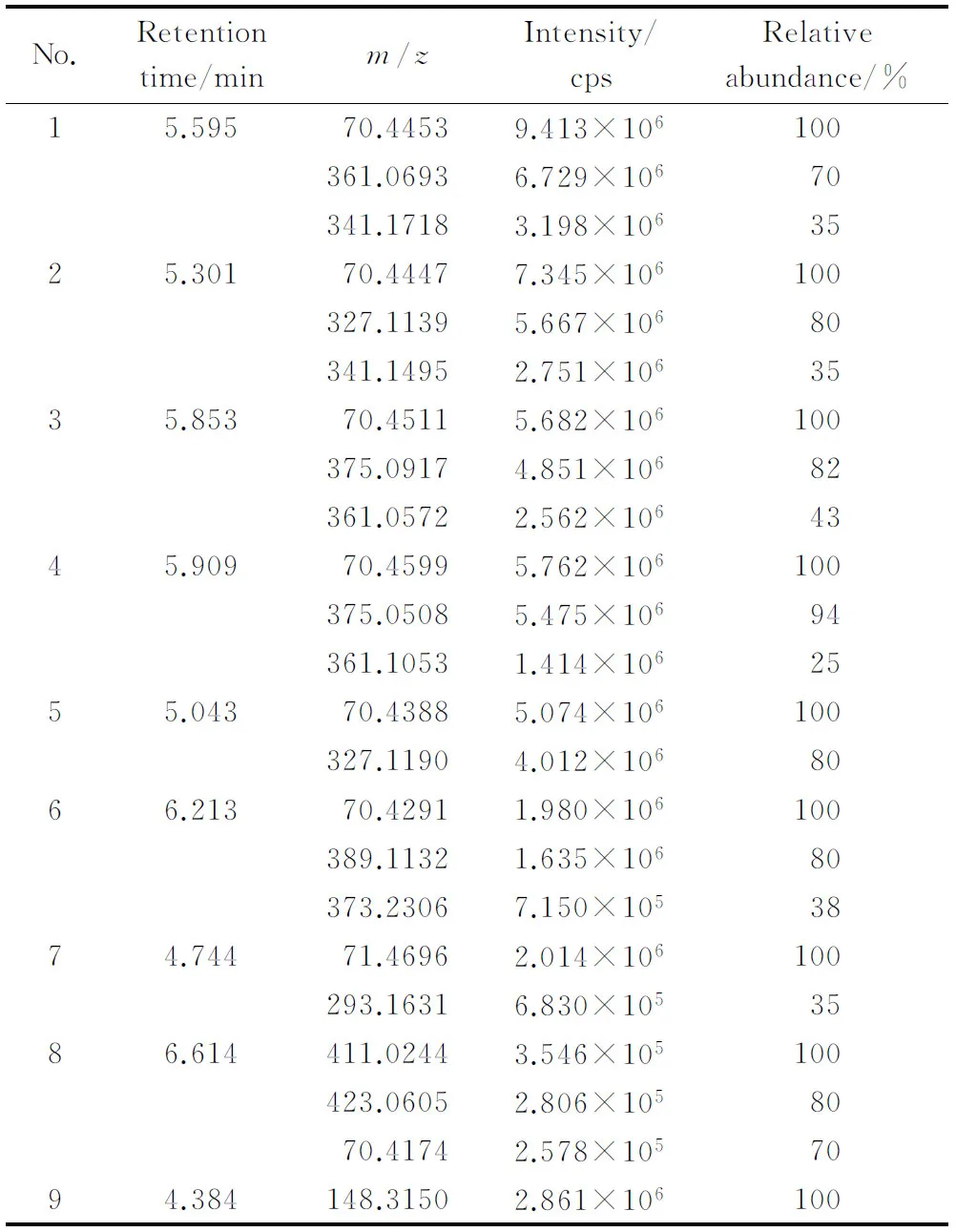
接下来我们对TIC色谱峰各簇峰碎片离子进行了提取以便确定SIM的监测离子。表1按簇峰强度由高到低排列(Nos. 1~9),相应的保留时间见图2,每个峰提取1~3个强度较高的碎片离子。选择强度最大且出现频率最高的1种碎片离子作为定量离子,选择强度相对较大和出现频率相对较高的4种碎片离子作为定性离子。定量离子选择m/z70.40,定性离子选择m/z327.10、361.00、389.11和411.02;这5种离子为SIM的监测离子。
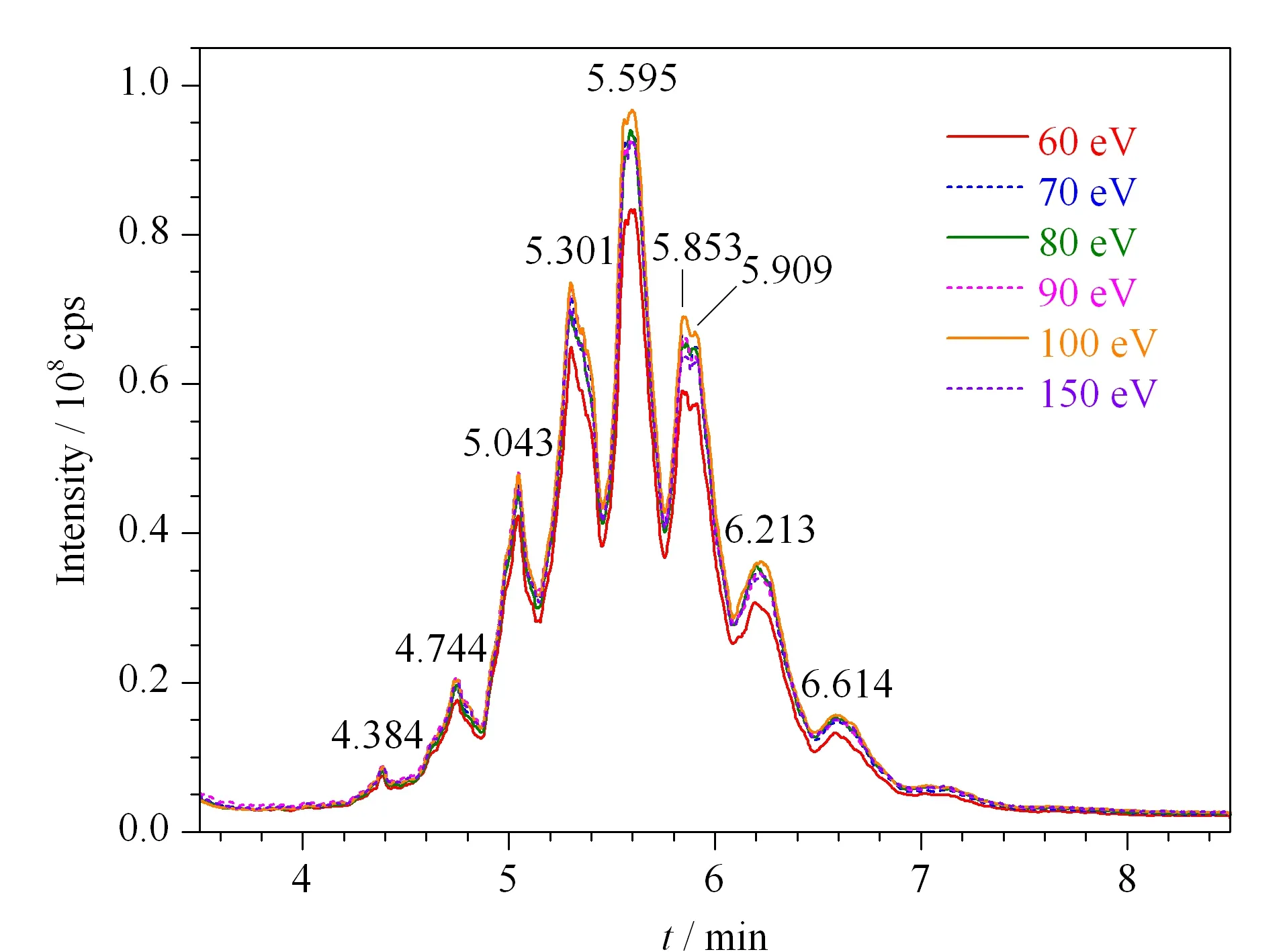
图 2 采用不同电子轰击能量所检测的SCCPs的全扫描总离子流色谱图Fig. 2 TIC chromatograms of SCCPs detected with different electron energies
2.2 样品提取条件的优化
为了充分地提取运动场所合成材料面层和稀释剂中的短链氯化石蜡,我们采用超声提取的方式,对提取溶剂(正己烷、甲苯、二氯甲烷、乙腈)、提取时间(10、20、30、40 min)、提取溶剂用量(5、10、15、20、25、30 mL)等提取参数进行了优化。经实验证实,采用超声提取方式,当提取溶剂为正己烷,提取时间为30 min,提取溶剂用量为20 mL时,提取效果最为理想。原因是超声提取方式有利于提取溶剂浸润、扩散深入到运动场所合成材料面层的内部结构中去,使提取充分、高效。另外,短链氯化石蜡为弱极性的化合物,根据相似相溶原理,用非极性的正己烷能最大限度地将SCCPs提取出来。
2.3 净化条件的优化
由于运动场所合成材料面层和稀释剂在制备的过程中会有各种添加剂的加入,为了尽可能地减少杂质对SCCPs测试的干扰,有必要对提取液进行净化处理。固相萃取是最有效的净化方式之一。可根据萃取对象来选择相应的固相萃取填料种类及其用量以及洗脱剂及其用量。SCCPs既含有非极性的烷基,又含有极性的C-Cl键;固相萃取填料的种类不同,对SCCPs的吸附性能也不同,填料用量越大,吸附容量越大;洗脱剂必须选择合适的能较好地分离其他干扰杂质有机溶剂,还要能够洗脱完全,使SCCPs有较好的回收率。基于以上因素考虑,我们最终选择1 g/6 mL的弗罗里硅土固相萃取小柱,并用正己烷-丙酮(3∶1, v/v)作为洗脱剂,样品提取液、弗罗里硅土、洗脱剂的用量关系为2 mL∶1 g∶5 mL。
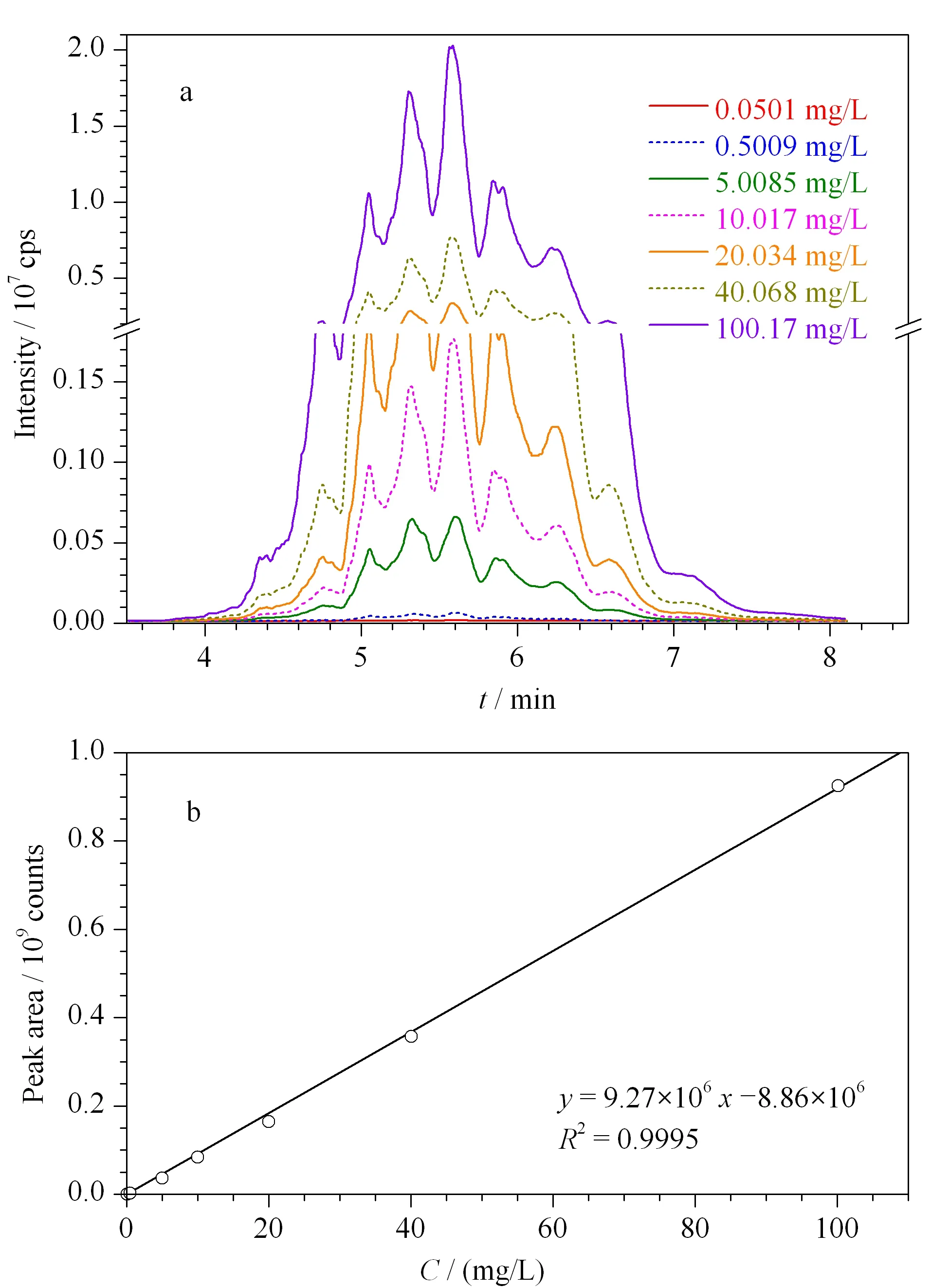
图 3 (a)采用选择离子扫描方式所检测的不同质量浓度SCCPs的SIM色谱图及(b)所检测的SCCPs的校正曲线Fig. 3 (a) SIM chromatograms of different mass concentrations of SCCPs detected using selective ion scanning mode, and (b) calibration curve for SCCPs
2.4 方法评价
2.4.1线性范围、检出限和定量限
在最佳的提取条件下,我们对方法的线性范围、检出限和定量限进行了评价。对质量浓度为 0.050 1~100.17 mg/L 的一系列SCCPs标准溶液进行选择离子扫描定量分析(见图3a),以色谱峰面积对标准溶液浓度作图,得到关于SCCPs的标准工作曲线(见图3b)。按照本方法中的程序逐级稀释标准溶液,以3倍信噪比所对应的最低检出浓度、取样量及样品溶液的定容体积确定方法的检出限,以10倍信噪比所对应的最低定量浓度、取样量及样品溶液的定容体积确定方法的定量限。结果表明,本方法中SCCPs的线性范围为 0.050 1~100.17 mg/L,线性方程为y=9.27×106x-8.86×106(其中y为色谱峰面积;x为SCCPs的总质量浓度,mg/L),线性相关系数R2为 0.999 5;方法的检出限低至0.50 μg/g(即 0.000 050% ),定量限低至1.7 μg/g。而文献[6,10,24]中报道的检出限为30~1 000 μg/g,因此本方法检测SCCPs的灵敏度更高。
2.4.2回收率和精密度
在优化的实验条件下对空白运动场所合成材料面层样品和稀释剂样品中分别添加低、中和高3个水平的SCCPs标液进行提取,标液的质量浓度分别为5.0、20.0和100.2 mg/L,加标体积均为1.0 mL,采用选择离子扫描模式定量,平行测定6次。结果表明,该方法的回收率为83.2% ~96.3% ,相对标准偏差为1.56% ~6.02%(见表2)。
2.5 实际样品的分析
本实验从广州杰锐体育设施有限公司购买了5批次硅PU球场样块和5批次稀释剂进行分析。从图4可以看出,目标化合物的色谱峰形良好,没有明显的杂质干扰,说明所建立的方法可行,能满足运动场所合成材料面层和稀释剂中SCCPs的定量分析要求。所分析的10批次的样品均检出了SCCPs, 5批次硅PU球场样块中SCCPs的含量分别为0.28% 、0.21% 、0.37% 、0.55%和0.24% ,而5批次稀释剂中SCCPs的含量分别为0.029% 、0.033% 、0.052% 、0.038%和0.016% 。含量均在0.016% ~0.55%之间,符合欧盟对SCCPs的限值(1% )要求。
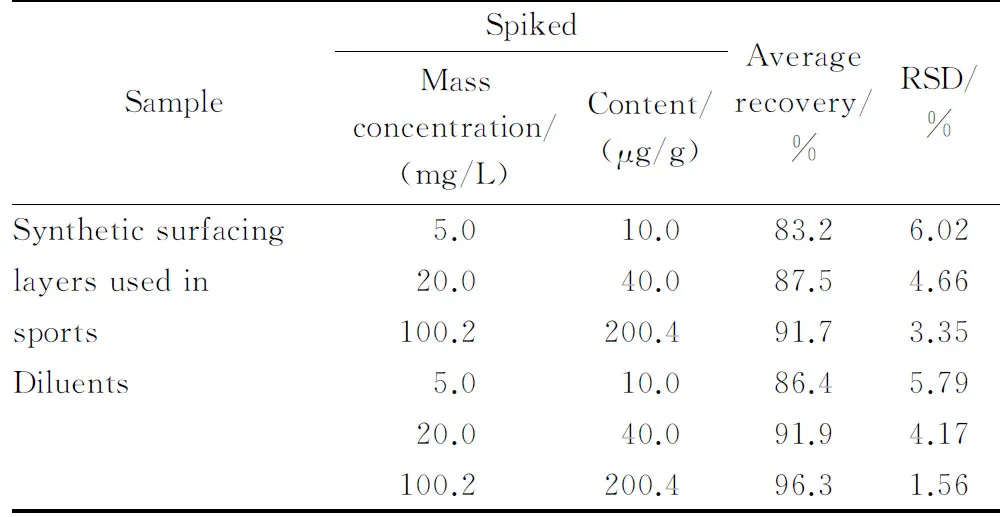
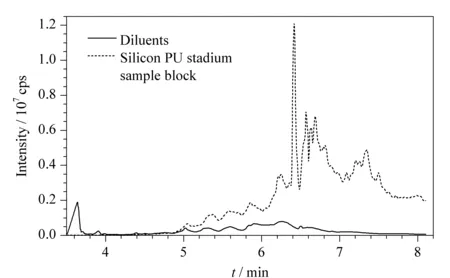
图 4 所检测样品硅PU球场样块及稀释剂中SCCPs的SIM色谱图Fig. 4 SIM chromatograms of SCCPs in the tested samples of silicon PU stadium sample block and diluents
3 结论
实际样品中SCCPs的含量测试是目前分析工作中的一个难点,迄今为止尚未建立重现性好的普适性的测定方法。本论文使用常用的气相色谱-质谱联用仪,首先从气相色谱-质谱分析条件的优化入手,通过优化正和负化学离子源的选择、快和慢速程序升温方式的选择、灯丝发射电流的选择、电子轰击能量的选择、定量和定性监测离子的选择等重要色谱和质谱参数,提高SCCPs的响应值,从而提高分析的灵敏度。其次,通过优化样品的前处理方法,主要包括提取条件和净化条件,提高SCCPs的提取效率和减少样品基质对测试的干扰。所建立的SPE-GC-NCI-MS方法可用于SCCPs总含量的准确测定,具有宽的线性范围、低的检出限和定量限、良好的回收率和精密度以及良好的选择性,适用于运动场所合成材料面层、稀释剂等复杂基质样品中SCCPs的检测分析。

