整体柱固相萃取-液相色谱-串联质谱法在线分析大米中15种酰胺类除草剂残留量
张海超, 艾连峰, 马育松, 王 敬, 李晓菲
(河北出入境检验检疫局, 河北 石家庄 050051)
在近代农业生产中,酰胺类除草剂因其杀草谱广、效果突出、易降解等优点,成为目前世界上应用较广泛的除草剂之一[1]。该类除草剂在给人类带来了巨大利益的同时,也对人类造成了潜在的危害。据研究,酰胺类除草剂具有较高的毒性,在体内可降解转化成二烷基醌亚胺,这种物质具有致癌作用,使人和动物发生癌症的风险极大提高[2],因此酰胺类除草剂的残留问题也受到了人们的广泛关注。
大米因其丰富的营养价值被称为五谷之首,是我国重要的粮食作物,约占粮食作物栽培面积的四分之一,世界上有一半人口以大米为主食。酰胺类除草剂对于稻米田杂草的防治具有重要作用,但如果在施药过程中存在滥用、乱用的行为,将会在大米中造成一定量的农药残留,危害食用者的健康。世界各国都对大米中酰胺类除草剂的残留量制定了严格的限量标准,如欧盟规定大米中甲草胺、敌稗、二甲吩草胺为0.01 mg/kg,敌草胺和氟噻草胺为0.05 mg/kg[3];日本规定大米中丙草胺为0.03 mg/kg,异丙甲草胺为0.1 mg/kg[4]。我国国家标准GB 2763-2016中对大米中丙草胺的限量规定为0.1 mg/kg,丁草胺为0.5 mg/kg,并且在2017年及2018年国家食品安全监督抽检实施细则中丙草胺和丁草胺分别被列为大米必检的农残检测项目。因此,建立大米中酰胺类除草剂残留快速、灵敏的检测方法具有重要意义。
大米中含有较多的淀粉和油脂,由于基质的复杂性,需要对样品进行前处理以去除杂质干扰。文献报道中关于酰胺类除草剂所采用的前处理净化方式有QuEChERS法[5-8]、固相萃取(SPE)[9-11]、固相微萃取(SPME)[12-14]及近年来一些新兴的方法如磁性固相萃取(MSPE)[15]和悬浮固化液相微萃取(SFO-LPME)[16]等。但是,这些传统或新兴的方法均存在一定缺陷,如QuEChERS法对于复杂基质去除干扰物质的能力依然略显不足;固相萃取操作繁琐,有机溶剂使用量大;磁性固相萃取的表面活性剂涂层易被破坏扩散到解吸溶剂中。且这些净化方式均为离线操作,速度慢,严重影响了检测效率。本文所采用的整体柱(monolithic column)是由甲基丙烯酸丁酯为功能单体,通过混合交联剂、致孔剂等原位聚合制备而成的具有疏水作用的连续棒状整体,具有很好的多孔性和渗透性。另外,整体柱性质稳定,具有良好的生物兼容性,可以反复多次使用,已在食品安全领域得到一些应用[17-22]。本实验将该在线整体柱作为萃取介质,结合三重四极杆串联质谱分析了大米中15种酰胺类除草剂的残留,该方法简便、高效、可靠。
1 实验部分
1.1 仪器与试剂
在线净化液相色谱-串联质谱仪(Thermo Fisher公司,美国),由CTC多功能自动进样器(配有200 μL定量环)、两个耐压 125 MPa (1 250 bar)的四元梯度液相泵、多元柱切换装置和TSQ Quantum Ultra三重四极杆质谱仪组成;LC-2010型高效液相色谱仪(Shimadzu公司,日本),配紫外检测器;DKZ-2型电热恒温振荡水槽(上海精宏实验设备公司,中国); Sigma 3K-15型离心机(Sigma公司,美国); PT2100型均质器(Kinematica公司,瑞士);涡旋混合器(Scientific Industries,美国)。
甲基丙烯酸丁酯(butyl methacrylate, BMA)和乙二醇二甲基丙烯酸酯(ethylene dimethacrylate, EDMA)均购自阿拉丁试剂公司;正丙醇购自天津市光复精细化工研究所;偶氮二异丁腈(AIBN)和聚乙二醇400(PEG-400)购自天津市大茂化学试剂厂;色谱纯甲酸购于北京迪马科技有限公司;色谱纯乙腈、甲醇、丙酮、异丙醇购自飞世尔试剂公司;分析纯无水硫酸钠购自国药集团化学试剂有限公司;实验所用纯水均由美国Milli-Q纯化系统(Millipore公司,美国)制得。
标准品:敌草胺(napropamide, CAS号:15299-99-7)、苯噻酰草胺(mefenacet, CAS号:73250-68-7)、二甲吩草胺(dimethenamid, CAS号:87674-68-8)、敌稗(propanil, CAS号:709-98-8)、双苯酰草胺(diphenamid, CAS号:957-51-7)、吡草胺(metazachlor, CAS号:67129-08-2)、毒草胺(propachlor, CAS号:1918-16-7)、丁草胺(butachlor, CAS号:23184-66-9)、丙草胺(pretilachlor, CAS号:51218-49-6)、吡氟酰草胺(diflufenican, CAS号:83164-33-4)、异丙甲草胺(metolachlor, CAS号:87392-12-9)、乙草胺(acetochlor, CAS号:34256-82-1)、牧草胺(tebutam, CAS号:35256-85-0)、甲草胺(alachlor, CAS号:15972-60-8)、氟噻草胺(flufenacet, CAS号:142459-58-3)标准品均购于德国Dr. Ehrenstorfer公司,纯度大于97% 。
1.2 混合标准溶液的配制
分别称取15种酰胺类除草剂标准品10.0 mg(折合纯度后)于10 mL棕色容量瓶中,用甲醇溶解、定容,得到1 g/L 的单标储备液,于4 ℃下避光保存。根据需要,准确移取15种除草剂标准储备液,用甲醇稀释成10 mg/L 混合标准工作液,待用。
1.3 poly(BMA-co-EDMA)整体柱的制备
参照文献方法[19],将1.0 mmol单体BMA、3.0 mmol交联剂EDMA、13.0 mmol正丙醇和2.5 mmol聚乙二醇400、10 mg引发剂偶氮二异丁腈在室温下超声混合、脱气后灌入不锈钢柱管(50 mm×2.1 mm)中,两端密封。实验在水浴温度55 ℃、反应时间8 h条件下制备整体柱。反应结束后,将poly(BMA-co-EDMA)整体柱接入LC-2010型高效液相色谱高压泵,用甲醇冲洗该整体柱以除去未反应的单体和致孔剂,得到poly(BMA-co-EDMA)柱,备用。
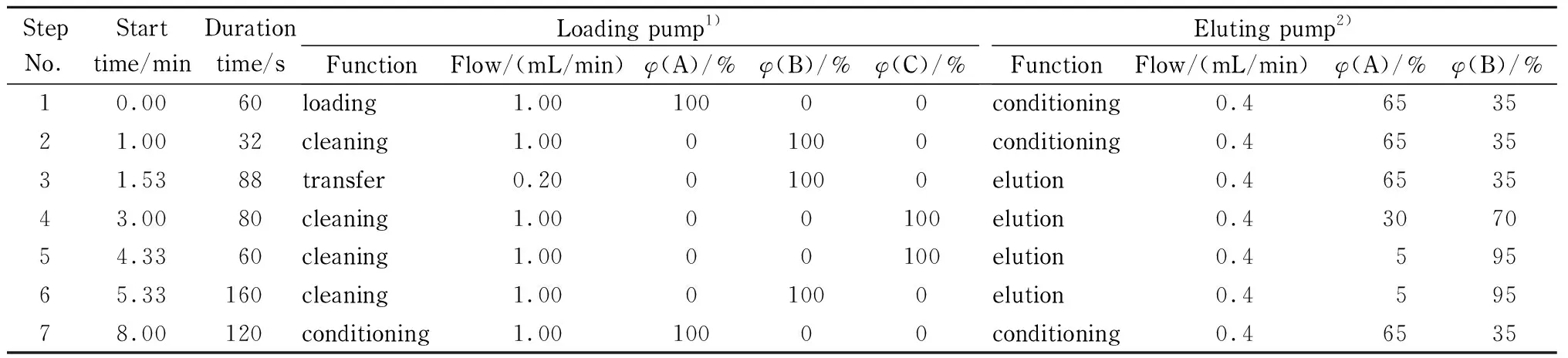
表 1 在线净化及色谱分离的梯度洗脱程序
1) A: water; B: acetonitrile; C: acetone-acetonitrile-isopropanol (1∶1∶1, v/v/v). 2) A: 0.5%(v/v) formic acid aqueous solution; B: acetonitrile.
1.4 样品制备
称取5 g(精确到0.01 g)粉碎均匀的大米试样,置于50 mL离心管中,加入10 mL水涡旋混匀浸泡10 min。加入25 mL乙腈和8 g无水硫酸钠迅速摇匀,用均质器以 10 000 r/min 均质1 min后,在5 000 r/min 下离心5 min。准确移取5.0 mL提取液在40 ℃水浴中氮气流吹干。准确加入500 μL甲醇涡旋1 min,再加入500 μL水混匀过0.22 μm滤膜,进样测定。
1.5 在线净化固相萃取与HPLC-MS/MS条件
1.5.1在线净化及HPLC条件
在线净化程序主要通过两个泵和两个六通阀的切换实现流路在固相萃取柱和色谱柱之间的流动,完成分析测定的在线自动化。在线固相萃取程序(TFC)分为4个部分:上样、淋洗、洗脱和条件化。流动相A为水,B为乙腈,C为丙酮-乙腈-异丙醇(1∶1∶1, v/v/v),进样量为50 μL;样品在上样溶液水的带动下流经poly(BMA-co-EDMA)在线固相萃取柱,目标分析物保留在净化柱上。淋洗时使用乙腈将吸附在净化柱上的部分杂质冲洗下来排入废液,同时要保证目标化合物不被洗脱。在洗脱过程中,采用乙腈将分析物洗脱,切入至分析柱中进行分离分析。最后的条件分为两部分:在线固相萃取柱的冲洗及平衡,同时,洗脱泵驱动分析流动相在分析柱上完成目标化合物的分离。
HPLC分离采用Hypersil GOLD柱(150 mm×2.1 mm, 5 μm)为分析柱,分析流动相A为0.5%(v/v)的甲酸水溶液,流动相B为乙腈。整个过程只有洗脱步骤中净化柱与分析柱连接,在其余步骤中在线固相萃取净化柱与分析柱均未连接,TFC程序切入废液。TFC每步的变化采用瞬变模式,HPLC每步的变化除最后一步采用瞬变模式外其他步骤间的改变采用渐变模式,整个运行时间为10 min。最终建立的在线净化梯度洗脱程序见表1。
1.5.2质谱条件
电喷雾离子源正离子(ESI+)模式;多反应监测(MRM)扫描;电喷雾电压 3 500 V;离子源温度200 ℃;毛细管温度350 ℃;辅助气压力40 unit;鞘气压力30 unit;源内诱导解离电压10 V; Q1和Q3单位分辨率0.7 U;定性离子对、定量离子对和碰撞能量见表2。

* Quantitative ion pair.
2 结果与讨论
2.1 前处理条件的选择和优化
本方法所测定的化合物都是相对分子质量在200~400范围内、具有氨基的化合物,溶于丙酮、甲醇、乙腈等有机溶剂。大米基质的干扰成分主要是淀粉和油脂等,因此为降低提取过程中带来的基质干扰,选择了极性相对较强的乙腈作为提取溶剂。同时实验发现在去除水分的步骤中采用氯化钠进行盐析分层得到的上清溶液在氮吹后有较多的固体残渣,影响了分析物的复溶,导致部分化合物(吡氟酰草胺和丁草胺)回收率极低。而采用适量无水硫酸钠吸收水分得到的上清溶液在氮吹后固体残渣显著减少,且不影响提取效率。
同时,定容液的选择对化合物在整体柱上的保留情况有着重要的影响,实验以水为上样溶液、采用不接分析柱、分流进质谱的模式考察了以不同比例的甲醇和水为上样溶液时目标物在整体柱上的保留情况。如图1所示,在整体柱上保留较弱的4个化合物毒草胺、双苯酰草胺、二甲吩草胺和吡草胺在定容液中甲醇体积分数分别为90%、70%、50%时的色谱图,发现化合物随着定容液中甲醇比例的减小,在整体柱上的保留行为增强。当甲醇体积分数为50%时可保证化合物全部保留在整体柱上,且该定容液可完全溶解目标物。
2.2 质谱条件的选择和优化
用蠕动泵以10 μL/min 流速向质谱系统分别注入各化合物1 mg/L 标准溶液,确定其最佳质谱条件。各化合物的标准溶液和HPLC的流动相混合进入ESI电离源,在正离子扫描模式下进行一级全扫描质谱分析,大部分化合物为[M+H]+峰。甲草胺、乙草胺和丁草胺分子离子峰响应极低,但这3个化合物的部分碎片甲草胺m/z238.1、乙草胺m/z224.0和丁草胺m/z238.1却出现极高的响应且较为稳定,分析原因可能是这3种化合物在离子化过程中极不稳定出现断裂。导致甲草胺出现[C13H16ClNO+H]+峰、乙草胺出现[C12H14ClNO+H]+峰、丁草胺出现[C13H16ClNO+H]+峰。选择甲草胺m/z238.1、乙草胺m/z224.0、丁草胺m/z238.1作为母离子,有效解决了甲草胺和乙草胺这对同分异构体的色谱分离问题,同时甲草胺和丁草胺在表1色谱条件下也可达到有效的分离。其全扫描质谱图和母离子可能的裂解示意图见图2。
2.3 在线净化条件的优化
实验采用不接分析柱、分流进质谱、反相洗脱优化每一步过程。首先选定水作为上样溶液,发现可对所有目标化合物实现保留。淋洗和洗脱溶液比较了甲醇和乙腈,最后均选用具有较好洗脱能力的乙腈溶液,可保证化合物更快进入分析柱。在洗脱时需将目标化合物从在线固相萃取柱转移至分析柱,与分析柱流动相合并切入质谱,见表1第3步,因此洗脱流动相流速不能过高,在柱压允许情况下选定为0.2 mL/min,在该流速下约88 s可保证目标物全部洗脱且不会对色谱峰形造成溶剂效应。在确定好洗脱时间后,对淋洗时间进行优化,淋洗时间过短会导致过多废液切入质谱,过长会导致目标物切入废液。通过不断优化确定淋洗时间为32 s,见表1第2步。切入质谱时间为最大限度地保证更少的杂质、更多的目标物切入质谱,优化后的在线净化过程所得的色谱图见图3。最后再用强淋洗溶剂丙酮-乙腈-异丙醇(1∶1∶1, v/v/v)洗掉在线净化柱上的强保留杂质,并以在线净化流动相A初始化在线净化柱,以备下一个样品的分析,最后建立了表1的梯度条件。

图 1 不同定容液对4种除草剂在整体柱上保留的影响Fig. 1 Effect of different methanol volume ratios on the retention of the four herbicides on monolith column
2.4 色谱条件的优化
分析柱是将由在线净化柱洗脱下的分析物进行分离。实验选用甲酸水溶液和乙腈作为流动相进行梯度洗脱,发现甲酸含量对部分化合物灵敏度有着很大的影响,为得到最优的分析条件,实验对不同浓度的甲酸溶液进行了比较。最后选用0.5%(v/v)甲酸溶液为水相,乙腈为有机相,采用梯度洗脱条件时,所有化合物的峰形较好,灵敏度较高(如图4)。
2.5 基质效应、线性范围、检出限和定量限
根据分析物的灵敏度,分别采用大米的空白基质溶液和甲醇-水(1∶1, v/v)配制成质量浓度为0.5、1、2、5、10、20、50、100 μg/L 的系列标准工作溶液,依次进样测定,进样量50 μL。以各组分的峰面积对其质量浓度绘制标准曲线,将基质标准曲线斜率k1与溶剂标准曲线斜率k2进行比较,根据如下公式计算基质效应:ME=k1/k2。结果显示,ME在0.54~1.24之间,个别化合物存在一定的基质效应,因此选用大米基质配制标准工作液以保证定量结果的准确性。各组分在相应的线性范围内,峰面积与质量浓度成良好的线性关系,相关系数(r)大于0.998(见表3)。在空白大米基质中添加不同质量浓度的待测物,计算方法的检出限(LOD,S/N=3)和定量限(LOQ,S/N=10),分别为0.20~2.0 μg/kg 和0.50~5.0 μg/kg(见表3)。

图 2 甲草胺、乙草胺和丁草胺全扫描质谱图及母离子产生的方式Fig. 2 Full scan mass spectra and proposed dissociation mode of alachlor, acetochlor and butachlor

图 3 优化后的15种除草剂在线净化条件色谱图(不接分析柱)Fig. 3 Chromatogram of the 15 amide herbicides under optimized on-line cleanup conditions (not connected to the analytical column)

图 4 15种酰胺类除草剂的标准MRM色谱图Fig. 4 MRM chromatograms of mixture of the 15 amide herbicide standards

表 3 15种除草剂的线性方程、线性范围、相关系数、检出限和定量限
y: peak area;x: mass concentration, μg/L.

表 4 空白大米中15种酰胺类除草剂的加标回收率和精密度(n=6)
* Spiked levels are 5, 10, 50 and 100 μg/kg for propanil.
2.6 方法的回收率和精密度
采用标准加入法进行试验。取已制备均匀的空白样品,准确加入15种除草剂的混合标准溶液,添加浓度分别为2、5、10和50 μg/kg(敌稗为5、10、50和100 μg/kg)的样品各6份,按上述优化后的方法进行分析。采用大米空白基质溶液配制系列标准溶液,外标法进行定量分析,计算平均回收率和精密度(见表4)。结果表明,所有农药的回收率均在75.5% ~121.3%之间,精密度也均小于15% ,符合国内外相关要求。
2.7 实验方法与传统方法对比
大米基质中酰胺类除草剂的传统净化方式多采用离线固相萃取。本文与传统测定方法在预处理过程中有机试剂用量、耗时长短、萃取柱可重复利用3方面进行了对比。由表5可知,本前处理方法消耗试剂量更少,耗时更短,成本更低。且在线整体柱不需要实验人员对固相萃取柱进行活化、上样、洗脱等操作,减少了人为操作误差。同时在线固相萃取方式也并未增加仪器测定时长,10 min可完成一次样品分析。

表 5 本实验方法与文献方法的分析结果对比
2.8 实际样品测定
应用该在线净化分析测定方法对送检的13份大米样品进行分析,其中1份检出乙草胺,含量为4.5 μg/kg。
3 结论
本方法以甲基丙烯酸丁酯为单体,乙二醇二甲基丙烯酸酯为交联剂构筑了疏水在线整体柱,构建了整体柱在线固相萃取与三重四极杆串联质谱联用测定大米中15种酰胺类除草剂的检测手段。该整体柱制备简单,可重复多次使用,大大降低了成本和对环境的污染。与传统净化方式相比,在线净化技术简化了前处理过程,操作简单、快速,提高了工作效率。该方法快速,准确,成本低,可用于大米中15种酰胺类除草剂的检测。

