基于可变亲水性溶剂的液液微萃取-气相色谱-质谱法分析尿中的2′-氯地西泮
徐仿敏, 李海波, 魏万里, 刘凌云, 李 强
(1. 江阴市公安局物证鉴定室, 江苏 江阴 214431; 2. 常州市公安局物证鉴定所, 江苏 常州 213001; 3. 无锡市公安局物证鉴定所, 江苏 无锡 214001)
液液微萃取技术(liquid-liquid microextraction, LLME)是20世纪90年代Jeannot等[1]在传统液液萃取的基础上提出的新型样品前处理技术。该技术经过多年的发展,不断改进,从最初的单滴液液微萃取(single drop microextraction, SDME)[1]到中空纤维液液微萃取(hollow-fiber-protected liquid-phase microextraction, HF-LPME)[2-4]、分散液液微萃取(dispersive liquid-liquid microextraction, DLLME)[5-7],再到近年来基于可变亲水性试剂的均相液液微萃取(switchable-hydrophilicity solvent homogeneous liquid-liquid microextraction, SHS-LLME)[8]。与传统液液萃取相比,液液微萃取具有操作简便、萃取效率高、富集效果好、耗时少、所需有机溶剂少等优点,属于环境友好型前处理技术。
SHS-LLME是2010年Jessop等[8]提出的绿色高效的萃取技术,该技术使用的萃取剂是一类可变的亲水性试剂,主要包括二丙胺(dipropylamine, DPA)、三乙胺(triethylamine, TEA)、N,N-二甲基丁胺(N,N-dimethylbutylamine, DMBA)、N,N-二甲基环己胺(N,N-dimethylcyclohexylamine, DMCHA)等[9,10],它们在二氧化碳气体存在下能够与水相互溶形成均相体系。但是当体系中通入空气或者加热时,这类亲水性试剂会转换成疏水性试剂,实现两相分离。这是由于在CO2存在的情况下,可变亲水性试剂会在水中与CO2反应生成碳酸氢盐,形成与水相互溶的均相体系。当加热或者通入空气等其他气体的时候,CO2容易被置换溢出,可变亲水性试剂重新转变成疏水性试剂,使均相体系又转变为两相体系,实现有机相的分离,从而完成萃取过程。该类试剂的亲水性和疏水性变换可以通过调节pH值来完成,在短时间内形成含有无数有机小液滴的乳浊液,实现两相的最大接触,提高萃取效率。目前,该萃取技术已经被应用到多个领域[11-14]。
2′-氯地西泮属于苯二氮卓类药物,在20世纪60年代被首次合成出来[15],由于它的安全问题而未被允许进行临床试验,因此在全球范围内均未被批准作为药物来使用。它具有抗焦虑、抗惊厥、镇静和肌肉松弛等作用[16,17]。近年来该药物在网络上非法销售,并被不法分子用来实施抢劫、强奸等犯罪活动。目前,生物检材中2′-氯地西泮的前处理方法主要有直接过滤进样法[18]和液液提取法[19,20]等,主要的检测方法有液相色谱-串联质谱法(liquid chromatography-tandem mass spectrometry, LC-MS/MS)[18-20]和毛细管电泳-串联质谱法(capillary electrophoresis-tandem mass spectrometry, CE-MS/MS)[21]等。
本文旨在将SHS-LLME技术应用到法庭科学领域,并用盐酸和氢氧化钠代替CO2调节pH值,实现亲水性和疏水性的切换,达到萃取的目的。最终建立SHS-LLME联合气相色谱-质谱法(gas chromatography-mass spectrometry, GC-MS),分析尿液中的2′-氯地西泮,并对该方法进行评价。
1 实验部分
1.1 仪器与试剂
1.1.1仪器
Trace 1310-ISQ LT气相色谱质谱仪(美国赛默飞世尔科技); TDL-80-2B离心机(上海安亭科学仪器厂); SK-1快速混匀器(金坛市顺华仪器有限公司);氮吹仪(上海安普科学仪器有限公司)。
1.1.2试剂
二丙胺、三乙胺、N,N-二甲基环己胺、无水乙醇(均为色谱纯,百灵威公司);盐酸、氢氧化钠(均为分析纯,上海化学试剂有限公司); 2′-氯地西泮(纯度98.4% ,挪威Chiron公司);蒸馏水。
1.1.3仪器条件
色谱柱:VF-5ms(30 m×0.25 mm×0.25 mm);柱温:120 ℃,保持1 min, 20 ℃/min 升至280 ℃,保持4 min;载气:He;流速:1.0 mL/min;进样口温度:280 ℃;进样量:1 μL,不分流进样。离子源温度:300 ℃;传输线温度:280 ℃;离子源:EI; EI电压:70 eV;扫描范围:45~450 amu;溶剂延迟:4 min;全扫描模式(full scan)采集总离子流色谱图。
1.2 实验方法
1.2.1样品制备
空白尿液由近期未服用任何药物的健康自愿者提供,在-18 ℃的冰箱中保存,使用前在室温下解冻。
1.2.2均相亲水性试剂的制备
分别将DPA、TEA、DMCHA与6 mol/L HCl按照体积比1∶1.4配制成均相的亲水性试剂,每份均相亲水性试剂配制50 mL,备用。
1.2.3SHS-LLME微萃取过程
取2.0 mL待测样品于5 mL玻璃试管中,首先加入1.2.2节中配制的均相亲水性试剂,与待测样品混匀,形成均相体系;然后加入6 mol/L 的NaOH溶液,亲水性试剂迅速转变成疏水性试剂,产生无数有机小液滴,使整个体系快速形成乳浊液,实现两相分离,完成萃取过程。以3 000 r/min 的速度离心5 min,提取上层有机相,在氮气流下吹干,用50 μL无水乙醇复溶,待测。萃取流程详见图1。
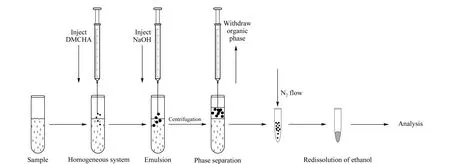
图 1 SHS-LLME萃取流程图Fig. 1 Procedure of the switchable hydrophilictiy solvent homogeneous liquid-liquid microextraction (SHS-LLME) DMCHA: N,N-dimethylcyclohexylamine.
2 结果与讨论
在SHS-LLME微萃取过程中,有许多参数影响着萃取效率。本文主要对HCl的用量、SHS的种类、均相SHS的用量、NaOH的用量、萃取时间等参数进行考察,并对所建立的实验方法进行方法学评价。
2.1 实验参数考察
2.1.1HCl的用量
多数文献[22-25]报道是通过加入干冰的形式获得均相亲水性试剂。由于干冰不易保存,在配制过程中存在一定困难。因此,本文中使用HCl替代干冰制备均相亲水性试剂。按照SHS与HCl(6 mol/L)体积比分别为1∶1、1∶1.1、1∶1.2、1∶1.3、1∶1.4、1∶1.5配制。结果发现:当SHS与HCl的体积比为1∶1、1∶1.1、1∶1.2、1∶1.3时,SHS仍然存在分层现象,不能形成均相体系;当体积比达到1∶1.4和1∶1.5时,SHS与HCl互溶,形成均相体系。考虑到如加入较多的HCl,在后续的实验中就需要加入较多的NaOH进行中和。因此,按照SHS与HCl体积比1∶1.4配制均相亲水性试剂。
2.1.2SHS的种类
亲水性试剂需要满足以下两个条件才具备可切换的性质:第一,正辛醇/水分配系数(logKow)大约在1.2到2.5之间;第二,酸度系数pKa大于9.5。根据资料,显示DPA的logKow=1.64, pKa=11.05; TEA的logKow=1.47, pKa=10.68; DMCHA的logKow=2.04, pKa=10.48; 3种试剂均具备可切换亲水性试剂的性质[10]。因此,本实验选取这3种亲水性试剂作为考察对象,进行优化选择。
根据单一变量的考察模式,在其他实验条件固定不变的情况下,空白添加样品中分别加入300 μL 1.2.2节中配制的DPA、TEA、DMCHA均相亲水性试剂,按照1.2.3节操作,比较2′-氯地西泮的峰面积,选择最佳SHS种类。结果发现,加入TEA的样品中,随着pH值的改变,并未产生有机相的分离现象,无法满足实验需要。比较DPA和DMCHA的萃取效果,发现以DMCHA为萃取剂进行分析的样品获得的萃取效果最好,峰面积最大。因此,选择DMCHA为最佳亲水性试剂。
2.1.3均相DMCHA的用量
在SHS-LLME萃取过程中,均相DMCHA的用量直接影响着萃取效率。为了获得最佳的均相DMCHA用量,在其他实验条件不变的情况下,分别考察了100、200、300、400、500 μL的用量,实验结果见图2。随着均相DMCHA用量的增加,2′-氯地西泮的峰面积也随之增加;当用量达到400 μL时,峰面积基本达到最大;随着用量继续增加到500 μL,峰面积基本保持在一个平衡的状态。因此本实验选取均相DMCHA的最佳用量为400 μL。
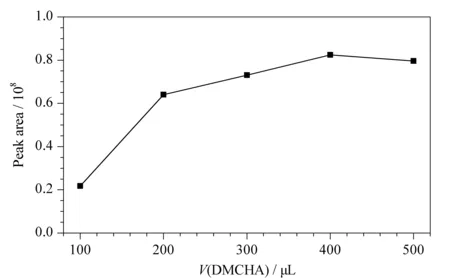
图 2 均相DMCHA的体积对萃取效率的影响Fig. 2 Efficiency of the volume of homogeneous N,N-dimethylcyclohexylamine (DMCHA)
2.1.4NaOH的用量
在SHS-LLME萃取过程中,NaOH的主要作用是中和HCl、调节pH值。加入NaOH能使亲水性DMCHA转换成疏水性DMCHA,实现两相分离,完成萃取过程。因此NaOH的用量直接影响萃取效率。
在其他实验条件不变的情况下,分别加入200、300、400、500 μL的NaOH(6 mol/L),考察NaOH的最佳用量。实验结果表明:随着加入NaOH体积的增加,2′-氯地西泮的峰面积也增大;当体积增大至300 μL以后,2′-氯地西泮的峰面积基本保持平衡。因此,选择300 μL作为NaOH的最佳用量。
2.1.5萃取时间
在SHS-LLME萃取过程中,萃取时间被定义为从加入NaOH到离心前的时间间隔。在其他实验条件不变的情况下,分别考察了不同萃取时间(1、2、3、4、5、10 min)对萃取效率的影响。结果表明,在不同萃取时间下,2′-氯地西泮的峰面积基本保持在一个平衡状态。这表明,SHS-LLME萃取过程短时间内就迅速达到了平衡。这是由于均相的DMCHA与样品混溶,当加入NaOH时,HCl被迅速中和,与此同时,亲水性的DMCHA快速转换为疏水性的DMCHA,形成无数有机小液滴,使整个样品溶液变成乳浊液,从而实现有机相与水相充分接触,2′-氯地西泮能够在短时间内由样品中转移到DMCHA中,快速完成萃取过程。所以,在SHS-LLME萃取过程中,萃取时间对萃取效率基本没有影响,因此,本实验选择的萃取时间为不少于1 min。
2.2 方法学评价
在最佳实验条件下,空白尿液和空白加标尿液的总离子流色谱图见图3, 2′-氯地西泮的保留时间为10.34 min,定性离子为m/z283、318、290、255,定量离子为m/z283。
2.2.1工作曲线与检出限
以空白尿液为基体,分别配制2′-氯地西泮质量浓度为0.025、0.05、0.1、0.25、0.5、1、2.5 mg/L 的系列工作液,按照优化的实验条件进行检测,每个样品平行测定2次,取平均值。以2′-氯地西泮的峰面积(y)为纵坐标,质量浓度(x, mg/L)为横坐标绘制工作曲线。线性回归方程为y=1.86×108x-1.18×106,相关系数r2=0.994 6,线性范围为0.025~2.5 mg/L。通过3倍信噪比(S/N)得出检出限为0.007 mg/L。
2.2.2精密度与回收率
取空白尿液,分别配成0.05、0.25、1.0 mg/L 3个水平的工作液,用于计算日内回收率和日间回收率。结果见表1,回收率为76.5% ~90.3% ,日间精密度为3.6% ~5.0% ,日内精密度为3.3% ~6.5% 。
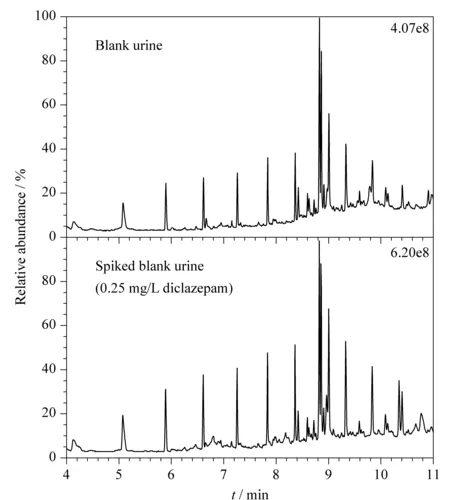
图 3 空白尿液和空白加标尿液(0.25 mg/L 2′-氯地西泮)的总离子流色谱图Fig. 3 Total ion chromatograms of blank urine, and spiked blank urine (0.25 mg/L diclazepam)

2.3 实际样品检测
采用本实验所建立的方法,对疑似被迷奸的受害人尿液进行分析。结果,在受害人的尿液中检出2′-氯地西泮,同时还检出地洛西泮和劳拉西泮。总离子流色谱图和质谱图见图4。
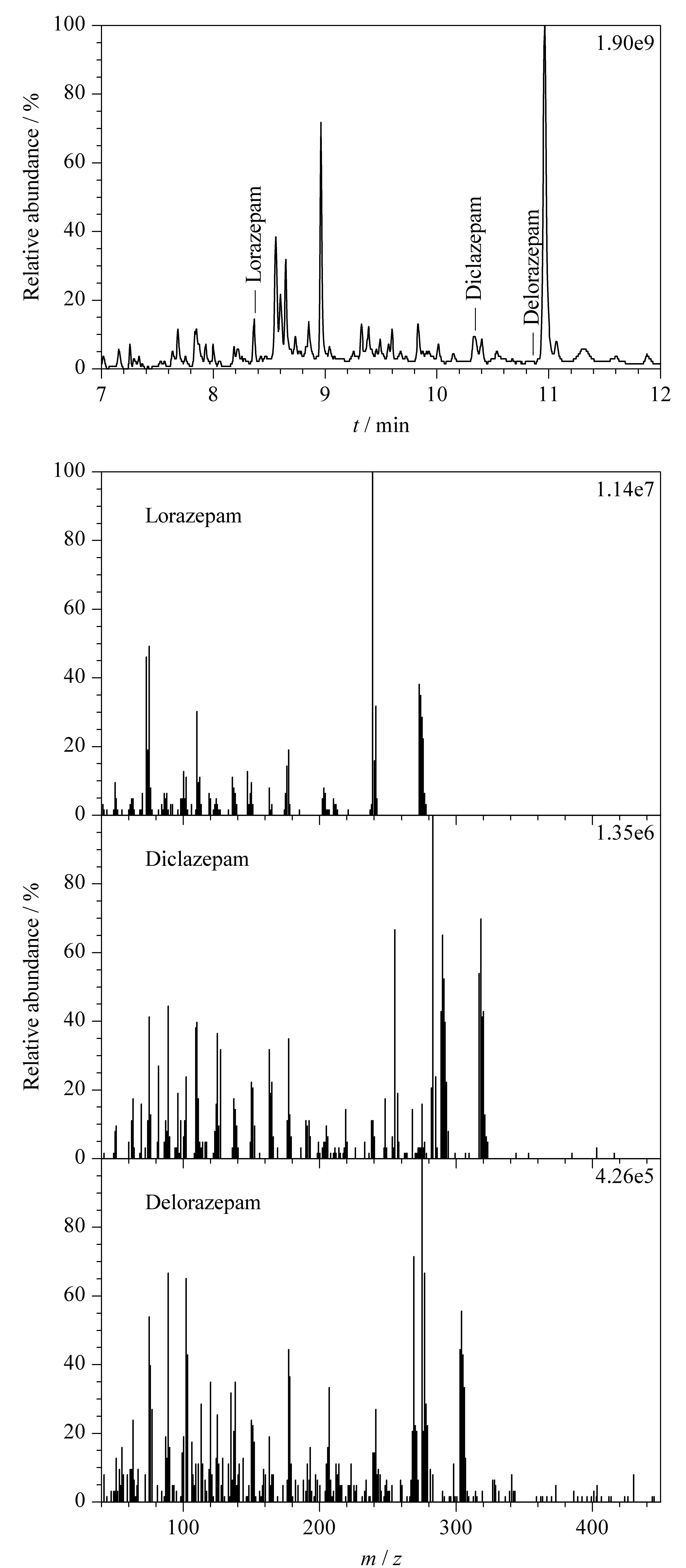
图 4 尿液中劳拉西泮、2′-氯地西泮和地洛西泮的总离子流色谱图和质谱图Fig. 4 Total ion chromatogram and mass spectra of lorazepam, diclazepam, and delorazepam in urine
由于2′-氯地西泮的含量低于本实验方法的定量限,因此无法计算含量。根据Moosmann等[16]的研究,2′-氯地西泮在体内首先代谢为地洛西泮和洛甲西泮,然后进一步代谢为劳拉西泮。由此可见,本实验方法既能检测尿液中的2′-氯地西泮,还能检测2′-氯地西泮的代谢产物,能够满足实际案件的检验需要。
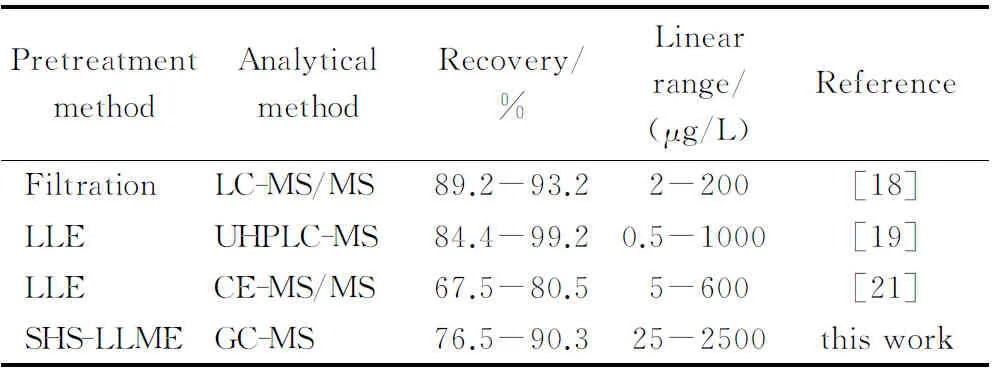
2.4 与文献方法对比
将实验结果与文献方法进行对比(见表2),本方法选用GC-MS进行分析,灵敏、准确,回收率、线性范围、灵敏度均能满足实际检验需求。
3 结论
本工作采用SHS-LLME结合GC-MS法分析尿液中的2′-氯地西泮。以DMCHA为可切换亲水性试剂,使用HCl和NaOH代替CO2实现DMCHA由亲水性到疏水性的转换,完成萃取过程。该方法操作简单、快捷、线性范围良好,回收率和精密度均能满足检验需求,能够运用于实际案件中2′-氯地西泮的分析检验,为该萃取技术在法庭科学领域的应用提供参考。

