滋补脾阴方药对脾阴虚大鼠空肠葡萄糖转运蛋白1、葡萄糖转运蛋白5表达的影响*
孙晓霞,战丽彬**,侯圣林,江玉翠,杨关林
(1.南京中医药大学基础医学院,中医脾藏象现代研究实验室 南京 210023;2.辽宁中医药大学 沈阳 110032)
“脾主运化”为“后天之本”的物质基础,是指将饮食水谷消化、吸收并将其中之精微转输至周身的过程。这一过程伴随着能量不断的生成与消耗,实现对物质与能量代谢的调控[1]。糖类作为一种精微物质,能够为机体提供所需能量,保障生命活动的顺利进行[2]。糖类在小肠的吸收是运化精微的重要表现形式之一[3]。葡萄糖转运蛋白(glucose transporters,GLUTs)作为一种跨膜运载体,是以易化扩散方式介导糖代谢的关键性物质[4]。临床上脾虚证患者出现脾失健运的表现与消化系统营养吸收功能障碍有关,同时存在肠道黏膜上GLUTs的异常,提示机体对精微物质的吸收功能依赖于GLUTs[5]。本研究以脾阴虚大鼠模型为研究对象,基于“脾主运化”理论,探讨脾阴虚大鼠空肠GLUT1和GLUT5表达的变化及滋补脾阴方药(ZBPYR)的干预作用,为进一步丰富“脾主运化”的科学内涵提供实验依据。
1 材料和方法
1.1 实验动物
SPF级雄性Wistar大鼠20只,体质量200±20 g。购自北京维通利华实验动物技术有限公司[许可证号:SCXK(京)2016-0011]。SPF级环境饲养,温度22±3℃。
1.2 主要试剂与药物
RIPA裂解液(碧云天,P0013B);SDS-PAGE蛋白上样缓冲液5×(碧云天,P00015L);蛋白Marker(Thermo,26617);Anti-Glucose Transporter GLUT1 抗体(Abcam,ab652);Anti-Glucose Transporter 5 GLUT5抗体(Abcam,ab41533);β-actin Mouse mAb(CST);羊抗小鼠IG-HRP(博士德);羊抗兔IG-HRP(博士德);ECL发光液(天能,180-5001);康为世纪RNA pure Tissue&Cell Kit试剂盒(CWO584S);诺维赞vazyme AceQ qPCR SYBR®Green Master Mix(High Rox Premixed)试剂盒。
伤阴药(吴茱萸、制附子、肉桂,混合比例为1∶1∶1),购于南京中医药大学国医堂门诊部。滋补脾阴方药(红参30 g,山药15 g,茯苓15 g等),购于大连医药集团药材公司。常规水煎,伤阴药生药浓度1 g/mL,滋补脾阴方药生药浓度3.29 g/mL,过滤后4℃保存备用。
1.3 主要仪器
精密天平(奥豪斯,美国);R-300型旋转蒸发仪(步琪,瑞士);小型垂直电泳槽(Bio-Rad,美国);NanoDrop One超微量分光光度计(Thermo,美国);凝胶成像系统(Bio-Rad,美国);高速分散均质机(KAT10 basic,德国);Real-time PCR仪(ABI 7500,美国);小型冷冻台式离心机(Thermo Micro CL 17R,美国)。
1.4 分组、模型建立及给药方法
适应性喂养3天后,双盲随机分为正常组6只,脾阴虚模型组14只。采用经典复合因素方法,以饥饱失常与过劳结合燥热耗伤阴液法建立脾阴虚动物模型,分为脾气虚和脾阴虚两个阶段[6-7]。第1-14天为脾气虚造模阶段:饱食1日+禁食2日,3日为1个循环。期间自由饮水。每日游泳至力竭,游泳桶内径25 cm,水深35 cm,水温22℃。第15-24天为脾阴虚造模阶段:第15天,将符合脾气虚标准的模型纳入脾阴虚造模阶段。实验过程中大鼠死亡1只,排除不符合脾气虚标准大鼠1只。将剩余12只大鼠纳入脾阴虚造模阶段。模型组在脾气虚证基础上,每日增加伤阴药灌胃(1 ml/100 g/只)。其余予以等体积的生理盐水灌胃。第25-38天为滋补脾阴方药给药阶段:将脾阴虚模型组分为脾阴虚组(6只)和滋补脾阴方药组(6只),滋补脾阴方药组按照1 ml/100 g/只/天胃饲ZBPYR,余组予以等体积生理盐水胃饲。
1.5 模型评价
参考《中医虚证辨证参考标准》及《中医新药临床研究指导原则》[8-9],综合拟定脾气虚证评定标准:①食少;②神疲乏力;③消瘦;④毛色枯槁无光泽,便软或溏。脾阴虚证评定标准:①体质量下降,消瘦;②易激惹,咬斗;③肛温升高;粪便干燥;④背毛枯稿无光泽;⑤饮食量时增时减;⑥饮水量增多;⑦游泳耐力下降。

表1 qPCR法检测空肠GLUT1和GLUT5 mRNA表达

表2 脾气虚造模阶段各组大鼠体质量、肛温情况(xˉ±s)
1.6 qPCR法检测空肠GLUT1和GLUT5 mRNA表达
提取各组大鼠近端空肠组织总的RNA,按照康为世纪RNA pure Tissue&Cell Kit试剂盒说明书提示进行实验操作并检测RNA纯度。逆转录的反应条件:37℃ 15 min,85°C 5 s,4℃保存。合成cDNA模板后采用SYBR Green I相对定量分析。引物由南京金斯瑞生物科技公司合成,具体引物序列详见表1。qPCR反应条件:95℃ 5 min;95℃ 10 s,60℃ 30 s 40 个循环;95℃15 s,60℃ 30 s,95℃ 15 s终止反应。
1.7 Western Blot法检测空肠GLUT1与GLUT5蛋白表达
取大鼠近端空肠组织提取总蛋白,使用超微量分光光度计测定蛋白浓度并计算蛋白上样量。将蛋白样品分别加入10%和5%的凝胶中电泳,转膜,5%脱脂牛奶于室温条件下摇床封闭2 h,按照1∶1 000加入一抗,4℃孵育过夜。第2日1×TBST充分洗膜(5 min×3),加入二抗(1∶2 000),1×TBST充分洗膜(5 min×3),ECL发光显影。
1.8 统计学方法
所有计量资料使用SPSS19.0统计软件进行数据处理,以均数±标准差(xˉ±s)表示。两组间比较行T检验统计学分析方法,多组间比较行单因素方差统计学分析方法,P<0.05代表差异具有统计学意义。
2 结果
2.1 各阶段大鼠体质量和肛温变化比较
脾气虚造模阶段(表2):与正常组比较,脾气虚组大鼠体质量和肛温明显降低(P<0.001)。脾阴虚造模阶段(见表3):与正常组比较,脾阴虚组大鼠体质 量显著降低(P<0.001);肛温较正常组显著降低(P<0.001),但较脾气虚造模阶段肛温呈上升趋势。滋补脾阴给药阶段(见表4):与正常组比较,脾阴虚组和滋补脾阴方药组大鼠体质量明显下降(P<0.001);相比于脾阴虚组,滋补脾阴方药组大鼠体质量呈增长趋势,但无统计学意义。肛温无显著性差异。
表3 脾阴虚造模阶段各组大鼠体质量、肛温情况
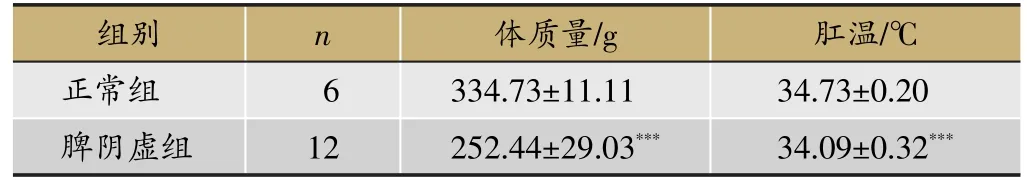
表3 脾阴虚造模阶段各组大鼠体质量、肛温情况
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001。
组别正常组脾阴虚组n 6 1 2体质量/g 334.73±11.11 252.44±29.03***肛温/℃34.73±0.20 34.09±0.32***
表4 滋补脾阴给药阶段各组大鼠体质量、肛温情况
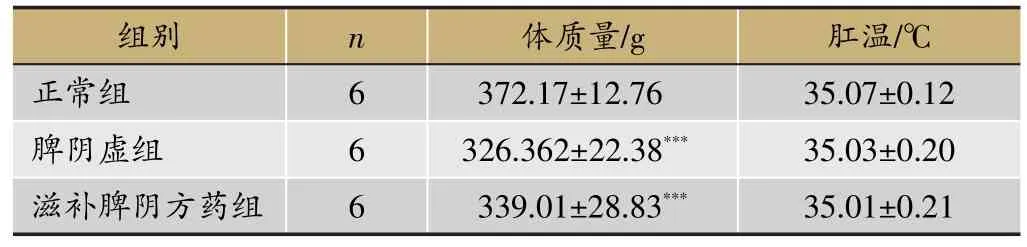
表4 滋补脾阴给药阶段各组大鼠体质量、肛温情况
注:与正常组比较,*P<0.05,**P<0.01,***P<0.001。
组别正常组脾阴虚组滋补脾阴方药组n 6 6 6体质量/g 372.17±12.76 326.362±22.38***339.01±28.83***肛温/℃35.07±0.12 35.03±0.20 35.01±0.21
表5 各组大鼠空肠组织GLUT1、GLUT5 mRNA表达比较
组别正常组脾阴虚组滋补脾阴方药组GLUT1 mRNA 1.00±0.00 0.71±0.12*1.54±0.22*##GLUT5 mRNA 1.00±0.00 0.33±0.33*1.03±0.47##
2.2 模型评价
大鼠生物学特征评估:正常组大鼠反应敏捷,活动迅速,毛发光泽,眼神灵活,大便正常;脾阴虚组大鼠体重下降,易激惹、咬斗,背毛枯槁无光泽,肛温呈升高趋势,粪便干燥,进食量时增时减,饮水量增多。综上,实验结果基本符合脾阴虚动物模型评估标准。
2.3 大鼠空肠组织GLUT1、GLUT5 mRNA含量的表达
结果表明(表5、图1),与正常组相比,脾阴虚组GLUT1、GLUT5 mRNA表达量降低(P<0.05),滋补脾阴方药组GLUT1 mRNA的表达含量增加(P<0.05);与脾阴虚组相比,滋补脾阴方药组GLUT1 mRNA和GLUT5 mRNA的表达含量均明显增加(P<0.01)。
2.4 大鼠空肠组织GLUT1、GLUT5蛋白含量的表达
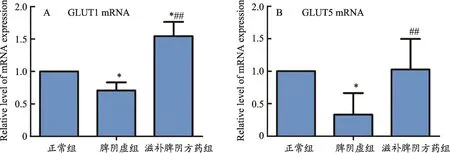
图1 大鼠空肠组织GLUT1和GLUT5mRNA表达比较
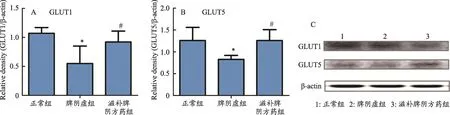
图2 大鼠空肠组织GLUT1和GLUT5蛋白表达比较
结果表明(图2),与正常组相比,脾阴虚组GLUT1、GLUT5蛋白表达均降低(P<0.05);与脾阴虚组相比,滋补脾阴方药组GLUT1、GLUT5蛋白表达均升高(P<0.05)。
3 讨论
精微物质在“脾主运化”作用下得以转输至全身,是营养物质的主要来源以及维持正常生命活动的重要保证[10-11]。脾阴是具有滋润五脏六腑、濡养全身及补益脑髓等功能的精微物质,由水谷精微所化,泛指营血、津液、脂膏等一切阴液。“脾主运化”不仅依赖于脾气、脾阳,同时也依赖于脾阴所发挥的生理作用。脾脏病变多以虚证为主,脾阴虚是脾虚证之一。《医学衷中参西录·例言》曰:“脾为太阴,乃三阴之长”,故伤阴者,脾阴首当其冲。脾阴虚证的病因病机与脏腑阴阳的偏盛偏衰及气血津液的相互转化相关,凡饮食失调、忧思劳倦、五脏虚损以及妄投医药等原因引起的阴阳气血亏虚,皆可导致脾阴的功能障碍[12]。其中,妄用大辛大热之剂可致脾阴受劫,是导致脾阴虚证的重要因素之一。正如《明医杂著》言:“所用之药,又有辛温燥热助火消阴之剂,遂致胃火益旺,脾阴愈伤”。脾阴虚证的病机实质为脾的“气阴两虚”[13]。因此,本实验基于“饮食失节,脾胃乃伤”、“劳倦伤脾”以及“劳则气耗”等中医基础理论,采用经典复合因素造模方法,在建立脾气虚动物模型的基础上,予以辛温燥热耗伤阴液之剂,成功复制了脾阴虚大鼠模型。
脾阴不足则影响机体纳运水谷以及化生精微的过程,导致营养物质吸收障碍、物质转换与能量代谢的异常[14]。糖类是为生命体提供能量的主要物质来源[15]。在GLUTs的协助下,葡萄糖以易化扩散的方式进出细胞膜,是糖代谢顺利进行并保障能量供应的重要前提[16]。GLUT1是目前研究发现在体内分布最为广泛的基础性葡萄糖转运体,不具有组织特异性。有研究表明,脾虚大鼠空肠上皮细胞GLUT1表达显著降低,艾灸通过上调GLUT1表达促进物质跨膜转运[17]。吕林等[18]通过研究脾虚型功能性消化不良大鼠发现其小肠GLUT1表达减少,这一结果提示我们可以从一个新的角度探索脾虚证的本质。此外,GLUT5也能够明显影响小肠对单糖的吸收[19]。GLUT5是果糖转运载体,主要表达位点是小肠上皮细胞膜顶端,利用底物顺浓度差转运入小肠上皮细胞[20]。正常饮食摄入的果糖主要在小肠中被处理掉[21]。摄入果糖过量会影响人体的健康状况,导致如肥胖、胰岛素抵抗及高血压等疾病的发生[22]。研究显示大鼠在饥饿条件下空肠GLUT5表达含量减少,而经高糖喂食后表达明显增加,这一研究结果说明了GLUT5对空肠的单糖吸收具有重要意义[23]。
通过观察脾阴虚大鼠模型发现:空肠GLUT1、GLUT5 mRNA和蛋白表达均显著降低,这与在脾气虚和脾阳虚大鼠模型中表达水平降低的结果相一致[24-25]。本研究立足于脾阴虚证,在脾气虚证、脾阳虚证的基础上完善了对脾虚证的研究,说明在脾虚状态下,空肠GLUT1、GLUT5 mRNA和蛋白表达含量均有不同程度下调。本实验结果提示GLUT1、GLUT5可能参与脾阴虚状态下糖代谢紊乱的病理过程。脾阴虚状态下空肠GLUT1、GLUT5基因与蛋白表达的降低,可能是小肠对单糖吸收减少,进而导致机体能量代谢发生障碍的重要机制之一,进一步丰富了脾虚证科学内涵。
中医论治脾阴虚证一直以滋养脾阴为根本大法[26]。正如张锡纯所言:“脾阴虚者,当以滋脾阴为主,脾阴足自能灌溉诸脏腑”[27]。ZBPYR是战丽彬教授结合多年临床实践经验,根据清代吴澄《不居集》中资成汤化裁而成。在本研究中,ZBPYR给药后GLUT1、GLUT 5的mRNA和蛋白表达含量较脾阴虚组均显著提高,提示ZBPYR在转录和翻译水平增加了GLUT1、GLUT5合成,通过上调其表达水平,改善脾阴虚大鼠糖代谢紊乱的异常状态。
综上,ZBPYR通过上调脾阴虚大鼠空肠GLUT1、GLUT5 mRNA和蛋白表达,可能是其发挥对脾阴虚证干预作用的机制之一。ZBPYR具有滋补脾阴,健脾益气之效,对改善葡萄糖代谢紊乱具有重要意义,为临床治疗脾阴虚证及理论研究提供了新思路。但能量代谢过程复杂,涉及多靶点多途径调控,本次研究仅从葡萄糖在体内的转运载体入手,故对脾阴虚与能量代谢的关联途径与作用机制等仍需深入探索。此外,ZBPYR对脾阴虚证干预后,是否能够调节除糖代谢之外的影响机体能量代谢的异常变化,有待进一步实验研究。

