肾嗜酸细胞瘤及后肾腺瘤的CT、MRI影像学特征分析
马丽娅 李震 沈亚琪 胡学梅 胡道予
肾脏少见良性腺瘤包括肾嗜酸细胞瘤(renal oncocytoma, RO)、后肾腺瘤(metanephric adenoma, MA)等,术前影像学检查对其与肾癌鉴别能起到重要作用。本研究回顾性分析RO和MA的CT及MRI特征,以期为临床鉴别诊断及治疗提供进一步的帮助。
对象与方法
一、临床资料
收集2011年4月至2018年5月我院行CT平扫和(或)增强以及MRI平扫、增强和(或)DWI检查的肾脏良性肿瘤患者,其中21例RO患者,男14例,女7例,年龄8~76岁,平均年龄52.9岁;7例MA患者,男4例,女3例,年龄21~53岁,平均年龄39.4岁。所有病例均经手术及病理证实。RO患者中有16例进行了CT检查(15例腹部三期增强CT、6例平扫CT)、8例进行了MRI检查(8例平扫、2例增强、4例DWI),MA患者中有4例进行了CT检查(4例腹部三期增强CT、2例平扫CT)、4例进行了MRI检查(4例平扫、3例增强、3例DWI)。
二、影像学检查方法及图像分析
1.CT检查方法:采用多排螺旋CT(GE discovery 750、Lightspeed VCT)。扫描范围自膈肌平面至腰4椎体或坐骨结节水平。增强扫描采用双筒高压注射器自肘静脉注入非离子型碘对比剂,碘普罗胺(370 mg I/ml)1.0~1.5 ml/kg(50~80 ml),流率2.0~4.0 ml/s。采用团注追踪技术,皮质期、髓质期及肾盂期扫描延迟时间分别为20~30 s、40~60 s、180~240 s。
2.MRI检查方法:采用GE Discovery MR750 3.0T、Brivo MR360 1.5T、Signa HDx 3.0T MR仪,MR专用高压注射器。体部8通道或32通道阵列线圈,取常规仰卧位。MR检查序列:平扫轴位T1WI/快速容积成像序列(LAVA序列)(TR 160~190/3.73~6.2 ms,TE 4.2/1.68~3.13 ms),轴位T2WI序列(TR 8 000~10 000 ms,TE 80~100 ms),冠位快速成像FIESTA或SSFSE序列;增强扫描为经静脉注射钆对比剂Gd-DTPA 0.1 mmol/kg并行灌注扫描,使用LAVA序列;DWI序列采用b=600、1 000 s/mm2或多b值(0~4 500 s/mm2)扫描。
3.图像分析:所有图像由2名从事腹部CT及MR诊断5年以上的医师独立阅片,分别进行病灶的定位、描述及定性诊断,并进行定量测量,如意见不一致时则协商达成一致。
结 果
一、一般资料
RO病灶21例,均为单发,其中左肾11例、右肾10例,病灶平均直径约3.7 cm,位于肾上极7例、中极8例、下极6例,有20例病灶突出于肾轮廓、1例未突出,突出病灶中有19例与肾实质呈钝角、1例呈锐角。临床表现为血尿1例(同时并发肾结石),腰腹痛4例,无临床症状体检发现16例。
MA病灶7例,均为单发,其中左肾3例、右肾4例,病灶平均直径约2.9 cm,位于肾上极3例、中极3例、下极1例,7例病灶均突出于肾轮廓,突出病灶中6例与肾实质呈钝角、1例呈锐角。临床表现为腰痛1例,体检发现6例。
二、影像学表现
1.RO病灶:CT平扫CT值约(44.0±4.8)HU,与同侧正常肾实质[(40.8±5.3)HU]密度相仿,其中3例有明显不规则低密度区。CT增强后动脉期CT值为(119.1±49.6)HU[同侧肾皮质CT值(143.7±31.5)HU],静脉期为(126.7±28.6)HU[同侧肾皮质CT值(173.6±34.0)HU],延迟期为(80.2±13.8)HU[同侧肾皮质CT值(119.6±22.9)HU]。1例病灶有钙化(图1A~C);3例病灶有囊变或坏死区(图1A~C),其中1例与CT平扫相对应;1例病灶呈辐轮状强化;7例病灶可见假包膜,假包膜呈延迟强化;6例病灶有中心星状瘢痕(图2A~C),星状瘢痕呈延迟强化;5例病灶可见节段反转强化征(图3),可呈左、右分界(图3A~C),也可呈同心圆状分界(图3D~F)。
MRI平扫T1WI以等-低信号为主,部分病灶信号稍不均匀,可见小片状更低信号。T2WI均呈混杂信号,以高信号为主,可见局部或边缘低信号(图1D~E)。增强后可见明显强化,其中1例病灶可见反转强化征,另1例病灶假包膜及分隔均呈延迟强化。DWI呈不均匀稍高-高信号,部分病灶中心呈低信号,多b值扫描时随着b值增加信号逐渐减弱、中心星状瘢痕随着b值增加信号稍增强(图2D~G)。
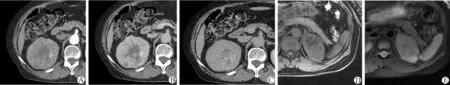
A~C:CT增强图像,可见右肾中极肿块,病灶动脉期强化不明显,静脉期可见强化,延迟期强化减弱,中心可见囊变坏死区及钙化灶;D~E:MRI平扫轴位,病灶呈不均匀等T1信号稍长T2信号
图1 RO病灶
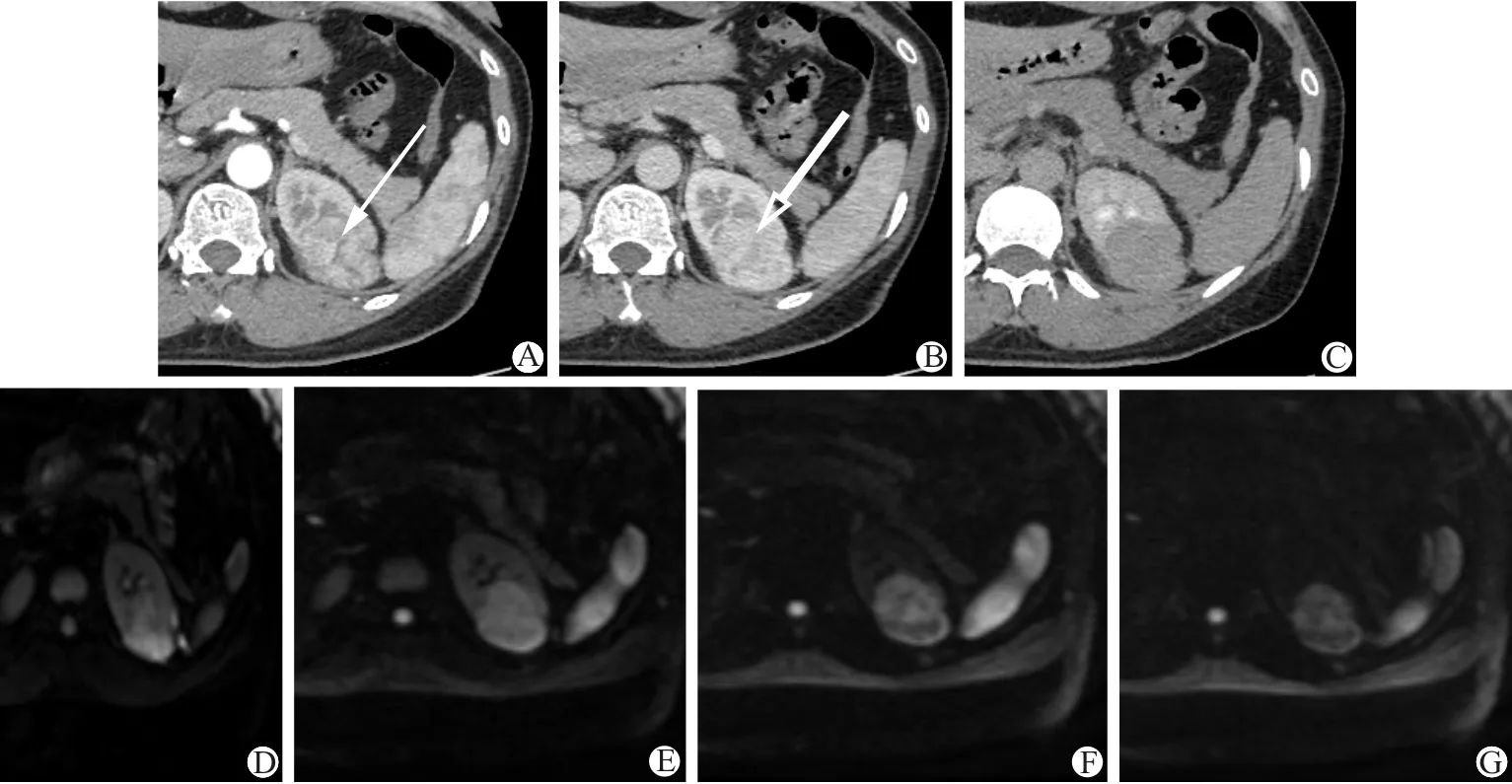
A~C:CT增强图像,可见左肾中极病灶,中心星状瘢痕动脉期强化不明显(白箭),静脉期稍强化(白箭),延迟期中心星状瘢痕与余病灶实质强化相仿;D~G:DWI图像,b值分别为50、600、1 500、4 500 s/mm2,可见病灶呈稍高信号,病灶部分实质随着b值增加信号减弱、病灶边缘及中心星状瘢痕随着b值增加信号稍增强
图2 RO病灶中心星状瘢痕

A~C:CT增强图像,左肾上极病灶可见节段反转强化征,动脉期(A)示病灶局部呈明显强化(短箭)、余呈低强化(长箭),静脉期(B)示部分病灶强化程度减低(短箭)、余强化程度相对增加(长箭),延迟期(C)示病灶上述区域强化均减弱(长箭);D~F:CT增强图像,动脉期(D)示病灶外周呈明显强化(长箭),内缘呈低强化(短箭),静脉期(E)示外周强化程度减低(长箭)、内缘强化程度相对增加(短箭),延迟期(F)外周强化进一步减低(长箭)并较周围肾实质密度减低、内缘仍为相对强化区(短箭)
图3 RO病灶的节段反转强化征
2.MA病灶:CT平扫CT值约(36.1±13.4)HU,与同侧正常肾实质[(37.1±13.0)HU]密度相仿,其中1例有明显不规则低密度区。增强后动脉期CT值为(46.5±12.1)HU[同侧肾皮质CT值(186.9±66.4)HU],静脉期为(126.7±28.6)HU[同侧肾皮质CT值(180.7±44.0)HU],延迟期为(80.2±13.8)HU[同侧肾皮质CT值(129.8±13.8)HU]。1例病灶有钙化,1例病灶有囊变坏死区且与CT平扫病灶相对应(图4)。
MRI平扫以稍低-等信号为主,T2WI呈混杂信号,以等-高信号为主,局部可见低信号。增强后可见逐渐强化,延迟强化较明显,分隔不规则且强化明显。DWI呈稍高-高信号,且随着b值增加信号增强(图5)。
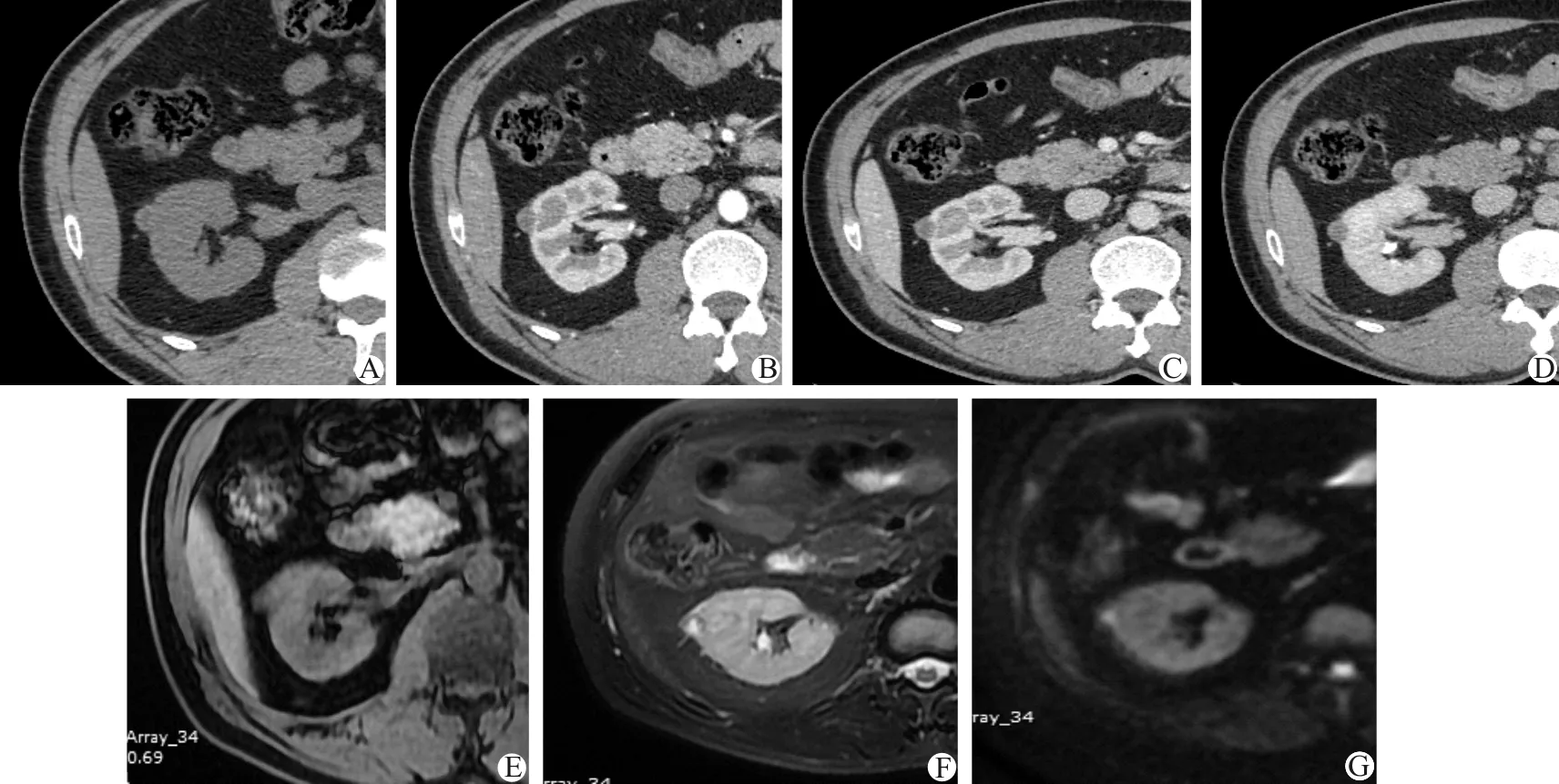
A:CT平扫,示局部小软组织结节突出于肾轮廓,密度稍不均匀;B~D:CT增强图像,病灶边缘呈弱强化,中心低密度区未见明显强化;E~G:MRI平扫+DWI轴位,病灶呈稍长T1信号,T2WI示病灶边缘呈低信号、中心呈高信号,DWI示b=600 s/mm2时病灶呈稍高信号
图4 MA病灶
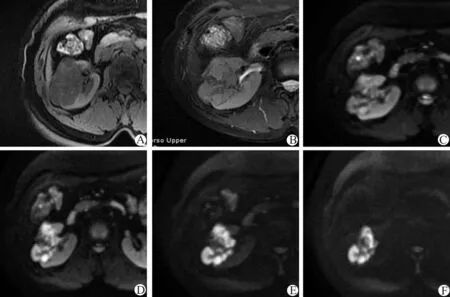
A、B:MRI平扫轴位,右肾中极病灶,呈混杂长T1混杂等T2信号,并可见稍短T1稍长T2信号分隔;C~F:DWI示病灶呈混杂稍高信号,b值分别为50、600、1 500、4 500 s/mm2,随着b值增加部分实质信号增强
图5 MA病灶
讨 论
2013年有文献回顾性总结提示,经手术证实的肾肿瘤约14%~15%为良性[1],但目前术前影像学检查无法完全鉴别肾脏良性与恶性肿瘤[2]。因此本文归纳分析RO和MA两种少见肾脏良性腺瘤的术前影像学表现,有助于临床治疗方案的选择及优化。
一、RO
RO发生率约占肾肿瘤的2%~11%[3],好发于中老年,男性较女性多见,通常无临床症状,多为偶然检查发现,少数患者临床表现可为腰部不适或血尿等[4]。本组病例中平均年龄为52.9岁,男女比例为2∶1,大多数患者为体检发现(16/21),少数患者有腰腹不适(4/21)及血尿(1/21)症状,与文献相符。
RO多起源于肾皮质,突出于肾轮廓,单侧多见[5]。肿瘤常边界清晰,CT平扫示肿瘤呈等或低密度,钙化、出血及坏死相对少见。增强后最常见的强化方式为皮质期及髓质期不均匀强化,排泄期强化均匀且密度低于周围肾皮质[6]。本组病灶基本突出于肾轮廓(20/21),大多数与肾实质夹角为钝角。CT平扫示病灶与周围肾实质相仿,增强后均为不均匀强化,三期强化程度较周围肾皮质强化程度低。部分病灶可见中心星状瘢痕征(6/21)及节段强化反转征(5/21)。有文献报道,中心星状瘢痕是RO的特征之一,可能由肿瘤生长缓慢并长期出血所致[7]。Kim等[8]研究提示,如出现节段反转强化征,则为RO的特异性征象。另一篇系统评价提示节段强化反转征是RO较为特异的影像学征象,但不同文献提示的敏感性差别很大[9]。本组病例中MRI示病灶一般信号不均匀,病灶局部呈延迟强化,分隔及假包膜亦可见延迟强化,而其中1例DWI示中心星状瘢痕随着b值增加信号稍增强。
病理学特征:光镜下肿瘤细胞呈腺管状或巢状排列,胞质富含嗜酸性颗粒,细胞核大小一致,界限不清,核分裂象罕见,免疫组化表现为CK8(+)、EMA(+)、Vim(-)、Hale胶体铁染色(-)[10]。
二、MA
MA由Brisigotti等[11]于1992年首次命名,2016年WHO关于肾肿瘤分类中将其归入后肾肿瘤中的良性肿瘤[12]。该肿瘤为起源于后肾组织的良性肿瘤,占肾脏肿瘤的0.2%[13]。MA多无临床症状,常因体检或偶然发现就诊,少部分患者可出现腰背部不适、腹部包块,肉眼或镜下血尿等。本病可发生于任何年龄,最常见于50~60岁,以中年女性多见,男女发病比例约1∶2.5[14]。本组患者平均年龄39.4岁,男女比例为1.3∶1,仅1例有腰部不适症状,余6例均为体检发现,与文献报道稍有差异,可能与样本量较小相关。
MA增强后多为轻-中度渐进性强化,可呈均匀或不均匀强化,且有延迟强化的特点,而据文献报道,后者是MA较为特异性的征象[15-16]。本组病例均突出于肾轮廓,大多数与肾实质夹角为钝角。CT平扫示病灶与周围肾实质相仿,CT增强后强化程度较周围肾实质低,呈轻-中度强化。MR增强多期扫描,可见病灶延迟强化明显,部分病灶分隔呈延迟强化,与文献报道相符合。DWI示病灶呈不均匀高信号,且随着b值增加信号增强,与肾脏恶性肿瘤难以鉴别。
病理学特征:光镜下肿瘤细胞排列呈管状或腺泡状,细胞较小且形态一致,细胞核小,核仁不明显,核分裂象罕见,免疫组化染色CK和Vim常呈阳性,CD57常呈弥漫阳性[17]。
三、鉴别诊断
1.肾细胞癌:肾癌高发年龄多在50~70岁之间,典型表现为增强后皮质期明显强化,实质期强化较周围肾实质减低,呈“快进快出”表现。可有假包膜,在皮质期强化不明显、实质期呈相对低密度[18]。也有部分肾细胞癌呈中等强化或延迟强化[19]。DWI呈不均匀高信号,随着b值增加信号增强。RO及MA病灶均呈渐进性强化,部分病灶可见延迟强化,RO病灶的中心星状瘢痕及节段反转强化征为较特异性表现,可从一定程度上区分。但MA病灶DWI随着b值增加信号增强,与肾细胞癌鉴别有一定困难。
2.血管平滑肌脂肪瘤(renal angiomyolipoma, RAML):是最常见的良性肾肿瘤。典型的RAML影像学表现为单侧/双侧肾脏增大或局部突出,并见不均匀肿块影,其中低密度脂肪影为其特征性影像学表现[20]。当脂肪成分比例<20%时,影像学则不易显示,称为乏脂肪RAML。主要有两种强化形式:①富血供RAML:增强后皮质期病灶明显强化,强化程度与正常肾皮质相仿,实质期病灶强化程度低于周围正常肾实质,表现为“快进快出”;②乏血供RAML:增强后皮质期肿瘤呈轻度强化,可形成小网格状强化,实质期仍表现为高密度[21]。乏脂肪RAML与RO、MA鉴别有一定困难,RO病灶可通过特征性的中心星状瘢痕及节段反转强化征来进行鉴别。
四、治疗及预后
因术前影像学难以完全与肾脏恶性肿瘤相鉴别,RO、MA病灶基本予以手术治疗,以肾部分切除术为主,临床预后良好[22]。若能术前确诊,则可予以肿瘤剜除或肾部分切除术,尽量保留余肾功能。
综上所述,RO病灶的中心星状瘢痕、节段反转强化征有一定特异性,DWI示随着b值增加信号有所减弱、中心星状瘢痕信号可稍增强;而MA病灶呈轻-中度强化、可呈延迟强化,但DWI示随着b值增加信号增强,与其他肾良恶性肿瘤鉴别有一定困难。

