前列腺导管腺癌临床特点和诊治方法分析及文献复习(附7例报告)
彭超 张俊 徐晓健 王亮良 袁和兴 黄玉华 侯建全
前列腺导管腺癌(prostatic ductal adenocarcinoma, PDA)是除前列腺腺泡癌(prostatic acinar adenocarcinoma, PAA)之外最常见的前列腺癌的一种组织亚型,较为罕见,常与PAA混合存在,单纯PDA的发病率只占前列腺癌的0.4%~1%,且主要为老年患者[1-2]。1967年,Melicow 等[3]首次报道了这类罕见病例,由于PDA组织学形态为假复层柱状上皮排列的乳头、筛状和管状结构,与子宫内膜癌的组织学相似,因此最初被称为“子宫内膜癌”,使人们误以为其来自于前列腺精阜的男性苗勒管残余。后来随着前列腺穿刺活检及前列腺癌根治术的广泛开展,发现这种形态的癌也常出现于前列腺的外周带,结合免疫标记技术,证实PDA也来自前列腺上皮,只是以向导管方向分化为主[4]。PDA被一致认为恶性程度较高,最近的一份关于前列腺癌Gleason评分系统的报告中,Epstein[5]认为这种前列腺癌的组织类型分级应为Gleason 4,因为PDA的生物学行为与Gleason评分4+4=8的PAA相似。另一方面由于PDA早期缺乏经典前列腺癌的临床表现,确诊时多为晚期,也给该病的诊疗带来不少的困难。本文分析探讨了PDA的临床特点、诊断及治疗方法,旨在提高临床及病理医生对PDA的认识。现报告如下。
对象与方法
一、一般资料
回顾分析我院2008年3月至2017年11月经病理确诊的7例PDA患者的临床资料,患者年龄48~84岁,平均 71岁。入院时以不同程度的排尿困难为主要表现5例,其中1例伴有明显肉眼血尿;2例体检发现PSA升高。入院后检查,6例PSA高于正常值(4.0 ng/ml),且均>20.0 ng/ml,1例在正常范围内。所有患者均行术前直肠指检,6例患者前列腺Ⅱ度肿大,中央沟消失,质硬;1例Ⅲ度肿大,表面凹凸不平,界限不清,右侧叶可触及结节,压痛明显。6例患者行盆腔MR检查,其中3例见肿瘤突破包膜侵犯精囊,膀胱以及盆腔淋巴结转移;2例明确见周围髂骨转移;1例行B超检查提示前列腺增生。5例患者术前行前列腺穿刺活检,Gleason评分均≥7分。所有病例术后标本均经中性福尔马林固定,石蜡包埋,HE染色,其中5例行免疫组化标记,主要包括CK5/6、P63、P504S、高分子量角蛋白CK34βE12(基底细胞)、PSA、PAP和Ki-67。
二、治疗方法
7例患者中有6例术前病理确诊为前列腺癌,5例行MRI-TRUS融合穿刺活检确诊,1例行TURP确诊,所有穿刺结果均提示为前列腺癌,仅1例穿刺结果报告见PDA成分。有4例患者行根治性前列腺切除术,术后均行康士得+诺雷得内分泌治疗,其中1例曾行术前内分泌治疗加放疗;3例患者行TURP,术后均行内分泌治疗。
结 果
所有患者术后病理检查均确诊为PDA,Gleason评分7~10分,4例行根治性前列腺切除术患者术后病理分期分别为pT3aN0M0、pT4bN1M0和pT4aN0M0、pT3aN0M0,2例行TURP患者临床分期均为cT4N1M1,1例患者由于术前诊断为前列腺增生仅行B超检查无法分期。7例PDA患者中5例合并有PAA,5例患者行免疫组化检查,结果显示基底细胞标志物P63、CK34βE12及CK5/6均为阴性,P504S为阳性,Ki-67分别为30%、50%、60%、60%和60%。7例患者随访4~36个月,其中行姑息性TURP的3例患者中2例短期内出现多发骨转移及肝脏转移,分别于术后4个月和5个月死亡,1例患者术后7个月出现生化复发,其余行根治性前列腺切除的4例患者术后恢复良好,至今无肿瘤复发及转移征象,血清PSA均维持在极低水平。见表1、图1。

表1 患者一般资料、治疗及预后
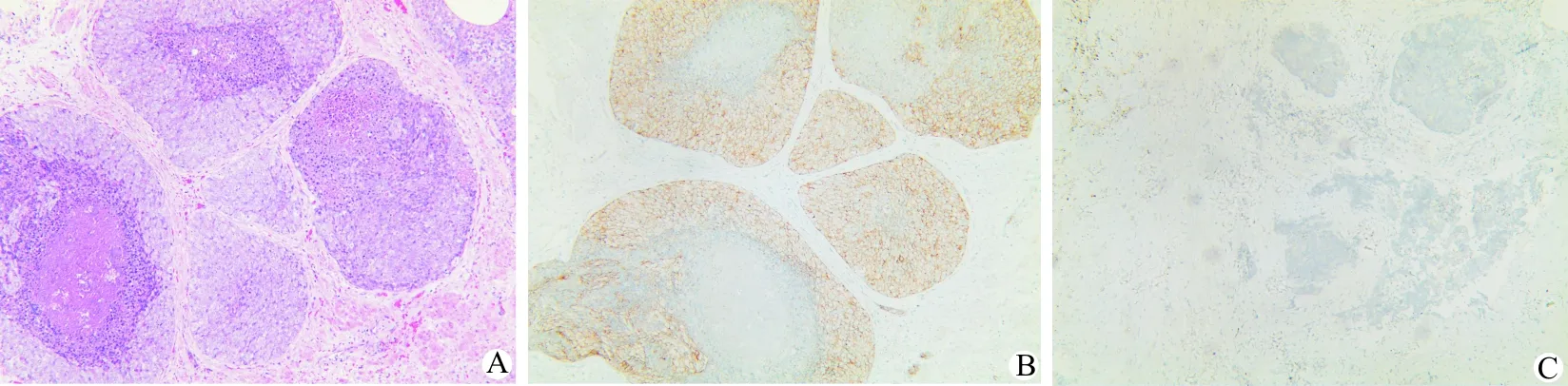
A:镜下观:肿瘤细胞呈实体性腺样排列,中间见粉刺样坏死灶(HE染色,×100);B:P504S呈阳性表达(×100);C:基底细胞标志物P63呈阴性表达,与周边正常腺体P63阳性形成对比(×100)
图1 病理检查
讨 论
PDA虽已被证实与PAA均来自于前列腺腺体本身,但二者的组织学结构有着本质的区别,在临床表现、免疫组化以及预后等方面亦有不同。临床上PDA常常累及中央腺管并表现为前列腺尿道部乳头样病灶,可伴有不同程度的组织坏死,因此PDA经常在TURP或者前列腺全切时发现,而由于前列腺穿刺活检主要穿刺点位于外周带,因而很少能在活检标本中发现PDA的成分[6]。本组7例患者有5例伴有不同程度的下尿路梗阻症状或者血尿,分析与肿瘤生长位置有关。3例行TURP的患者术中均有见前列腺内部组织明显坏死改变,后尿道黏膜组织变形,堵塞管腔。行前列腺穿刺活检的5例病理报告中仅有1例见PDA成分。PDA患者血清PSA变化范围较大,可能与该肿瘤腔内生长方式有关,早期肿瘤未侵犯腺泡及周围组织时,PSA可表现为低水平。有文献报道PDA患者的PSA水平与经典PAA患者相比较低,在一项包含371例PDA患者及 442 881 例PAA患者的大数据对比分析中,Morgon等[7]对血清PSA在PDA患者中的表达情况进行了多因素分析评估,发现PDA患者血清PSA平均水平较PAA患者低30%,且PSA<4 ng/ml 的概率是PAA患者的2.4倍。亦有一系列小型研究证实该证据,一项研究发现46例转移性PDA患者中术前PSA低于2 ng/ml的患者有9例,占所有患者的20%,而晚期转移性PAA患者血清PSA几乎都非常高,与之形成鲜明对比[8]。研究结果提示,与PAA相比,PDA可能更不容易被PSA筛查所发现,对于此类PSA在正常范围内的患者,临床医生应更详细询问病史,常规行直肠指检,对任何可疑患者均应行盆腔MR检查,尽量减少误诊的可能性。在本组病例中,6例患者术前血清PSA均>20.0 ng/ml,分析原因可能是与肿瘤处于相对晚期有关,且多数合并有较多的PAA成分。值得注意的是1例误诊为前列腺增生的患者术前血清PSA<4.0 ng/ml,入院仅行B超检查提示良性前列腺增生而未行MRI或者CT排除前列腺癌的可能,TURP术后行病理检查才明确为PDA。
PDA的诊断主要依据组织病理学检查,PDA最大的细胞组织学特征是肿瘤细胞呈高柱状上皮,细胞核单层或假复层排列,异型性明显,常位于瘤细胞的基底部,而经典的PAA肿瘤上皮呈立方形。根据生长方式通常将PDA分为2型,A型表现为乳头状生长,大多以息肉样或菜花样突入前列腺尿道,亦可侵犯尿道周围前列腺大导管;B型呈弥漫性的大腺泡结构,以筛状或乳头状结构为主,常位于前列腺深部。超过一半的病例2种生长方式同时出现,且相互移行,周围均伴有不同程度的间质纤维化[9]。随着肿瘤的进展有一部分PDA的病理形态会变为实性,中间可见粉刺样坏死,预后更差[10]。PAA主要表达前列腺组织的免疫组织化学标志物,包括PSA、PAP、α-甲基酰辅酶A(CoA)-还原酶(AMACR)、雄激素受体和CK7,而基底细胞标志物如P63、CK34βE12和CK5/6通常是阴性的。PDA的免疫表型与PAA相似,但PDA的部分区域可表现为基底细胞阳性,可能与PDA常常沿着正常导管或腺泡浸润,取代正常腺上皮保留基底层有关[11]。近些年一些机构开始运用P504S联合P63、CK34βE12的检测来提高前列腺癌诊断的正确率。最初,Xu等[12]于2000年应用cDNA文库减影法和微检测筛查法从前列腺癌组织中分离出一种蛋白,即P504S。P504S基因所编码的蛋白由381个氨基酸组成,在支链脂肪酸的β氧化和脂肪酸衍化过程中起重要作用。Jiang等[13]于2001年发现P504S在前列腺腺癌组织中呈阳性表达,在前列腺良性病变组织中呈阴性表达,提出可将其作为前列腺癌的肿瘤标志物,以提高前列腺癌的诊断正确率。但P504S不能作为诊断前列腺癌的特异性指标,因为P504S在前列腺高级别上皮内瘤变和前列腺非典型腺瘤样增生中亦有一定程度阳性率,且有文献报道P504S也可在结直肠癌、卵巢癌、乳腺癌、膀胱癌、肺癌、肾腺癌、淋巴瘤和黑色素瘤中表达[14]。需要注意的是免疫组织化学标志物并不能区分PDA与PAA,有文献报道Ki-67、P53在PDA中有更高的表达率[15-16],而这仅只能辅助二者的鉴别诊断,可能标志着更差的预后,但仍需进一步的研究来证实,二者最主要的鉴别方法仍然是组织细胞学的差异。本组5例患者术后免疫组化结果显示基底细胞标志物P63、CK34βE12及CK5/6均为阴性,未见部分阳性表达,P504S均为阳性,Ki-67有4例>50%,显示出较高的细胞增殖活性。
除了前列腺典型腺癌以外,PDA常常需要与以下疾病相鉴别,包括前列腺高级别上皮内瘤变、前列腺导管内癌(intraducal prostate cancer, IDC-P)、膀胱腺癌及转移性腺癌等。前列腺高级别上皮内瘤变属于前列腺癌前病变,无真正的乳头状结构形成,其形态特点是前列腺导管和腺泡的分泌细胞增生,腺体大小正常,核仁呈明显增大,而PDA的腺体较大,形成复杂的筛状或乳头状结构。另一个重要的特点是前列腺高级别上皮内瘤变基底层细胞基本完整或至少有不连续的基底层细胞,因此基底细胞标志物染色常明显,而PDA一般缺乏基底细胞。IDC-P是指浸润性癌在前列腺正常腺体结构内的扩散从而导致恶性肿瘤细胞在导管和腺泡内的腔内增殖,并至少局灶保存有基底细胞,上皮细胞呈立方形,核异型性明显,肿瘤细胞核的大小至少超过邻近的良性腺体细胞核的6倍且常常伴有局灶性的粉刺样坏死;而PDA以高柱状复层排列上皮为特征,肿瘤细胞核明显小于IDC-P,与其他高级别前列腺癌一样,PDA也容易出现导管内扩散,因此在导管腺癌周围亦可发现残存的基底细胞。从概念上讲PDA伴有基底细胞就是IDC-P,有学者提出将PDA分类到IDC-P的范畴内,但是基于IDC-P特征性的形态学表现以及并不是所有的PDA周围都存在基底细胞,因此PDA与IDC-P并不是同一个概念。对于来源于前列腺外的如直肠腺癌、尿路上皮癌的浸润,PSA、PAP、基底细胞标志物P63、CK34βE12及P504S标记阳性可用于鉴别。
已有多项研究证实,与PAA相比,PDA往往具有更高的Gleason评分以及更晚的分期,因而恶性度更高,预后更差。Morgan等[7]发现PDA更容易突破前列腺侵犯包膜外组织,而且在没有远处转移的患者中,PDA患者的疾病特异性死亡率较PAA患者高,是后者的2.4倍。Samaratunga等[17]通过对268例前列腺根治术后患者的病理标本进行回顾性研究发现,34例PDA患者中>70%术后病理分期进入pT3,而PAA通常只有30%。在最近的一项研究中,Kim等[18]对比分析了29例PDA患者和116例PAA患者的术后病理特点及预后,发现PDA组术后病理Gleason评分≥8分的患者19例(65.5%),PAA组54例(46.5%),二者具有显著差异,另外在预后方面发现前组的生化复发率明显较后组高(34.4% vs 16.6%)。本组7例患者中,确诊时明确有远处转移的患者2例, 4例行根治性前列腺切除术的患者术后病理也都超过pT3期,分别为pT3aN0M0、pT4bN1M0和pT4aN0M0、pT3aN0M0,而且所有患者的Gleason评分均≥7分,最高者10分。故通过前列腺穿刺或者TURP确诊为PDA的患者,无论其血清PSA值的高低,我们都有充分的理由怀疑其为高危前列腺癌患者,应立即行腹盆腔MR、ECT全身骨扫描和胸部CT等检查明确肿瘤与周围组织的关系以及有无远处转移,从而制定个性化的治疗方案。
PDA常与PAA共同存在,但是PDA成分所占的比例对疾病预后的影响目前尚没有明确的共识。Samaratunga等[17]对34例PDA前列腺根治性切除标本中的PDA成分进行了定量分组研究,结果显示PDA更容易出现包膜外侵犯,但是与PDA所占的比例无关。而另一项研究[19]以PDA患者伴有的PAA成分Gleason评分=7分和≥8分进行分组,发现当Gleason评分为7分时,PDA成分≥10% 的患者更容易出现包膜外扩散,当PDA成分<10% 时则不存在这些差异;而当Gleason评分8~10分时,无论PDA成分多少,两组在术后病理分期、淋巴结转移率以及术后切缘阳性率等方面均没有显著差异。Jang 等[20]最近研究发现,PDA成分比例越高不仅代表着更高的疾病分期,也预示着更差的预后。关于PDA成分对患者预后的影响研究较少,国内更是罕有报道,仍需要进一步的大数据分析研究,但是基于PDA的高侵袭性生物学特点,我们建议在前列腺穿刺活检以及根治性切除标本中,只要发现PDA成分无论其比例多少都需要在报告中体现。
PDA是一种罕见的前列腺癌的亚型,发病率较低,早期临床表现不典型因而难以确诊,特别是对于血清PSA低于正常值的患者,常误诊为前列腺增生。诊断主要依靠术后病理组织细胞学形态以及免疫组化染色,PDA常具有更高的Gleason评分以及更晚的肿瘤分期,且容易远处转移,因而恶性度更高,预后更差。我们建议对于怀疑此类前列腺癌的患者应仔细询问病情,行经直肠或会阴前列腺穿刺活检。早期确诊后应积极行根治性前列腺切除术,术后坚持行内分泌治疗,采用综合治疗方案延长患者的生存期。

