肾脏黏液样小管状和梭形细胞癌的临床、影像及病理学特征(附4例报告)
刘海浪 王桎仙 王少刚 杜广辉 陈忠 宋晓东 杨为民
肾脏黏液样小管状和梭形细胞癌(mucinous tubular and spindle cell carcinoma of the kidney,MTSCC)是相对少见的肾脏肿瘤,2004年WHO在对成人肾脏肿瘤分型的描述中首次将其列出,并定义为恶性的实体肿瘤[1]。其在肾脏所有类型的肿瘤中占比<1%,女性患者多于男性[2]。由于相对罕见,关于MTSCC的临床生物学行为、影像学特点及病理学特征报道较少。本文通过回顾性分析我院2009年10月至2017年6月收治的4例MTSCC患者的临床资料,结合相关文献报道,分析总结了MTSCC的临床、影像及病理学特点。现报告如下。
对象与方法
一、一般资料
本组4例患者均为初发病例,男、女患者各2例。肿瘤位于左侧1例,位于右侧3例;肿瘤位于肾脏上极3例,位于肾脏中上部1例;肿瘤最大径分别为2.0、2.4、3.0及8.0 cm。发病年龄分别为57、62、56及31岁,体重指数(BMI)分别为24.44、21.88、22.04及22.49 kg/m2。所有患者均未表现出明显症状而为例行体检发现。患者一般资料见表1。
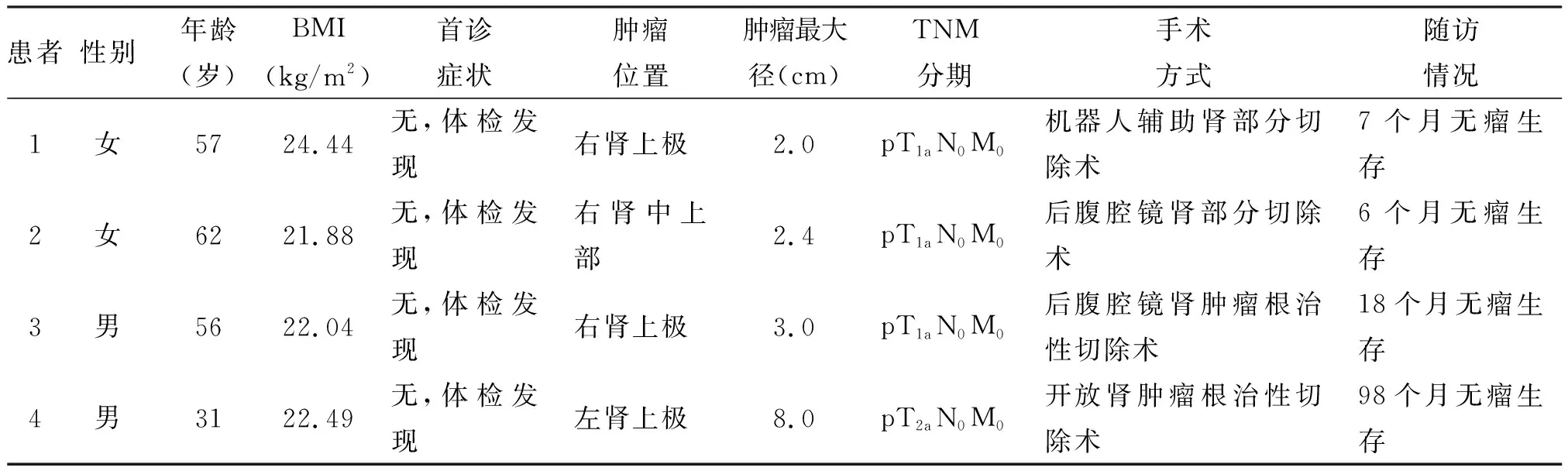
表1 患者一般资料
二、检查及治疗方法
所有患者术前均行泌尿系超声检查;3例行双肾CT平扫,其中1例同时行双肾增强CT检查;2例患者行MRI平扫+DWI检查。4例患者均行手术治疗,其中1例患者行机器人辅助腹腔镜肾部分切除术(肿瘤最大径2.0 cm),1例行后腹腔镜下肾部分切除术(肿瘤最大径2.4 cm),1例行后腹腔镜肾肿瘤根治性切除术(肿瘤最大径3.0 cm),1例行开放肾肿瘤根治性切除术(肿瘤最大径8.0 cm)。手术切除肿瘤组织常规行病理检查,其中有3例行免疫组化检查。
结 果
超声检查肿瘤表现为低回声,边界清,内部回声不均,有2例患者肿瘤CDFI(彩色多普勒)上表现为低回声周边见环状血流信号,3例诊断为肾脏实质性占位,1例诊断为肾脏肿瘤。CT平扫肿瘤表现为圆形或类圆形软组织影,与周围组织分界清;增强扫描肿瘤内呈不均匀、渐进性强化,与各期肾实质相比,强化没有肾实质明显,4例全部诊断为肾脏肿瘤。2例患者行MRI平扫+DWI检查,T2加权像上肿瘤呈不均匀的等信号或稍高信号,T1加权像上肿瘤呈等信号或稍低信号,双化学移位序列中(In phase 及Out of phase)肿瘤内未见脂肪信号,肿瘤于DWI序列上呈明显高信号,2例均诊断为肾脏肿瘤性病变。
手术均顺利完成。随访截止2017年12月,无病例死亡。术后大体标本见肿瘤呈白色或灰黄色;镜下见立方上皮构成小管呈线性排列,胞质嗜酸性,可见明显黏液基质,黏液基质中可见大量梭形细胞;免疫组化检查示细胞角蛋白(CK7)、上皮膜抗原(EMA)、PAX-8、P504S及波形蛋白(Vimentin)阳性者3例,HMW在2例患者中分别呈散在阳性及灶状阳性表达,PAX-2在2例患者中分别呈弱阳性及阳性表达,Melan A、CAIX、HMB45、CD10、CD15、CD117、TFE-3、villin在2例患者中均呈阴性表达。患者免疫组化检查结果见表2。

表2 患者免疫组化结果
讨 论
MTSCC属十分罕见的肾脏肿瘤亚型,在2009年10月至2017年6月我院收治的所有肾脏肿瘤患者中仅见4例,目前尚未有关于MTSCC的详尽流行病学资料。既往认为其是一种低级别的集合管癌,2004年WHO首次将其单独列出,认为其是独立的实体肿瘤。MTSCC在所有类型肾脏肿瘤中的占比<1%,通常男性患者少于女性,比例约为1∶2~1∶4,发病年龄17~82岁,中位年龄60岁[2]。与大多数肾脏肿瘤类似,MTSCC患者通常无临床症状,仅有部分患者出现肉眼血尿、发热等,或当瘤体巨大时表现为患侧腰腹部胀痛,极少数患者出现副肿瘤综合征[3]。因无特异性临床症状,多数患者为例行体检时偶然发现肿瘤。MTSCC一般预后较好,2004版WHO肾脏肿瘤分类中起初将其定义为惰性肿瘤,认为其极少出现远处转移,但随着MTSCC患者出现远处转移的报道逐渐增多,2016版中将关于MTSCC肿瘤生物学行为的描述术语“惰性肿瘤”去除,意即随着人们对MTSCC认识的加深,关于MTSCC是否为惰性肿瘤还难以下定论,尚需更多病例更长时间的随访报道[4]。本组4例患者均为体检发现,截止最后随访时间2017年12月,无病例死亡,未出现局部复发及远处转移病例。本组患者的临床特征及预后与既往文献报道基本相符。
由于其独特的组织学特征,MTSCC的CT及MRI等影像学表现也各有其特点。CT平扫中,肾实质的衰减值变化范围为30~40 HU,肾脏肿块的衰减值通常高于邻近的肾实质,为40~90 HU[5]。此变化特点意味着肾脏肿块一般于CT平扫上即可被定位到,但要判断其良恶性及鉴别肿瘤亚型仍较为困难,需结合CT增强扫描进行。MTSCC瘤体常单独出现,突出、部分突出或位于肾实质内,呈圆形或卵圆形,与周围肾实质分界清,CT平扫上能很好地观察到分界线,常呈均质性改变,由于肿瘤乏血供,因此常见于肾透明细胞癌及肾乳头状细胞癌等肿瘤亚型中的坏死、出血、囊性变及钙化等改变较少于CT上观察到[6]。Cornelis等[7]对17例MTSCC患者进行CT扫描发现,增强扫描时,瘤体常呈不均匀、渐进性强化,与肾皮质相比,肿瘤在所有时相有着更低的平均衰减,且倾向于在增强检查的最后阶段达到稳定的最大增强效果。MTSCC在所有时相都没有肾脏皮质及髓质强化明显,与瘤体的乏血供不无关系。典型患者CT图像见图1。
MTSCC的MRI检查显示,T2加权像上,多数肿瘤呈现出不均匀的中到高信号,T1加权像上,与肾皮质相比,肿瘤呈等信号或稍低信号;T2加权成像上呈现高信号这种现象能为肿瘤的自身组织成分所解释,因为肿瘤间质含有大量黏液基质;相比之下,在T2像上呈现低信号的区域,可能与瘤体中含有较少黏液基质有关[7]。因MTSCC瘤体几乎不含脂肪成分,在肿瘤的同反相位序列中(In phase及Out phase)较少能检测到脂肪信号。MTSCC于DWI一般呈高信号[8]。在行MRI灌注扫描时,T1加权像上,早期强化不明显,静脉期逐渐增强,延迟期强化达到顶峰[9]。对比来看,肿瘤的MRI强化特点与CT强化特点极其相似,均为不均匀、缓慢渐进性强化,而这一强化特点恰好常见于低级别恶性肿瘤及部分良性肿瘤。因此如果术前影像学检查怀疑MTSCC,且常规病理检查难以确定肿瘤性质时,病理医师将会做更多工作来证实这一怀疑,尤其是寻找黏液基质以及排除肾细胞癌的高级别诊断。MTSCC在CT及MRI缓慢强化的特点也可见于乳头状肾细胞癌,在定性诊断时尤其要注意与其进行鉴别。乳头状肾细胞癌于CT上表现为相对均质,T2加权像上表现为低信号,其在T2加权像上的表现是与富含黏液基质的MTSCC最主要的鉴别点,再结合CT上出血、囊性变及钙化(乳头状肾细胞癌常见)等特点,可通过影像学区别两者[7]。典型患者MRI图像见图1。
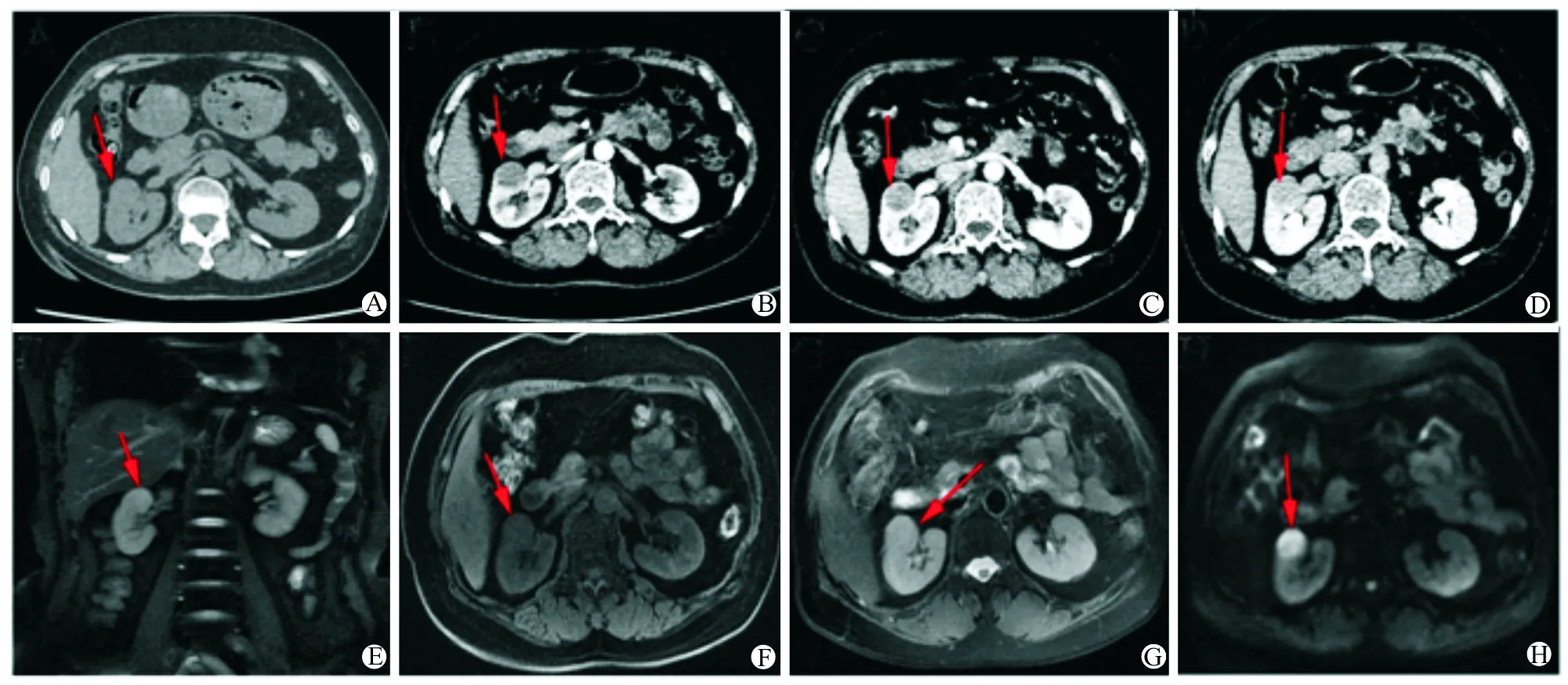
A:肿瘤CT平扫见肿瘤位于右侧肾脏中上部,圆形,与周围组织分界较为清晰;B~D:增强扫描时皮质髓质期、肾实质期及排泄期图像,可见肿瘤呈缓慢不均匀强化,肿瘤于排泄期达最大强化程度,各期肿瘤强化程度均低于正常肾实质;E:肿瘤冠状位MRI图像,见肿瘤位于右肾中上部;F:肿瘤MRI T1加权像,肿瘤呈稍低信号;G:肿瘤MRI T2加权像,肿瘤呈稍高信号;H: DWI序列图像,肿瘤呈明显高信号
图1 典型患者的CT及MRI图像(红色箭头所示之处为肿瘤)
组织学上,最初学者们认为MTSCC起源于肾单位的远端小管,但随后发现其与肾脏乳头状细胞癌在形态学及免疫组化特征上有诸多相似之处,其起源仍有待于进一步阐明,但目前较为一致的意见认为其来源于肾集合管或髓袢[10]。MTSCC通常位于肾皮质中,可呈白色、灰色、黄色及粉红色等;镜下可见许多狭长的索状排列的小管状结构,这些小管由立方形的肿瘤细胞构成,细胞胞质嗜酸性或呈透明状,核呈大小均一的圆形或卵圆形,异型性小,间质呈黏液样改变,有时通过Alcian blue染色法可见到大的黏液池,也常可见到小管状结构移行为梭形细胞[11]。免疫组化检查显示,构成小管的立方细胞及梭形细胞通常阳性表达PAX-2、PAX-8、低分子量细胞角蛋白(CK8、CK18、CK19及CK7)、EMA、甲基辅酶A消旋酶(AMACR)及Ecadherin(E-钙黏素);Vimentin及高分子量角蛋白(34E12)常呈差异性表达;肾细胞癌标志物CD10及CD15常为阴性,偶呈阳性表达;碳酸酐酶Ⅸ、UEA-1、P63、CK20、GATA3及平滑肌肌动蛋白SMA常呈阴性表达[12]。MTSCC肿瘤细胞分子遗传学层面,应用比较基因组杂交(CGH)及细胞原位杂交(FISH)技术可检出大量异常,包括1、4、6、8、9、11、13、14、15、18、22号染色体及X染色体的部分或全部缺失,以及2、3、4、5、7、9、12、15、16、17、18、19、20号染色体及Y染色体的部分或全部获得[13-14]。值得注意的是,MTSCC因在形态学及免疫组化特征上与乳头状肾细胞癌有着相似之处,鉴别两者有时较为困难;另外,少黏液基质及梭形细胞为主的MTSCC还需与肉瘤样变的肾细胞癌及间叶来源肿瘤(平滑肌瘤、平滑肌肉瘤及炎性肌纤维母细胞瘤)等进行鉴别。对于不典型的MTSCC,有时需结合肿瘤的形态学、免疫组化及分子遗传特征完成病理诊断。典型患者病理图见图2。
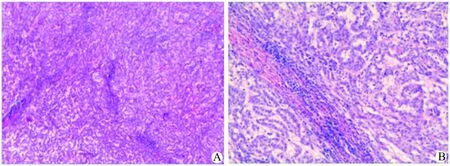
A:HE染色,×40;B:HE染色,×100
图2 典型患者的病理资料,见黏液基质背景下众多的小管状结构,核异型性小,少见病理性核分裂象
对于MTSCC这类肿瘤的治疗,目前尚无指南推荐明确的治疗方式,但多数学者认为MTSCC属低级别肾脏恶性肿瘤,生长缓慢,治疗仍以手术切除为主,术后积极随访即可,对于出现远处转移的患者,有报道称使用舒尼替尼治疗有效[12,15]。大部分患者首诊时肿瘤处于T1a~T2a期,可根据具体情况选择不同术式。结合已有的相关文献报道,总体来讲MTSCC患者的预后较好,但术后仍需积极随访,尤其是对于病理检查结果提示肿瘤具有高级别样改变的患者。

