包装方式对牛肉贮藏过程中蛋白质氧化及降解的影响
扶庆权,张万刚,宋尚新,王海鸥,陈守江
包装方式对牛肉贮藏过程中蛋白质氧化及降解的影响
扶庆权1,张万刚2,宋尚新1,王海鸥1,陈守江1
(1. 南京晓庄学院食品科学学院,南京 211171;2. 南京农业大学食品科技学院/肉品加工与质量控制教育部重点实验室/食品安全与营养协同创新中心,南京 210095)
为探明托盘透氧包装(air packaging, AP)和高氧气调包装(modified atmosphere packaging, MAP, 80% O2+20% CO2)对宰后牛肉贮藏过程中对牛肉嫩度影响的潜在机制,以真空包装(vacuum packaging, VP)为对照,选取6 头西门塔尔纯种母黄牛背最长肌,分别进行托盘透氧包装、真空包装和高氧气调包装,4℃冷库分别贮藏0、4、7、10 d,分别测定蛋白羰基含量及分布、蛋白表面疏水性值、蛋白质溶解度值以及肌间线蛋白和肌联蛋白的降解变化。结果表明:相对于真空包装组,托盘包装组和高氧气调包装组在宰后贮藏过程中肌细胞外围出现羰基氧化荧光信号显著增加,且不断向细胞内部扩散,说明其蛋白质氧化程度不断增加;宰后贮藏10 d后,托盘透氧包装组和高氧气调包装组的蛋白质表面疏水性显著高于真空包装组(< 0.05),而托盘透氧包装组和高氧气调包装组的蛋白溶解性显著低于真空包装组(< 0.05);宰后贮藏7和10 d,托盘透氧包装组和高氧气调包装组的肌间线蛋白和肌联蛋白的降解显著低于真空包装组(< 0.05),说明托盘透氧包装组和高氧气调包装组抑制了肌间线蛋白和肌联蛋白的降解(< 0.05)。托盘透氧包装组和高氧气调包装组能够提高宰后贮藏过程中蛋白质氧化程度,从而抑制其对牛肉骨骼关键蛋白的降解,该研究可为牛肉贮藏提供理论支撑。
冷藏;包装;蛋白质;牛肉;托盘包装;高氧气调包装;真空包装;蛋白质氧化;蛋白质降解
0 引 言
中国是冷鲜肉和肉制品生产和消费大国,而冷鲜肉在冷藏贮藏过程中,由于肉质变得柔嫩多汁且具有良好气味和滋味,已成为国内外消费的主流[1]。近年来,冷鲜肉在生鲜肉的生产和销售中所占的比例不断增大。随着社会经济的发展和人民生活水平的提高,冷鲜肉将是今后鲜肉发展的必然趋势。
目前,在冷鲜肉生产和销售过程中,为了满足不同顾客的需要,不同包装方式冷鲜肉应运而生。最常见的包装形式主要有透氧托盘包装、真空包装和高氧气调包装。这些包装技术的主要作用于防止二次污染、抑制微生物的生长繁殖、提高产品的嫩度和颜色等感官品质,抑制蛋白质氧化和脂肪氧化,减少质量损失,提高产品经济价值[2-3]。真空包装是市场上鲜肉常用的一种包装方式,通常被用于牛肉在运输过程中进行保鲜。它是将包装袋内的空气抽以降低氧气含量,然后采用密封技术,使包装内的鲜肉和空气隔绝,从而保持鲜肉肌红蛋白本身所具有的紫红色[4]。托盘透氧包装是目前肉类超市冷柜中最常见的一种包装方式。鲜肉切分后采用白色的泡沫聚苯乙烯托盘进行包装,上面配以无毒的聚氯乙烯或聚乙烯薄膜通过热封收缩紧贴在托盘上[5]。高氧气调包装(80% O2+20% CO2)主要用于小块牛肉和高价格的牛肉如背部最长肌、腰大肌和半膜肌等的包装,其主要目的是保持鲜肉稳定的亮红色和延长货架期[6]。托盘包装和80%高氧气调包装含有高浓度的氧,在鲜肉冷藏期间潜在引起脂肪氧化和蛋白质氧化,而蛋白质氧化能够降低鲜肉的品质如嫩度和多汁性[7-8]。
蛋白质氧化是通过活性氧或氧化应激的副产物引起蛋白质的共价修饰,从而能够引起蛋白质结构和功能的改变[9]。在鲜肉的加工和贮藏过程中,蛋白质氧化是导致产品品质下降的主要原因。蛋白质氧化可以导致蛋白质交联、氨基酸侧链修饰和蛋白质片段的形成[10]。蛋白质氧化修饰的程度主要通过羰基衍生物的形成、巯基的损失以及分子内和分子间交联的程度来评价。前期已研究证实,蛋白质氧化能够抑制-钙蛋白酶的活性从而影响其对鲜肉关键骨架蛋白的降解速率和程度,从而进一步影响鲜肉肌细胞内水分的分布状态以及嫩化程度[11-12]。
然而,托盘包装、真空包装和80%高氧气调包装3种包装条件下蛋白质氧化调控牛肉品质的机理目前还不清楚,尤其是3种包装方式对牛肉肌细胞蛋白氧化的分布情况以及关键骨架蛋白的降解目前还未有报道。因此,本文主要是探讨3种不同包装方式下蛋白质氧化对宰后牛肉在贮藏过程中的氧化修饰的影响以及对关键骨骼蛋白降解的影响。
1 材料与方法
1.1 材料与试剂
试验选取体质量基本相当的母黄牛(西门塔尔纯种)6头,月龄均为18个月。所有黄牛均在阜阳雨润食品有限公司屠宰,胴体称质量后送入4℃冷库排酸24 h,分别从每头牛的左半边胴体的第13根肋骨到最后一根肋骨处取下背最长肌备用。
聚丙烯托盘、封口膜及真空包装袋由快卫尔(中国)有限公司生产;DNPH(2,4-二硝基苯肼,2,4-dinitrophenylhydrazine),上海阿拉丁试剂有限公司;CY3-羊抗兔二抗、山羊和兔血清,武汉博士得生物工程有限公司;DNPH抗体(D9556)、肌间线蛋白单克隆抗体(ab8976)和HRP(辣根过氧化物酶,horseradish peroxidase)标记羊抗鼠IgG,英国Abcam公司;过氧化物标记的抗鼠免疫球蛋白,美国Bio-Rad公司;PVDF(聚偏二氟乙烯膜,polyvinylidene fluoride)膜,美国Millipore公司;BCA(二喹啉甲酸,bicinchoninic acid)蛋白检测试剂盒和ECl(电化学发光,elctro-chemi-luminescience)试剂盒,美国Thermo公司;BSA (牛血清白蛋白, bovine serum albumin ),美国Promega公司;其他试剂均为分析纯。
1.2 仪器与设备
Turrax T18 Basic高速匀浆机,德国IKA公司; Avanti J-E落地式高速冷冻离心机,美国Beckman Coulter公司; Smart 500气调包装机,西班牙Ulma包装公司;DC800-FB-E真空包装机,美国快尔卫包装公司;托盘透氧包装机,苏果超市有限公司卫岗店; SpectraMax M2酶标仪,美国 Molecular Devices公司; UV-2450紫外分光光度计,日本岛津公司;LSM 700 META 激光共聚焦显微镜,德国蔡司公司;CM1950 超薄冷冻切片机,德国 Leica 公司;PowerPac 1000 垂直电泳仪和Mini-protein Tetra Cell 电泳设备,美国 Bio-Rad 公司;ImageQuant LAS 4000 分子成像系统和 Imagescanner凝胶成像系统,美国 GE公司。
1.3 试验方法
1.3.1 样品处理与试验设计
剔除6条背最长肌上面可见脂肪、筋膜和结缔组织,将牛肉样品分割成厚3 cm、长6 cm、质量500 g的肉块,牛肉样品充分混合后随机分成3组,一组进行托盘透氧包装(PE材料,氧气透过率>7 000 cm3/m2·24 h·atm,二氧化碳透过率>28 000 cm3/m2·24 h·atm),一组进行真空包装(PA/PE材料,氧气透过率<30 cm3/m2·24 h·atm,二氧化碳透过率<120 cm3/m2·24 h·atm),另外一组进行高氧气调包装(80 % O2+ 20% CO2,PA/EVOH/PE材料,封口膜氧气透过率<1 cm3/m2·24h·atm,二氧化碳透过率<5 cm3/m2·24 h·atm)。包装后的牛肉样品放在4℃冷库中贮藏,在0(未包装样品)、4、7、10 d到达后分别取样测定相关的指标。
1.3.2 肌原纤维蛋白的提取
宰后贮藏0、4、7、10 d后牛肉肌原纤维蛋白的提取根据Park 等[13]的方法并进行适当的修改。称取5 g解冻好的冻肉搅碎后,加入25 mL预冷过的肌原纤维蛋白提取缓冲液(2 mol/L MgCl2,100 mol/L NaCl,1 mol/L EGTA,10 mol/L 磷酸盐缓冲液,pH值7.0),使用匀浆机在4℃以12 000 r/min的速度匀浆2次,每次15 s,匀浆液于4 ℃ 2 000 g转速离心10 min。沉淀用20 mL上述缓冲液以同样的条件重复2次。离心后沉淀用20 mL 100 mol/L NaCl溶液重复洗涤2次,离心后沉淀即为肌原纤维蛋白。沉淀首先溶解在20 mol/L磷酸盐缓冲液中(含0.6 mol/L NaCl,pH值6.5),采用双缩脲方法测定肌原纤维蛋白的浓度[14],肌原纤维蛋白浓度最终调整为8 mg/mL。一部分溶解的肌原纤维蛋白溶液用于测定蛋白质氧化指标,一部分溶解的肌原纤维蛋白溶液与等体积的电泳上样缓冲液(125 mmol/L Tris-base,4% SDS(十二烷基硫酸钠,sodium dodecyl sulfate),20%甘油,0.5% MCE(β-巯基乙醇,β-mercaptoethanol),0.1%溴酚蓝,pH值6.8)用漩涡器充分混合,最终肌原纤维蛋白的上样液浓度为4 mg/mL,样品于95 ℃水浴5 min,取出冷却后分装样品,-80 ℃存放用于蛋白电泳和蛋白免疫印迹测定。
1.3.3 肌细胞内羰基分布测定
牛肉样品羰基肌细胞的分布测定参考Astruc 等[15]的方法并做一定的修改。将宰后冷藏贮藏0、4、7、10 d后的牛肉样品,沿肌原纤维方向将牛肉块切成细长条(长2 cm×宽0.2 cm×高0.2 cm),立即放入液氮中快速冷冻60 s以防止肌肉冰晶形成,平行测定6个牛肉样品。冰冻超薄切片机将牛肉细长条切成10m厚的薄片,立即加入0.02% DNPH溶液(溶解在20 mmol/L磷酸盐缓冲液和0.1 mol/L氯化钠的混合液中,pH值6.0)于暗处反应16 h。反应结束后切片样品用含0.1%吐温的磷酸盐缓冲液(20 mmol/L磷酸盐缓冲液,pH值6.75)重复冲洗6次,每次洗涤5 min。切片样品随后用10%的兔血清(溶解在20 mmol/L磷酸盐缓冲液,pH值6.0)37℃封闭1 h。移除封闭液,立即加入DNPH多克隆抗体(稀释100倍)于4℃孵育过夜。孵育结束后切片样品用含0.1%吐温的磷酸盐缓冲液(20 mmol/L磷酸盐缓冲液,pH值6.75)重复冲洗6次,每次洗涤5 min。切片样品用羊血清进行于37℃二次封闭1 h。移除封闭液,加入CY3标记的羊抗兔免疫球蛋白溶液(稀释50倍)暗处孵育1 h。反应结束后同样用磷酸盐缓冲液重复冲洗6次,每次洗涤5 min。采用激光共聚焦显微镜观察肌细胞间羰基分布情况。测试条件为激发波长555 nm,发射波长570 nm,样品放大200倍,曝光时间相同。
1.3.4 表面疏水性测定
肌原纤维蛋白表面疏水性测定参照Chelh 等[16]的方法并进行适当的修改。宰后贮藏0、4、7、10 d后牛肉样品提取的肌原纤维蛋白用20 mmol/mL 的磷酸盐缓冲液(pH值6.0)溶解并调整的至蛋白浓度为2 mg/mL,取出2 mL 蛋白溶液加入40L 1 mg/mL 溴酚蓝溶液充分混合,对照组取2 mL的20 mmol/mL 磷酸盐缓冲液(pH值6.0)同样加入40L的1 mg/mL 溴酚蓝溶液充分混合。样品和对照品用摇床在室温震荡10 min,于4℃条件下以4 000 g 离心15 min,在波长595 nm处测定上清液吸光度值,表面疏水性结果即结合溴酚蓝采用公式(1)进行计算。
结合溴酚蓝=40× (OD对照组− OD样品) / OD对照组(1)
1.3.5 蛋白溶解度测定
宰后贮藏0、4、7、10 d后牛肉样品的溶解度测定参考Joo 等[17]的方法略有改动。肌浆蛋白溶解度测定:1 g碎肉加入0.025 mol/mL(pH值7.2)预冷的磷酸钾缓冲液,匀浆机以最低速匀浆1 min,放入摇床固定于4℃匀速震荡过夜,取出匀浆液1 500 g离心20 min,上清液肌浆蛋白溶解度采用双缩脲方法进行测定。总蛋白溶解度测定:1 g碎肉加入20 mL的0.1 mol/mL(含1.1 mol/mL碘化钾,pH值7.2)预冷的磷酸盐缓冲液,按肌浆蛋白同样的方法和程序进行匀浆、震荡、离心和测定。肌原纤维蛋白的溶解度为总蛋白溶解和肌浆蛋白溶解度的差值。
1.3.6 肌间线蛋白测定
宰后冷藏0、4、7、10 d后牛肉样品的肌间线蛋白测定参考Fu 等[18]的方法并进行稍微修改。肌间线蛋白电泳采用4%的浓缩胶和10%的分离胶,按胶孔从左到右边的顺序依次加入4L标准蛋白和30g肌原纤维蛋白分别用来测定目标蛋白的位置和分析不同样品肌间线蛋白的变化。浓缩胶于恒压60 V电泳30 min,进入分离胶后增大电压至120 V 继续电泳,当溴酚蓝跑至分离胶的底部停止电泳。肌间线蛋白在恒压90 V条件下于4℃转印120 min,转印液为10%甲醇, 192 mmol/L甘氨酸和25 mmol/L Tris-base。转印完成后的聚偏氟乙烯膜放入含有5%脱脂奶粉的TTBS溶液(20 mmol/L Tris-base,137 mmol/L NaCl, 0.05% Tween 20,5 mmol/L KCl)于常温孵育封闭2 h。肌间线蛋白一抗按1:500的稀释倍数于4℃条件下孵育反应15 h。反应结束后取出膜并用TTBS溶液反复洗涤6次,每次5 min。聚偏氟乙烯膜置于HRP标记二抗溶液(1:500)中于室温反应2 h。反应结束后取出膜同样用TTBS溶液反复洗涤6次,每次5 min。聚偏氟乙烯膜表面用ECL显色剂在暗箱反应显色5 min,使用凝胶成像仪扫描曝光并拍照。肌间线蛋白的条带强度用Quantity one分析软件进行半定量分析。肌间线蛋白降解的结果用免疫反应的荧光强度值除以对照样品的荧光强度值所得百分比来表示。
1.3.7 肌联蛋白测定
宰后冷藏贮藏0、 4、7、10 d后牛肉样品的肌联蛋白的降解测定参照Li 等[19]的方法并稍加修改。5%的连续聚丙烯酰胺凝胶电泳(丙烯酰胺:甲叉丙烯酰胺=100:1,1.5 mol/L Tris-base,pH值8.0,0.1% SDS,0.05%过硫酸铵,0.05%四甲基乙二胺),每孔肌原纤维蛋白的上样量均为20g。每块胶以恒流4.5 mA常温电泳20 h电泳结束。采用考马斯亮蓝对肌联蛋白胶进行固定、染色和脱色,使用凝胶成像仪扫描并拍照。
1.4 数据统计与分析
所有数据均表示为平均值±标准偏差,所有牛肉样品使用6个重复,每个重复进行3次平行试验。采用SAS 8.0软件对所有数据进行分析,不同处理组的差异采用ANOVA的方差分析,平均值的差异比较采用邓肯的多重比较,每2个数据的均值的差异显著性采用-检验进行(< 0.05)。
2 结果与分析
2.1 不同包装方式对牛肉肌细胞内羰基分布的影响
图1所有样品白色荧光信号均为牛肉肌细胞中蛋白氧化形成的羰基。不同包装方式对牛肉贮藏过程中肌细胞内羰基分布的影响如图1所示。

注:AP,VP和MAP表示托盘透氧包装、真空包装、高氧气调包装。视野放大倍数均为200倍;标尺表示100 μm。
由图1可知,宰后冷藏贮藏4 d后,托盘包装和高氧气调包装牛肉样品的肌细胞四周出现氧化荧光信号,荧光分布不均匀,真空包装牛肉样品的肌细胞四周出现少量的氧化荧光信号。宰后冷藏贮藏7 d后,托盘包装和高氧气调包装牛肉样品的白色荧光信号逐渐增强,且由肌细胞外部逐渐向胞内扩散,真空包装牛肉样品的少量的白色荧光分布在肌细胞四周。宰后冷藏贮藏10 d后,托盘包装和高氧气调包装牛肉样品的肌细胞四周呈现高亮荧光信号,白色荧光部分逐渐向肌细胞内部渗透且荧光信号不断增强,而真空包装牛肉样品的白色荧光信号相对较弱,分布多集中在细胞的周围。相对于真空包装,托盘包装和高氧气调包装的牛肉样品白色荧光信号的增加说明随着贮藏时间的延长,其羰基含量越来越高,蛋白质氧化程度加剧。蛋白质氧化是活性氧(ROS,reactive oxygen species)直接或间接与蛋白质氧化应激二级产物反应引起蛋白质的共价修饰[9]。活性氧自由基与氨基酸反应或者活性氧氧化氨基酸的残基侧链、肽骨架以及功能基团,从而导致蛋白质分子内和分子间的交联、肽链骨架的断裂或氨基酸侧链的氧化修饰,导致蛋白质功能的损失和酶活性钝化[20]。在已有的参考文献中,大多数作者通常采用氨基酸侧链形成的蛋白羰基化合物浓度来评估蛋白质氧化的程度,此方法过程繁琐且测定结果误差大。
在本试验中,采用免疫组化的方法同时使用激光共聚焦显微镜技术来观察蛋白质氧化程度,能够更加清晰明了的观察到肌细胞氧化的变化过程。随着贮藏时间的延长,托盘包装和高氧气调包装的牛肉样品相对托盘包装其氧化程度加剧,且氧化荧光信号由细胞外逐渐向细胞内渗透。Astruc等[15]通过激光共聚焦来观测羰基在肌细胞内的荧光分布情况,发现宰后动物体内蛋白氧化起始于细胞膜上蛋白氧化,ROS从肌细胞膜向细胞内部传递的过程中肌浆蛋白和肌原纤维蛋白逐渐被氧化。
2.2 不同包装方式对牛肉肌原纤维蛋白表面疏水性的影响
溴酚蓝同非水溶性蛋白特异性结合被认为是测定肌原纤维蛋白表面疏水性值的一种简单而可靠的方法,而结合溴酚蓝的数量是反应蛋白表面疏水性值的一个指标[16]。3种包装方式处理的牛肉样品贮藏4 d后其表面疏水性值无显著性差异(图2,> 0.05)。
牛肉样品贮藏7 d后,托盘包装牛肉样品的表面疏水性值显著高于真空包装和气调包装的牛肉样品(< 0.05),而真空包装的牛肉样品和高氧气调包装的牛肉样品相比无显著性差异(> 0.05)。牛肉样品贮藏10 d后,托盘包装牛肉样品的表面疏水性值显著高于真空包装和气调包装的牛肉样品(< 0.05),而80%高氧气调包装的牛肉样品的表面疏水性值又显著高于真空包装的牛肉样品(< 0.05)。溴酚蓝能够与蛋白质发生反应产生强烈的相互作用,因此它常常作为一种简单而可靠的方法用来鉴别肌原纤维蛋白构象的变化和特征化表面疏水位点的暴露[21-22]。试验结果与Chelh等[16]报道的结果具有一致性。Chelh 等发现随着加热温度的增加,蛋白质氧化程度高,猪肉肌原纤维蛋白的表面疏水性也就随之增加。Santé-Lhoutellier 等[23]研究发现,蛋白质氧化增加了肌原纤维蛋白表面疏水性。蛋白表面疏水性增加表明化学氧化可能引起蛋白质二级结构和三级结构的变化,这些结构的改变由于非极性氨基酸分子进入疏水簇导致了蛋白质分子的展开或者重排[24]。
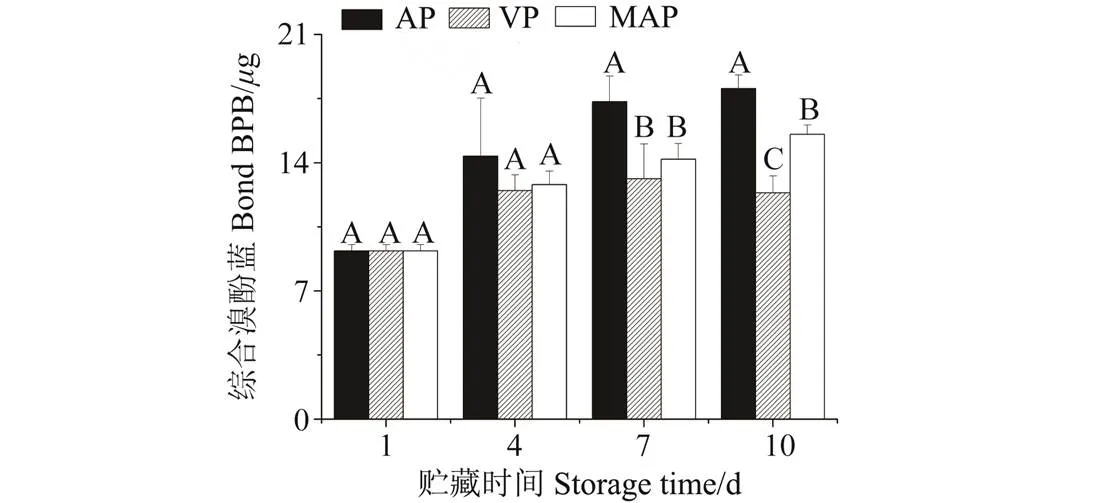
注:不同字母表示不同包装方式在相同冷藏时间下差异显著(P < 0.05),下同。
2.3 不同包装方式对牛肉蛋白质溶解度的影响
3种包装方式处理对牛肉样品宰后贮藏过程中肌原纤维蛋白溶解度、肌浆蛋白溶解度和总蛋白溶解度的影响如图3所示。
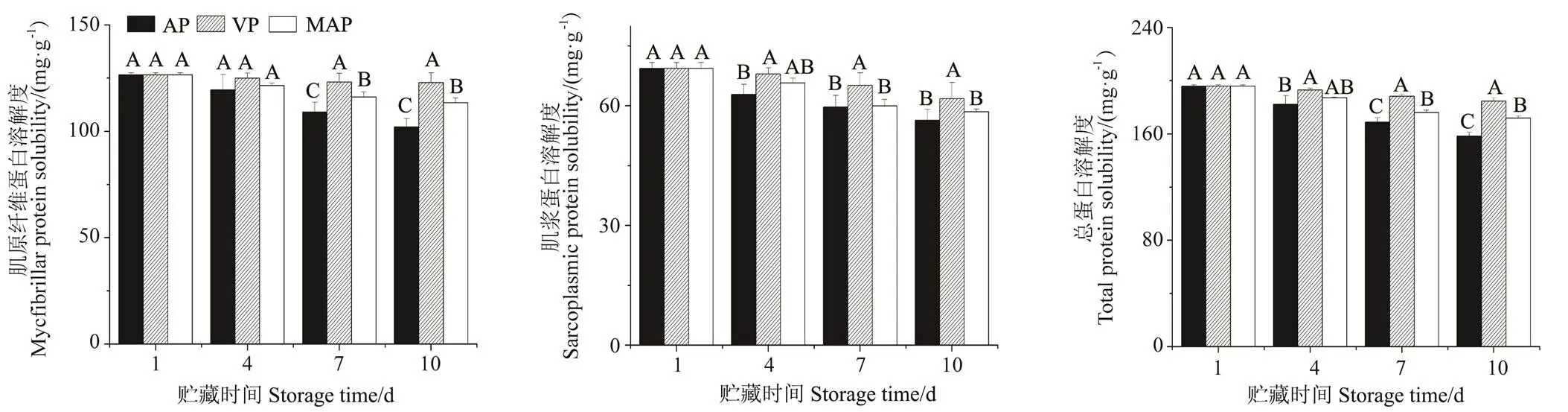
图3 3种包装方式在4℃贮藏10d过程中对牛肉样品肌原纤维蛋白溶解度、肌浆蛋白降解度和总蛋白溶解度的影响
由图3可知,在牛肉样品贮藏4 d,3种包装方式的牛肉样品的肌原纤维蛋白的溶解度无显著性差异(> 0.05),而真空包装牛肉样品的肌浆蛋白和总蛋白溶解度显著高于托盘包装的牛肉样品(< 0.05)。在牛肉样品贮藏7 和10 d,真空包装牛肉样品的肌原纤维蛋白和总蛋白溶解度显著高于托盘包装和高氧气调包装的牛肉样品(< 0.05),而高氧气调包装牛肉样品的肌原纤维蛋白和总蛋白的溶解度显著高于托盘包装的牛肉样品(< 0.05)。在牛肉样品贮藏7 d,真空包装牛肉样品的肌浆蛋白溶解度显著高于托盘包装和高氧气调包装的牛肉样品(< 0.05)。而托盘包装牛肉样品的肌浆蛋白溶解度和80%高氧气调包装的牛肉样品相比无显著性差异(> 0.05)。在牛肉样品贮藏10 d,真空包装牛肉样品的肌浆蛋白溶解度显著高于托盘包装的牛肉样品(< 0.05),而托盘包装牛肉样品的肌浆蛋白溶解度和高氧气调包装的牛肉样品相比无显著性差异(> 0.05)。溶解度可用于表征蛋白质变性聚集和交联程度。氧化可以改变蛋白质的天然构象导致溶解度降低。在本文研究中,托盘包装和80%高氧气调包装的牛肉样品在宰后贮藏过程中相对于真空包装其蛋白质溶解度的下降可能是由于氨基酸侧链基团的氧化修饰程度高导致蛋白质构象的变化加剧,从而使蛋白质分子内疏水基团的暴露更多,表面疏水性不断增加。同时由于游离巯基易氧化转化为二硫键,导致蛋白质的出现大量聚集和沉淀[25]。
2.4 不同包装方式对牛肉样品肌间线蛋白的影响
肌间线蛋白是中间丝状体结构的一个主要蛋白,其主要功能是维持肌细胞的结构和功能的完整性。肌间线蛋白的降解在宰后贮藏期间对肉质量的改善有重要的影响。不同包装方式对宰后牛肉贮藏过程中肌间线蛋白降解的影响如图4a、4b所示。
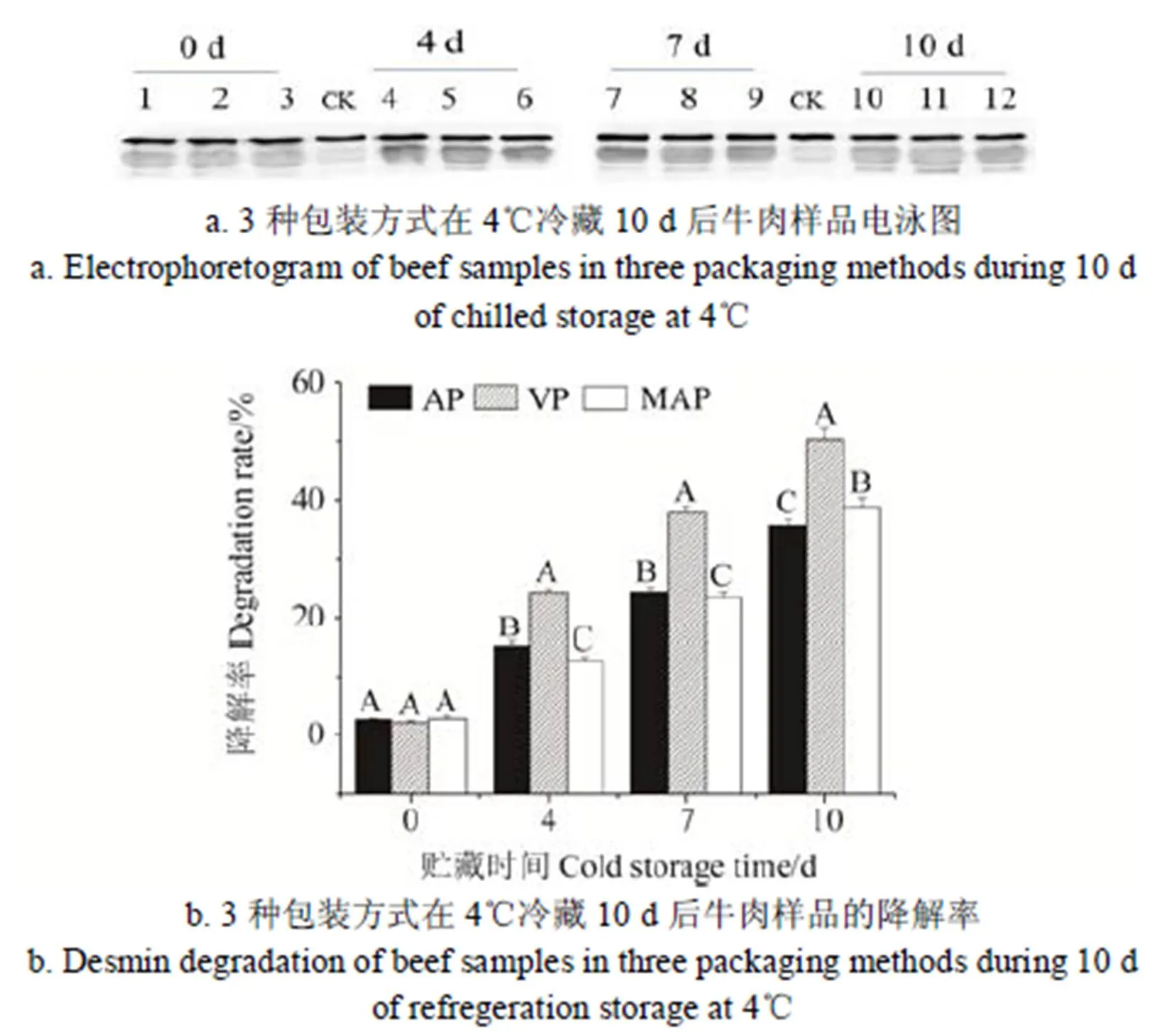
注:孔1、2、3代表贮藏0 d未包装的牛肉样品;孔4、5、6代表贮藏4 d后的托盘包装、真空包装、高氧气调包装的牛肉样品;孔7、8、9代表贮藏7 d后的托盘包装、真空包装、高氧气调包装的牛肉样品;孔10、11、12代表贮藏10 d后的托盘包装、真空包装、高氧气调包装的牛肉样品。对照样品为0 d的牛肉样品。
由图4b可知,不管是宰后贮藏4 、7 还是10 d,真空包装牛肉样品的肌间线蛋白降解率显著高于托盘包装和高氧气调包装的牛肉样品(< 0.05),而在宰后贮藏4和7 d,托盘包装牛肉样品的肌间线蛋白降解率显著高于高氧气调包装的牛肉样品(< 0.05),在宰后贮藏10 d,托盘包装牛肉样品的肌间线蛋白降解率显著低于高氧气调包装的牛肉样品(< 0.05)。肌间线蛋白是一种含量丰富且非常重要的细胞骨架蛋白,它连接骨骼肌中肌节和肌膜的Z-盘,分子量约53 kDa,其主要功能是维持肌细胞结构和功能的完整性[26-27]。在宰后贮藏期间,肌间线蛋白的降解与鲜肉嫩度的改善密切相关[28]。在本研究中,3种包装方式的肌间线蛋白降解不同,这可能是由于3种包装的牛肉样品的蛋白质氧化程度不同导致钙激活酶活性抑制程度不同,从而使得活性不同的钙激活酶在宰后贮藏期间对肌间线蛋白的降解程度有所差异。
2.5 不同包装方式对牛肉样品肌联蛋白的影响
肌联蛋白横跨Z线和M线,维持肌纤维结构的完整性。宰后肌联蛋白的降解速率和鲜肉嫩度密切相关。在宰后贮藏过程中,牛肉的肌联蛋白由完整条带降解为分子量大约2 400 kDa的降解产物。不同包装方式对宰后牛肉贮藏过程中肌联蛋白降解的影响如图5所示。由图5可知,在宰后贮藏0 d后,3种包装方式下牛肉样品的肌联蛋白降解条带T2没有显著差异(> 0.05)。无论宰后冷藏贮藏4 、7还是10 d后,真空包装牛肉样品的肌联蛋白降解条带T2显著高于托盘包装和高氧气调包装的牛肉样品(< 0.05),即托盘包装和高氧气调包装抑制了宰后牛肉肌联蛋白的降解。肌联蛋白是分子量很大的肌原纤维蛋白,约为2.8×106kDa,在有条纹的肌原纤维蛋白中,它横跨Z线和M线,从而维持肌纤维骨架结构的完整性[29]。肌联蛋白也是对降解最敏感的骨架蛋白之一,在宰后贮藏期间很容易降解,因此宰后贮藏过程中肌联蛋白的降解速率和鲜肉嫩度密切相关[30]。试验中,我们无论宰后贮藏4、7还是10 d,真空包装牛肉样品的肌联蛋白降解率显著高于托盘包装和气调包装的牛肉样品,说明包装方式对肌联蛋白的降解有显著的影响。
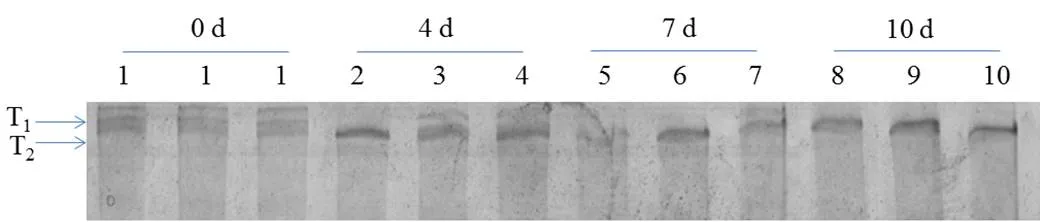
注:T1表示完整的肌联蛋白,T2表示降解的肌联蛋白;孔1代表0 d的样品并作为对照;孔2、3、4代表贮藏4 d后的托盘包装、真空包装、高氧气调包装的牛肉样品;孔5、6、7代表贮藏7 d后的托盘包装、真空包装、高氧气调包装的牛肉样品;孔8、9、10分别代表10 d后的托盘包装、真空包装、高氧气调包装的牛肉样品。
3 结 论
相对于真空包装,托盘包装和高氧气调包装牛肉样品在4℃贮藏10 d后其羰基在肌细胞分布不断增加,说明羰基含量增加,蛋白质氧化程度加剧。宰后贮藏10 d后,托盘透氧包装组和高氧气调包装组的蛋白质表面疏水性显著高于真空包装组(< 0.05);宰后贮藏7 和10 d,托盘透氧包装组和高氧气调包装组的肌间线蛋白和肌联蛋白的降解显著低于真空包装组(< 0.05),说明托盘透氧包装组和高氧气调包装组抑制了肌间线蛋白和肌联蛋白的降解(< 0.05)。
[1] 刘泽龙. 蛋白质氧化对肉及肉制品持水和水合特性的影响机理研究 [D]. 无锡:江南大学,2012.
[2] Kerry J P, O’grady M N, Hogan S A. Past, current and potential utilisation of active and intelligent packaging systems for meat and muscle-based products: A review [J]. Meat Science, 2006, 74: 113-130.
[3] Shacter E. Quantification and significance of protein oxidation in biological samples [J]. Drug Metabolism Reviews, 2000, 32: 307-326.
[4] Vitale M, Pérez-Juan M, Lloret E, et al. Effect of aging time in vacuum on tenderness, and color and lipid stability of beef from mature cows during display in high oxygen atmosphere package[J]. Meat Science, 2014, 96: 270-277.
[5] 孔保华,刁新平. 冷却肉包装保鲜技术的研究进展 [J]. 肉类研究,2008,2:54-59.
[6] Skandamis P N, Nychas G E. Preservation of fresh meat with active and modified atmosphere packaging conditions [J]. International Journal of Food Microbiology, 2002, 79: 35-45.
[7] Liu C L, Zhang Y M, Yang X M, et al. Potential mechanisms of carbon monoxide and high oxygen packaging in maintaining color stability of different bovine muscles [J]. Meat Science, 2014, 97(2): 189-196.
[8] Clausen I, Jakobsen M, Ertbjerg P, et al. Modified atmosphere packaging affects lipid oxidation, myofibrillar fragmentation index and eating quality of beef [J]. Packaging Technology and Science, 2009, 22(2): 85-96.
[9] Delles R M, Xiong Y L. The effect of protein oxidation on hydration and water-binding in pork packaged in an oxygen-enriched atmosphere [J]. Meat Science, 2014, 97(2): 181-188.
[10] Livingston M, Brewer S, Killifer J, et al. Shelf life characteristics of enhanced modified atmosphere packaged pork [J]. Meat Science, 2004, 68(1): 115-122.
[11] Huff-Lonergan E, Lonergan S M. Mechanism of water-holding capacity of meat: The role of postmortem biochemical and structural changes. Meat Science, 2005, 71(1): 194-204.
[12] Lund M N, Heínonen M, Baron C P, et al. Protein oxidation in muscle foods: a review [J]. Molecular Nutrition and Food Research, 2011, 55(1): 83-95.
[13] Park D, Xiong Y L, Alderton A L. Concentration effects of hydroxyl radical oxidizing systems on biochemical properties of porcine muscle myofibrillar protein [J]. Food Chemistry, 2006, 101(3): 1239-1246.
[14] Gornall A G, Bardawill C J, David M M. Determination of serum proteins by means of the biuret reaction [J]. Journal of Biological Chemistry, 1949, 177(2): 751-766.
[15] Astruc T, Marinova P, Labas R, et al. Detection and localization of oxidized proteins in muscle cells by fluorescence microscopy [J]. Journal of Agricultural and Food Chemistry, 2007, 55(23): 9554-9558.
[16] Chelh I, Gatellier P, Santé Lhoutellier V. Technical note: A simplified procedure for myofibril hydrophobicity determination [J]. Meat Science, 2006, 74(4): 681-684.
[17] Joo S T, Kauffman R G, Kim B C, et al. The relationship of sarcoplasmic and myofibrillar protein solubility to colour and water-holding capacity in porcine longissimus muscle [J]. Meat Science, 1999, 52(3): 291-297.
[18] Fu Q Q, Liu R, Zhang W G, et al. Effects of different packaging systems on beef tenderness through protein modifications[J]. Food and Bioprocess Technology, 2015, 8(3): 580-588.
[19] Li Y P, Liu R, Zhang W G, et al. Effect of nitric oxide on μ‑calpain activation, protein proteolysis, and protein oxidation of pork during post-mortem aging[J]. Journal of Agriculture and Food Chemistry, 2014, 62(25): 5972-5977.
[20] Stadman E R, Levine R L. Protein oxidation [J]. Annals the New York Academy of Sciences, 2000, 899(1): 191-208.
[21] Sheikh M I, Gerdes U. Interaction of phenolsulphonphtalein dyes with rabbit plasma and rabbit serum albumin [J]. Archives Internationales de Physiologie et de Biochimie, 1978, 86: 613-623.
[22] Huang Y R, Hua Y F, Qiu A Y. Soybean protein aggregation induced by lipoxygenase catalyzed linoleic acid oxidation [J]. Food Research International, 2006, 39: 240-249.
[23] Santé-Lhoutellier V, Aubry L, Gatellier P. Effect of oxidation on in vitro digestibility of skeletal muscle myofibrillar proteins [J]. Journal of Agricultural and Food Chemistry, 2007, 55: 5343-5348.
[24] Yarnpakdee S, Benjakul S, Visessanguan W, et al. Thermal properties and heat-induced aggregation of natural actomyosin extracted from goatfish (Mulloidichthys martinicus) muscle as influenced by iced storage [J]. Food Hydrocolloids, 2009, 23: 1779-1784.
[25] 胡忠良. 鸡胸肉肌原纤维蛋白氧化对其热诱导凝胶和理化特性的影响 [D]. 南京:南京农业大学,2012.
[26] Xue M, Huang F, Huang M, et al. Influence of oxidation on myofibrillar proteins degradation from bovine via µ-calpain [J]. Food Chemistry, 2012, 134: 106-112.
[27] Kitamura S, Muroya S, Tanabe S, et al. Mechanism of production of troponin T fragments during postmortem aging of porcine muscle [J]. Journal of Agricultural and Food Chemistry, 2006, 53: 4178-4181.
[28] Zhang W G, Xiao S, Ahn D U. Protein oxidation: basic principles and implications for meat quality [J]. Critical Reviews in Food Science and Nutrition, 2013, 53(11): 1191-1201.
[29] Furst D, Osborn M, Weber K. Myogenesis in the mouse embryo: Differential onset of expression of myogenic proteins and the involvement of titin in myofibril assembly [J]. Journal of Cell Biology, 1989, 109(2), 517-527.
[30] Penny I F, Dransfield E. The relationship between toughness and troponin-T in conditioned beef [J]. Meat Science, 1979, 3(4): 135-138.
Effects of different packaging methods on protein oxidation and degradation of beef during refrigeration storage
Fu Qingquan1, Zhang Wangang2, Song Shangxin1, Wang Haiou1, Chen Shoujiang1
(1.211171,; 2.210095,)
Air packaging (AP), vacuum packaging (VP) and modified atmosphere packaging (MAP) have been widely used during chilled storage in retail meat market. However, different packaging has its advantage and disadvantage. AP can get desirable red color in a short time, but protein oxidation and lipid oxidation occur during cold storage. VP keeps a stable purple color and increases the shelf life of fresh meat. However, VP can cause liquid exudation and product deformation of fresh meat. MAP with 80% oxygen can maintain desirable and stable cherry red color of fresh meat and extend the shelf life of fresh beef. Nevertheless, it can possibly cause protein oxidation and lipid oxidation of fresh meat during chilled storage. Protein oxidation is the covalent modification of proteins induced by reactive oxygen species or by-products of oxidative stress. Previous researches have demonstrated that protein oxidation inhibits-calpain activity, which may influence the rate and degree of protein degradation of fresh meat. The aim of this study was to examine effects of AP and high-oxygen MAP (80% O2+ 20% CO2) on the tenderness of beef samples during postmortem cold storage using VP as control. Six longissimus dorsi muscles of Simmental purebred yellow cattle were precooled at 4℃ for 24 h, which were then randomly assigned to MAP, VP and AP, and stored for 0, 4, 7 and 10 d respectively at 4℃. The carbonyl content and distribution, the values of protein surface hydrophobicity, the solubility values of myofibrillar protein, sarcoplasmic protein and total protein, and the degradation of desmin and titin were determined, respectively. The results showed that AP and MAP presented the stronger fluorescence light signal in a peripheral area, and the fluorescence light signal spread to the internal cellular environment, which showed that the extent of protein oxidation increased. The values of protein surface hydrophobicity of beef samples from AP and MAP were significantly higher than that of the samples from VP (<0.05), while the protein solubility values of beef samples from AP and MAP were significantly lower than that of the samples from VP 10 d after the storage (<0.05). The degradation of desmin and titin of beef samples from AP and MAP was significantly lower compared to the VP 7 and 10 d after the storage (<0.05), which showed protein oxidation further inhibited the degradation of desmin and titin. Increased protein oxidation under AP and MAP inhibits the degradation of the key protein during postmortem cold storage.
refrigeration; packaging; protions; beef; air packaging; high oxygen modified atmosphere packaging; vacuum packaging; protein oxidation; protein degradation
10.11975/j.issn.1002-6819.2018.18.038
TS251. 5
A
1002-6819(2018)-18-0308-07
2018-05-03
2018-08-18
江苏省科技厅自然科学青年基金项目(BK20170146);江苏省高校自然科学研究面上项目(17KJB550006);南京晓庄学院高层次培育项目(2016NXY14)
扶庆权,博士,高级实验师,研究方向为畜产品加工与质量控制。Email:fuqingquan@126.com
扶庆权,张万刚,宋尚新,王海鸥,陈守江. 包装方式对牛肉贮藏过程中蛋白质氧化及降解的影响[J]. 农业工程学报,2018,34(18):308-314. doi:10.11975/j.issn.1002-6819.2018.18.038 http://www.tcsae.org
Fu Qingquan, Zhang Wangang, Song Shangxin, Wang Haiou, Chen Shoujiang.Effects of different packaging methods on protein oxidation and degradation of beef during refrigeration storage[J]. Transactions of the Chinese Society of Agricultural Engineering (Transactions of the CSAE), 2018, 34(18): 308-314. (in Chinese with English abstract) doi:10.11975/j.issn.1002-6819.2018.18.038 http://www.tcsae.org

