miR-499-5p干预对心肌梗死大鼠心肌细胞凋亡的影响
吴丽梦,李 恩,周小翠,郭小宏,王 蒙,赵英杰,汪 涛
1)郑州大学第二附属医院心血管内科 郑州 450014 2)郑州大学第二附属医院老年医学科 郑州 450014
心肌梗死由心肌组织长时间缺血引起,病理过程涉及梗死早期炎症反应、心肌细胞凋亡以及梗死后期心脏重塑如心肌肥厚、心肌纤维化。心肌梗死仍然是世界范围内的主要死因[1]。
微小核糖核苷酸(miRNAs)是一类长度为20~25个核苷酸的非编码型RNA,与靶基因mRNA 3’非编码区域(3’UTR)结合,下调mRNA翻译或促进mRNA降解从而负性调控靶基因表达[2-3]。近来研究[4-6]表明急性心肌梗死(acute myocardial infarction, AMI)发生后体内多种miRNAs表达异常,包括miR-1、miR-133、miR-208、miR-499-5p等心脏特异性miRNA。AMI后两个关键事件为心肌细胞凋亡和细胞坏死。有研究[7-9]发现存在多种miRNAs调节心肌细胞凋亡,其中miR-499-5p在心肌细胞氧化应激损伤中发挥抗心肌细胞凋亡作用。但目前关于其在心肌梗死后心肌细胞凋亡中的作用及机制仍不清楚。本研究中作者观察了心肌梗死大鼠梗死心肌组织miR-499-5p表达量的改变,探讨miR-499-5p在大鼠心肌梗死后心肌细胞凋亡中的作用和相关机制。
1 材料与方法
1.1实验动物、细胞及药品试剂、仪器成年雄性SD大鼠,体重200~250 g,8~10周龄,购自郑州大学实验动物中心。大鼠在(25±2) ℃的环境温度下饲养, 光照条件12 h/12 h。建模前饲养1周使其适应环境,所有动物实验均遵守《实验动物管理条例》并遵循动物伦理学要求。HEK293细胞购于中科院上海细胞库。miR-499-5p mimics及竞争性短核糖核苷酸阴性对照序列(scramble-NC)购自广州锐博公司,miR-499-5p特异性引物、Lipofectamine2000、组织RNA提取试剂盒、反转录试剂盒购自Invitrogen公司,pcDNA3.1-Sox6(上海吉玛基因公司),Sox6、Bax及Bcl-xl一抗(Abcam公司,香港),GAPDH抗体、二抗(Sigma公司)。小动物超声仪(FUJIFILM Visual Sonics公司), DW3000-B型小动物呼吸机(北京众实迪创科技发展有限责任公司),心电图机(中国成都, RM6240多导生理信号采集处理系统)。
1.2AMI模型的建立大鼠腹腔注射100 g/L水合氯醛(3 mL/kg)麻醉,取仰卧位并固定于手术台上,参考文献[10]的方法,在左侧第3、4肋间隙开胸后暴露心脏,打开心包膜。在左心耳根部下方3 mm处进针,肺动脉圆锥边缘出针,用5-0缝合线结扎左冠脉前降支(LAD),结扎部位以下心室肌颜色发绀或者颜色发白、心室壁运动减弱,心电图Ⅱ导联T波高尖、S-T段呈持续弓背向上抬高,表明模型制作成功,记录结扎时间。
1.3qRT-PCR检测梗死区和非梗死区心肌miR-499-5p表达取18只大鼠,按1.2方法处理,分别于LAD结扎1、6、48 h处死6只大鼠,分离左室前壁梗死心肌与非梗死心肌,应用Trizol试剂盒提取心肌组织总RNA,反转录为cDNA;参照操作说明,应用特异性引物、SYBR荧光试剂盒、Taqman试剂盒在PRISM 7900HT检测系统(Applied Biosystems)中完成qPCR。miR-499-5p上游引物:5’-GGGGTTA AGACTTGCAGTG-3’,下游引物:5’-CAGTGCGT GTCGTGGAGT-3’;U6:上游引物:5’-CTCGCTTCG GCAGCACA-3’,下游引物:5’-AACGCTTCACGAATTTGCGT-3’。反应体系(总体积25 μL):cDNA 2.5 U,上、下游引物各1 μL, SYBR GreenⅠ PCR master Mix 12.5 U,DEPC水8 μL。反应条件:95 ℃预变性10 min;95 ℃ 15 s,60 ℃ 60 s,循环40次。根据2-ΔΔCt法计算miR-499-5p的表达水平,U6为内参。
1.4实验分组大鼠随机分成假手术组、AMI组、AMI+scramble-NC组(阴性对照组)、AMI+miR-499-5p mimics组(干预组),每组12只。除假手术组外,其余3组大鼠均制作AMI模型。假手术组除不结扎LAD外,其他操作与其他3组相同。阴性对照组、干预组在有效结扎LAD后,参照商家说明书和参考文献[10],用胰岛素笔将20 μL的scramble-NC或miR-499-5p mimics与Lipofectamine2000混合液(体积比1∶1)注射到结扎部位以下左室前壁心肌内,之后逐层缝合关胸。术后连续3 d给予青霉素(20万U/只)抗感染治疗。
1.5心肌细胞凋亡率测定术后48 h,取4组大鼠梗死区域心肌组织,洗净后置于40 g/L多聚甲醛中固定1 d,常规石蜡包埋后切片,按照TUNEL试剂盒说明书行切片染色后拍照。每张切片选取10个区域计数凋亡细胞(细胞核棕染),凋亡率=凋亡细胞数/总细胞数×100%。
1.6Sox6及凋亡相关蛋白表达的检测术后48 h,取4组大鼠梗死区域心肌组织,检测 Sox6 mRNA和蛋白,以及凋亡蛋白 Bax、抗凋亡蛋白 Bcl-xl 的表达。qRT-PCR检测梗死区域心肌组织Sox6 mRNA的表达。Sox6上游引物序列:5’-CCCCTCTGAACATGGTGGTGGC-3’,下游引物序列:5’-TGAGACTGCCCCTGCCGAGT-3’。Western blot检测蛋白表达:应用RIPA组织裂解液提取样本总蛋白。BCA法检测蛋白浓度。上样量20 μg,80 g/L SDS PAGE电泳分离蛋白后转至PVDF膜, 50 g/L脱脂牛奶封闭2 h后加特异性一抗(Sox6、Bax及Bcl-xl一抗均按1∶1 000稀释),4 ℃下孵育过夜,PBS-T液洗膜后用辣根过氧化物酶标记的山羊抗兔二抗(按1∶500稀释)室温孵育2 h后曝光;用Image J软件分析条带灰度值,以目标条带和GAPDH条带灰度值的比值作为目标蛋白的相对表达量。
1.7大鼠心脏超声评估心功能术后第28天,4组各取6只大鼠,麻醉后采用小动物超声仪探头(型号:Veno2100)于胸骨旁左室长轴切面检测M超图像,测定左室收缩末期直径、左室舒张末期直径,计算左室射血分数(EF)和左室短轴缩短率(FS)。
1.8Sox6与miR-499-5p靶向关系的确定经TargetScan Human、miRDB网站预测Sox6是miR-499-5p最可能的靶基因;经PCR扩增获得野生型Sox6 3’UTR基因;应用点突变试剂盒使Sox6 3’UTR种子序列GUCUUAA(120~126)突变为GUCCUAA,获得突变型Sox6 3’UTR基因。随之将野生型、突变型Sox6 3’UTR基因片段克隆到荧光素酶报告载体中形成荧光素酶报告质粒。将HEK293细胞以1×105个/孔的密度铺于6孔板,应用Lipofectamine2000、500 μg Sox6 3’UTR或Sox6 3’UTR-突变型质粒与miR-499-5p mimics或阴性对照序列共转染HEK293细胞;转染18 h后转移至96孔板,培养24 h后收集细胞检测荧光素酶活性,以萤火虫荧光素酶基因作为报告基因,以海肾荧光素酶基因作为对照基因进行标准化。
1.9统计学处理应用SPSS 21.0处理数据。采用配对t检验比较不同时间点梗死区域和非梗死区域心肌组织miR-499-5p的表达,采用单因素方差分析比较4组大鼠心肌细胞凋亡率、EF值、FS值,Sox6 mRNA,Sox6、Bax、Bcl-xl 蛋白的表达及4组HEK293细胞荧光素酶基因的表达,两两比较采用LSD-t法。检验水准α=0.05。
2 结果
2.1梗死区域心肌组织miR-499-5p的表达LAD结扎1、6、48 h,大鼠梗死区域心肌组织miR-499-5p的表达量较非梗死区域下降,见表1。
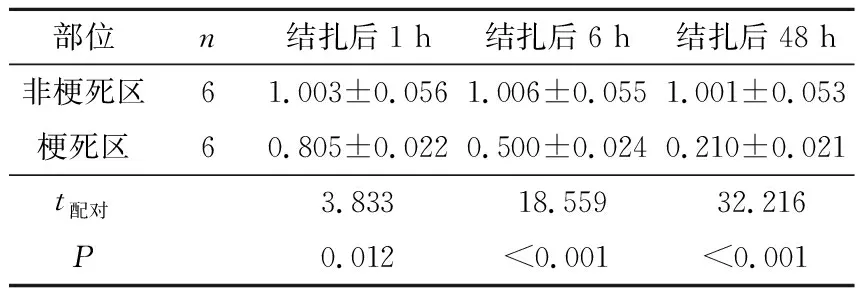
表1 梗死区和非梗死区心肌miR-499-5p的表达
2.2 4组大鼠心肌细胞凋亡率及心功能指标比较
4组大鼠心肌切片TUNEL染色结果见图1。4组大鼠典型心脏M超见图2。心肌梗死第28天大鼠心脏标本梗死部位以下可见明显心肌瘢痕组织。与阴性对照组和AMI组比较,干预组心肌细胞凋亡率降低,EF值、FS值升高,结果见表2。

A、B、C、D:分别为假手术组、AMI组、阴性对照组和干预组图1 各组典型TUNEL染色结果 (×400)

图2 4组大鼠典型M超图像表2 4组凋亡率、EF、FS的比较
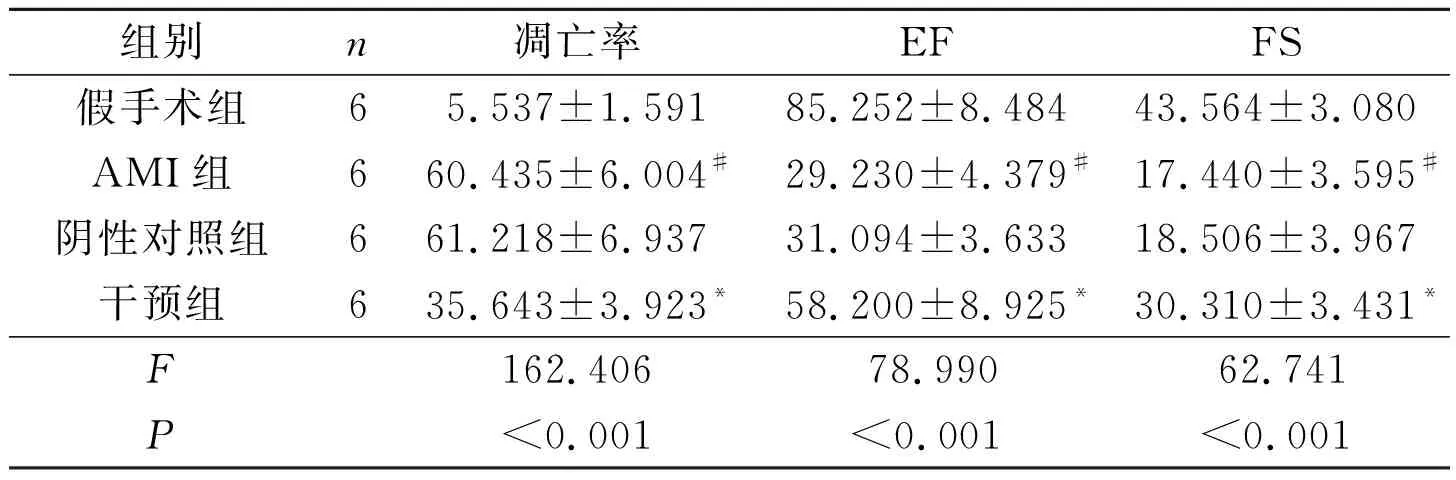
%
#:与假手术组相比,P<0.05;*:与其他3组相比,P<0.05
2.3 4组大鼠梗死区心肌组织Sox6mRNA和凋亡相关蛋白的表达见图3、表3。与假手术组相比,AMI 组Sox6 mRNA,Sox6、Bax蛋白表达均增高,Bcl-xl 蛋白表达降低;与 AMI 组和阴性对照组相比, 干预组 Sox6 mRNA,Sox6、Bax蛋白表达降低,Bcl-xl 蛋白表达升高。
2.4miR-499-5p与Sox6的靶向关系miR-499-5p 与 Sox6 3’UTR 第 120~126 位碱基序列结合位点见图4。荧光素酶报告实验结果:阴性对照+野生型质粒组、miR-499-5p mimics+野生型质粒组、阴性对照+突变型质粒组、miR-499-5p mimics+突变型质粒组荧光素酶活性分别为(0.997±0.087)、(0.490±0.070)、(1.006±0.094)和(0.997±0.081)(F=51.161,P=0.006); 与其他3组相比,miR-499-5p mimics+野生型质粒组荧光素酶活性降
低(P<0.01),提示miR-499-5p 特异性调控Sox6 3’UTR。
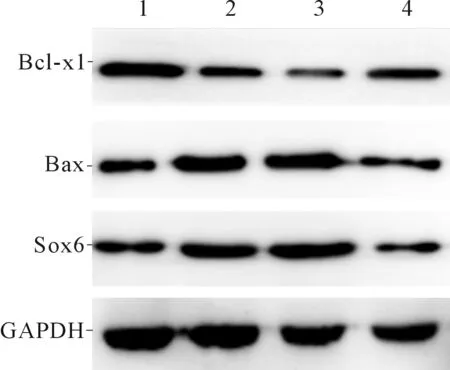
1~4:分别为假手术组、AMI组、阴性对照组和干预组图3 4组大鼠梗死区心肌组织Sox6和相关凋亡蛋白的表达表3 4组大鼠梗死区心肌组织Sox6和相关凋亡蛋白的表达
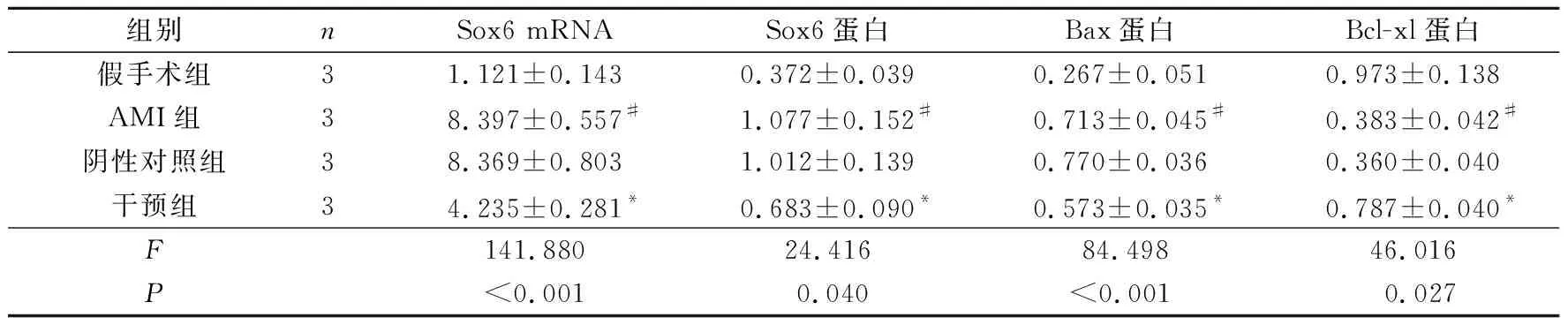
组别nSox6 mRNASox6蛋白Bax蛋白Bcl-xl蛋白假手术组31.121±0.1430.372±0.0390.267±0.0510.973±0.138AMI组38.397±0.557#1.077±0.152#0.713±0.045#0.383±0.042#阴性对照组38.369±0.8031.012±0.1390.770±0.0360.360±0.040干预组34.235±0.281*0.683±0.090*0.573±0.035*0.787±0.040*F141.88024.41684.49846.016P<0.0010.040<0.0010.027
#:与假手术组相比,P<0.05;*:与其他3组相比,P<0.05

图4 miR-499-5p 与 Sox6 3’UTR 的结合位点
3 讨论
miR-499-5p是进化上高度保守的肌肉特异性microRNA,在心室中高度表达[11-12]。体内、体外实验均有研究[13-16]表明在缺血、缺氧或氧化应激等因素刺激下,心肌组织或细胞miR-499表达水平改变,但结论不一致。Li等[13]发现心肌细胞缺氧后miR-499水平降低,miR-499过表达可抵抗心肌细胞缺氧性损害;而Wang等[14]在H2O2所致心肌细胞氧化应激损伤模型中发现miR-499水平改变与H2O2剂量相关,低剂量H2O2致miR-499水平升高,相对高剂量H2O2致miR-499水平降低;Matkovich及Shieh等[15-16]发现miR-499在患心肌病的人群或心肌肥厚大鼠的心肌组织中表达增加,且足以引起心力衰竭。可见不同因素刺激所致损伤心肌组织或细胞miR-499表达水平各异,而且关于miR-499-5p的效应目前的研究结论不一致,有的报道为心脏保护性作用,有的证实为损害性效应;本实验的意义在于首次探究miR-499-5p在大鼠心肌梗死后的作用和可能的分子机制。
我们的前期实验证实大鼠冠脉结扎1、6、48 h后梗死区域心肌miR-499-5p表达均低于非梗死区,提示miR-499-5p可能参与心肌梗死后心肌组织的病理过程。进一步分组观察结果表明,与假手术组比较,AMI组心肌细胞凋亡率增加,术后第28天心脏EF值、FS值降低,心功能下降;而与阴性对照组、AMI组相比,干预组心肌细胞凋亡率降低,术后第28天心脏EF值、FS值升高,心功能改善,证实miR-499-5p干预可对梗死心肌发挥保护作用。
特定miRNA可调控多种mRNA表达和功能,且某一种mRNA亦可被多种miRNAs调节[17-18]。有报道[12-14]miR-499-5p在抗心肌细胞凋亡作用中的靶基因可能为PDCD4、钙调磷酸酶和发动蛋白相关蛋白-1等;崔瑞新等[19]发现miR-499可能通过增加PI3K mRNA表达水平和Akt磷酸化来发挥抗缺血-再灌注心肌损伤作用。Sox6基因在细胞死亡、分化和增殖中起关键作用,在不同人类恶性肿瘤中为抑癌基因;Sox6作为促凋亡因子,调节心肌细胞凋亡[7,20]。我们首先应用靶基因预测软件推断Sox6为miR-499-5p可能的靶基因,之后应用双荧光素酶报告实验发现当细胞共转染 miR-499-5p 和野生型 Sox6 3’UTR 报告质粒时,荧光素酶活性被抑制;此外,Western blot结果表明,上调梗死心肌miR-499-5p的表达可使Sox6在mRNA和蛋白水平表达均降低,证实Sox6为miR-499-5p的靶基因。
此外,与阴性对照组和AMI组比较,miR-499-5p干预后梗死心肌Bax蛋白表达降低,Bcl-xl蛋白表达升高。BCL-2家族包括抗凋亡、促凋亡成员,可作为某些凋亡介质的下游关键因子[21-22],结合Sox6为促凋亡因子,我们设想BCL-2家族中Bax、Bcl-xl很可能为凋亡通路中Sox6下游因子,但尚缺乏细胞实验或者转基因动物实验来证实该推测。另外本研究仅在动物水平证实miR-499-5p在心肌梗死后的抗心肌细胞凋亡作用,凋亡相关指标检测较少,并且尚未在细胞水平上探索miR-499-5p对缺氧心肌细胞的作用,因此本研究存在一些局限性。
综上所述,我们的实验结果初步证实了miR-499-5p具有抗心肌细胞凋亡的作用,“miR-499-5p/Sox6/Bax,Bcl-xl”可能为调节凋亡的通路,为探索治疗心肌梗死的新策略提供了初步依据。