系统性红斑狼疮患者外周血单个核细胞中微管相关蛋白轻链3和溶酶体相关膜蛋白2基因表达及其临床意义
吴邱红,贾艾敏,袁佳利,刘 静,杨明辉,陈 勇,袁国华
系统性红斑狼疮(systemic lupus erythematosus,SLE)是一种多系统、多脏器损害的高异质性、慢性自身免疫性疾病,其特征性免疫学改变是体内产生多种自身抗体。研究显示,自噬在抗原多肽提呈过程中发挥重要作用[1]。自噬是真核生物中进化保守的对细胞内物质进行周转的重要过程,可分为3种主要方式:微自噬、巨自噬和分子伴侣介导的自噬(chaperone-mediated autophagy,CMA)。自噬过程中有一系列相关蛋白的参与,其中微管相关蛋白轻链3(microtubule-associated protein light chain 3,LC3)和溶酶体相关膜蛋白2(lysosomal-associated membrane protein type-2,LAMP-2)分别是巨自噬和CMA的标志物[2]。为探讨巨自噬和CMA在SLE病变过程中的作用,本研究采用实时定量PCR方法检测SLE患者外周血单个核白细胞(peripheral blood mono-nuclear cells,PBMCs)LC3和LAMP-2 在mRNA水平的表达,分析其与SLE的关系。
1 材料与方法
1.1 对象
纳入2017年11月至2018年3月在川北医学院附属医院风湿免疫科诊治的SLE患者88例,其中男4例,女84例;患者年龄10~60岁,平均35岁;病程2~240个月,中位病程68个月。纳入患者的诊断均符合1997年美国风湿病学会(Ameri-can Rheumatic Society,ARA)制定的SLE分类标准[3],采用SLE疾病活动指数(disease activity index,DAI)积分判断疾病活动度。选择性别、年龄匹配的健康体检者40例作为正常对照组,其中男3例,女37例;受检者年龄15~60岁,平均34.5岁。本研究遵循人体受试者道德伦理学标准,研究方案得到川北医学院伦理委员会批准(批文号:20170128),所有受试者均签署知情同意书。
1.2 主要试剂及设备
人淋巴细胞分离液Ficoll-Hypaque(天津灏洋生物制品科技有限公司);总RNA抽提试剂Trizol(美国Ambion公司);逆转录试剂盒(德国QIAGEN公司)。实时定量PCR扩增体系(Quant Studio12K Flex实时定量PCR 仪,美国ABI公司)。
1.3 方法
1.3.1 PBMCs的分离:采集受试者晨起外周静脉血各5 ml,以乙二胺四乙酸(ethylenediamine tetraacetic acid,EDTA)-K2抗凝。按照操作说明用Ficoll-Hypaque密度梯度离心,分离收集PBMCs。
1.3.2 总RNA提取和cDNA合成:用Trizol试剂按照说明提取总RNA,所提取RNA溶于焦碳酸二乙酯(diethyl pyrocarbonate,DEPC)处理的去离子水中,紫外分光光度法分析纯度和浓度,按反转录试剂盒说明操作,选择oligo(dT)18引物吸取12 μL RNA溶液,反转录合成cDNA。
1.3.3 实时荧光定量PCR法测定目的基因表达:实时荧光定量PCR内参Actin和目的基因引物设计与合成见表1。SYBR green实时定量PCR反应体系总体积为20 μl,其中ddH2O 8.1 μl,SYBR混合物10.1 μl,正向引物(10 μmol/L)0.4 μl,反向引物(10 μmol/L)0.4 μl,cDNA 1 μl。PCR 循环条件:95 ℃反应2 min,95 ℃反应5 s,60 ℃反应14 s,共40个循环。反应在ABI QuantStudio12K Flex定量荧光PCR仪上进行,每次实验都设立无模板对照,标本和对照均做复孔。反应结果为每个反应管内的目标基因荧光信号到达设定的阈值时所经历的循环数Ct值减去内参Actin的Ct 值(△Ct值),计算RQ值(RQ=2-△△Ct),作为目标基因的相对表达量。
1.3.4 SLE患者PBMCs中LC3和LAMP-2在mRNA水平的表达与临床特征及治疗效果关系评估:以健康对照组受检者PBMCs中LC3和LAMP-2在mRNA 水平的平均相对表达量作为基线,LC3 mRNA相对表达量低于均值-SD者(即<0.47)定义为表达量降低,LAMP-2 mRNA 相对表达量>均值+2SD(即>2.35)者定义为表达量增高,对具有不同LC3 mRNA和LAMP-2 mRNA表达水平患者的临床表现和实验室检查结果进行评估。SLE患者出现下列任一项表现者定义为肾损害:(1)尿蛋白定量>0.5 g/24 h或4 mg/(kg·h);(2)离心尿红细胞>5个/HPF;(3)肾功能异常(包括肾小球和/或肾小管功能);(4)肾组织活检异常。患者主要采用糖皮质激素、羟氯喹和免疫抑制剂治疗,后者包括环磷酰胺(cyclophosphamide,CTX)、硫唑嘌呤(azathioprine,AZA)、吗替麦考酚酯(mycophenolate mofetil,MMF)、他克莫司、甲氨蝶呤(methotrexate,MTX)。对不同LC3 mRNA和LAMP-2 mRNA表达组患者肾损害发生率和治疗效果进行比较。
1.4 统计学方法

2 结果
2.1 SLE患者PBMCs中LC3 mRNA和LAMP-2 mRNA相对表达量变化
SLE患者PBMCs中LC3 mRNA相对表达量为0.783±0.435,明显低于正常对照组的1.021±0.551,差异有统计学意义(t=2.323,P=0.02); SLE患者PBMCs中LAMP-2 mRNA相对表达量为2.402±2.233,明显高于正常对照组的1.015±0.667,差异有统计学意义 (t=4.542,P=0.000)(图1)。
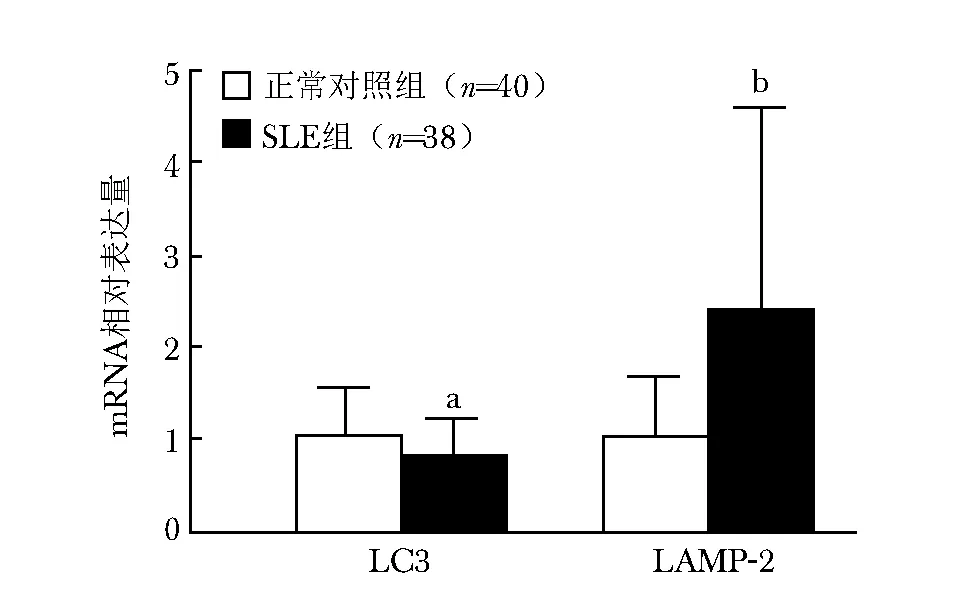
图 1 两组受试者PMBCs中LC3 mRNA和LAMP-2 mRNA表达量比较Fig 1 Comparison of LC3 mRNA and LAMP-2 mRNA in PBMCs between two groups
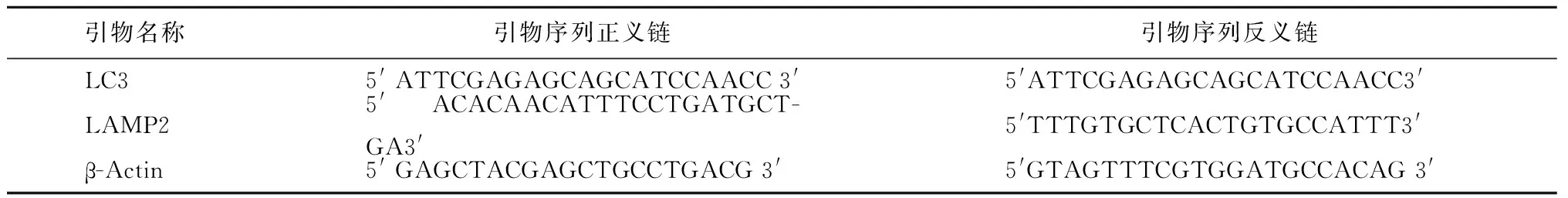
表1 引物序列Table 1 Sequence of target genes
2.2 SLE患者PBMC中LC3和LAMP-2 mRNA表达与SLEDAI的关系
SLE患者SLEDAI为4 (2,8),PBMCs中LC3 mRNA相对表达量与SLEDAI呈明显负相关(rs=-0.175,P=0.103),PBMCs中LAMP-2 mRNA相对表达量与SLEDAI呈明显正相关(rs=0.312,P=0.003)(图2)。
2.3 SLE患者PBMCs中LC3和LAMP-2在mRNA水平表达与临床特征的关系
LAMP-2 mRNA相对表达量升高的SLE患者肾脏损害发生率分别高于LAMP-2 mRNA相对表达量未升高者,差异均有统计学意义(P=0.013、0.004); LC3 mRNA相对表达量降低患者的血液系统受累率为65.2%,明显高于无LC3 mRNA相对表达量降低患者的32.3%,差异有统计学意义(P=0.006)。不同LC3 mRNA和LAMP-2 mRNA表达组间患者的其他相关临床、实验室检查指标以及糖皮质激素、羟基氯喹和免疫抑制剂使用情况的差异均无统计学意义(表2)。
3 讨论
SLE是自身免疫性疾病,其病理机制为患者体内产生多种自身抗体,并由此诱发针对自身组织或器官的系列免疫反应,导致靶组织或器官损伤。众所周知,抗体(包括自身抗体)的产生需首先经抗原加工处理,然后提呈给T淋巴细胞,才能诱导相应抗体的产生。研究证实,抗原的加工处理阶段主要发生在自噬溶酶体内,因而自噬在免疫系统的发育及免疫反应的发生中具有重要作用,其功能异常与多种自身免疫性疾病有关,包括类风湿关节炎、Cronhn病和SLE[4]。
自噬是除凋亡外生命科学领域中研讨的热点,根据细胞内底物运送到溶酶体内的方式不同,哺乳动物细胞的自噬可分为微自噬、巨自噬和CMA 3种主要方式,目前自噬与疾病的关系研究主要集中在后2种自噬方式。巨自噬起始于双膜结构的自噬泡,在哺乳动物的自噬泡形成过程中LC3修饰过程发挥至关重要的作用,对自噬泡的形成必不可少,因而可作为巨自噬的特征性标志物。CMA则是通过分子伴侣识别底物蛋白,并将其转运至溶酶体内进行降解。首先,分子伴侣蛋白HSPA8/ HSC70选择性识别底物蛋白中的特定氨基酸序列KFERQ并与之结合成复合物,同时在HSP40、HSP90和Hip等分子的帮助下使底物蛋白质去折叠。然后,该复合物与溶酶体膜表面受体LAMP-2结合而转运至溶酶体内进行降解,目前主要通过LAMP-2表达检测CMA。
有研究显示,LC3和LAMP-2 在mRNA水平的表达分别与巨自噬和CMA的发生率呈正相关[5],本研究对SLE患者LC3和LAMP-2 mRNA的表达进行定量检测,对巨自噬和CMA在SLE病变过程中的作用进行探讨。结果显示, SLE患者PBMCs中LC3 mRNA的表达明显低于正常对照组,而LAMP-2 mRNA表达则显著高于正常对照组,提示SLE患者巨自噬功能可能降低,而CMA功能则可能增强。
巨自噬与SLE的相关性研究已有报道。Clarke等[6]研究发现,巨自噬在SLE患者的B淋巴细胞和单核细胞/巨噬细胞中发生率增高,Alessandri等[7]的研究则显示SLE患者外周血T细胞巨自噬发生率与正常人比较无明显差异,但SLE患者T细胞对自噬诱导的刺激反应性下降。本研究对SLE患者的PBMCs(单核细胞和T、B淋巴细胞)中LC3表达进行检测,结果显示LC3 mRNA表达降低,与笔者在另一组56例SLE患者中观察到的结果一致,而且这个结果与采用Cyto-IDR自噬检测试剂盒经流式细胞分析技术(免疫荧光法)检测的PBMCs自噬发生率呈正相关[8],提示SLE患者可能存在总体巨自噬功能的相对不足。研究证实临床常用的SLE治疗药物糖皮质激素可促进T细胞巨自噬的发生[9],而动物和临床试验均证实,用巨自噬诱导剂雷帕霉素、sirolimus等治疗方法重塑巨自噬功能可显著减少自身抗体、减少血管炎和肾脏损害的发生率[10-11]。这些结果均支持本研究观察到的SLE存在巨自噬功能不足的结果。
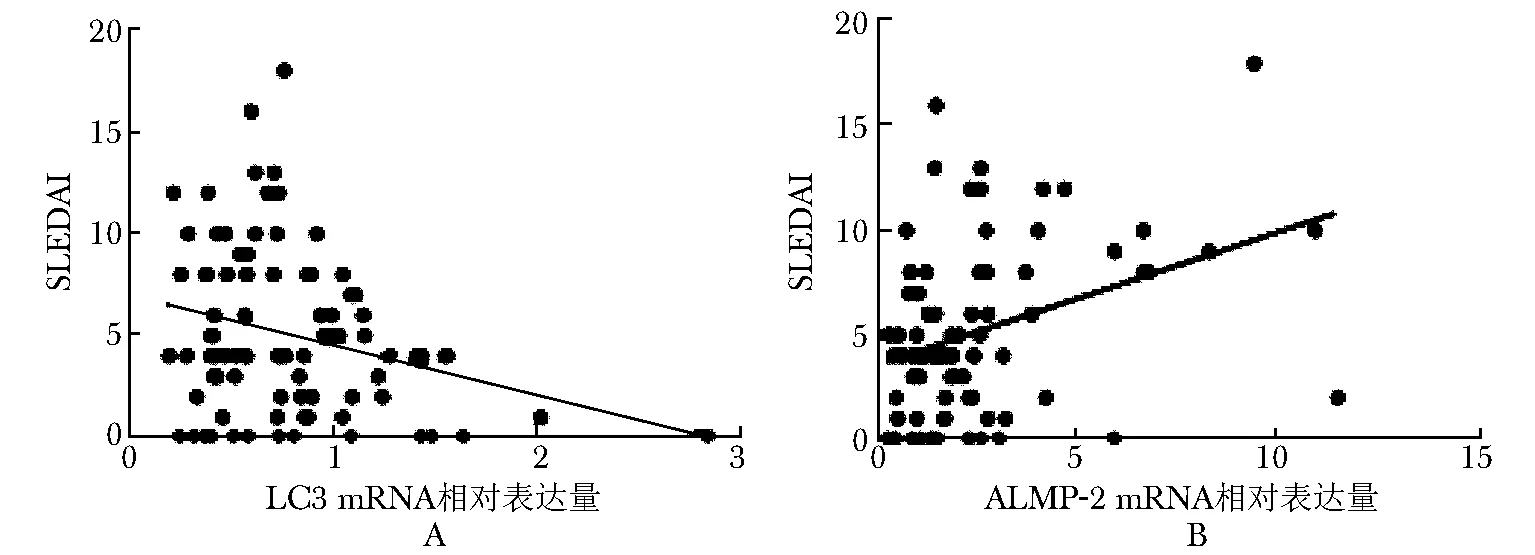
图 2 患者PBMCs中LC3 mRNA表达与SLEDAI相关性分析结果Fig 2 Correlation between expression level of LC3 mRNA in PBMCs and SLEDAI
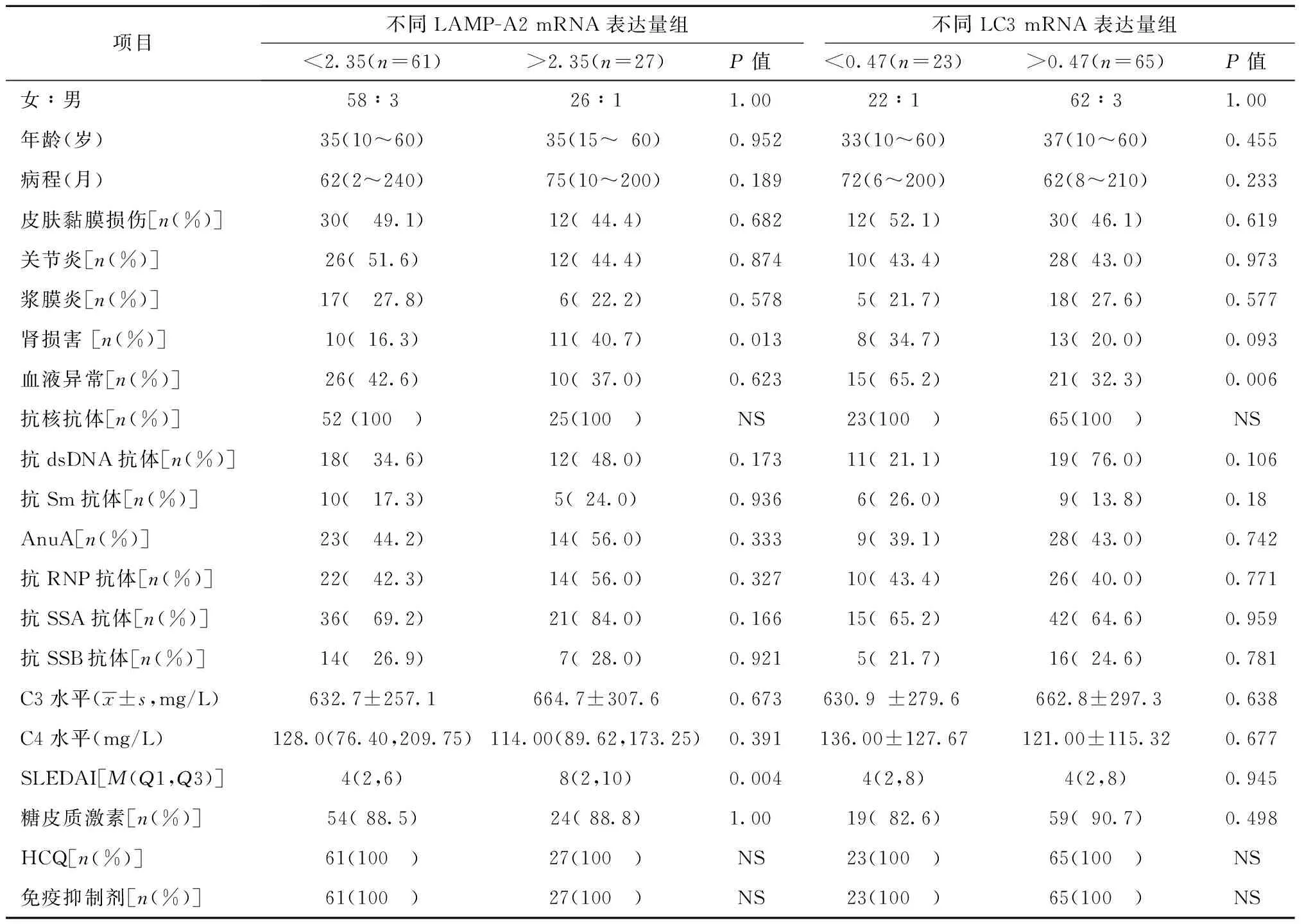
表2 不同LC3 mRNA和LAMP2 mRNA表达水平的SLE患者临床表现和实验室检查结果Table 2 Clinical menifastetions and laboratory results in SLE patients with different expression levels of LC3 mRNA and LAMP2 mRNA
CMA在抗原的加工处理和提呈中具有举足轻重的作用,沉默LAMP-2表达可减少人B细胞系提呈内源性抗原,而LAMP-2过度表达则可增加抗原的提呈量。目前CMA在SLE发病中的作用主要基于动物实验结果,Page等[12]在对SLE易患鼠(MRL/lpr)D的研究中发现,CMA的标志物LAMP-2在MRL/lpr脾脏B细胞中过度表达,表明SLE存在CMA活性的变化,说明CMA在SLE发病过程起着极为重要的作用。有关CMA在SLE患者的发生过程中的作用目前报道甚少。本研究对SLE患者的CMA标志物LAMP-2 mRNA表达进行检测,提示CMA在SLE患者的PBMCs中可能增高,极有可能成为治疗SLE的靶点。虽然有报道显示前列腺癌中LAMP-2 mRNA表达与CMA呈正比[13],但在SLE的PBMCs中LAMP-2 mRNA表达能否正确反映CMA的发生情况尚需通过分离溶酶体、采用Western blot检则LAMP-2蛋白的表达等有待进一步加以证实。
本研究进一步对SLE患者PBMCs中LC3和LAMP-2在mRNA水平的表达量与SLE临床特征的关系进行分析,显示LC3 mRNA表达水平与SLEDAI呈负相关,LAMP-2 mRNA表达水平与SLEDAI呈明显正相关;LAMP-2 mRNA表达增高患者肾脏损害发生率明显高于非增高患者, SLEDAI评分也明显增高,而LC3 mRNA表达降低患者的血液系统受累明显高于无LC3 mRNA表达降低患者,提示LC3表达降低或LAMP-2表达增高分别导致的巨自噬功能下降以及CMA的增强均参与SLE的病变过程。
总之,本研究通过检测LC3 mRNA和LAMP-2 mRNA的表达初步观察SLE患者的自噬发生情况,发现巨自噬标志物LC3mRNA表达下降,而CMA特异性相关分子LAMP-2表达增高,提示SLE可能存在巨自噬相对不足及CMA功能相对增强,但尚需进一步通过Western blot或免疫荧光技术对相应分子的蛋白表达及自噬体的定位加以验证。

