多细胞生物自噬的分子机制和生理功能
张 宏,张 慧
(中国科学院 生物物理研究所,生物大分子国家重点实验室,北京 100101)
1 自噬的研究历史
自噬的发现最早可以追溯到19世纪50年代,比利时科学家汀·德·迪夫(Christian de Duve)通过电子显微镜观察到肝脏细胞内存在一类单层膜或者双层膜的结构,这些结构内常常包含有部分细胞质成分以及各种细胞器[1].随后托马斯·阿什福德(Thomas Ashford)和基斯·波特(Keith Porter)注意到在胰高血糖激素(glucagon)的刺激下,在小鼠肝细胞(hepatocytes)中发现溶酶体包裹着处于不同降解阶段的线粒体[2].这是人们首次发现溶酶体除了降解内吞物外还可以降解胞内物质.1963年,迪夫在溶酶体国际会议上提出了自噬(autophagy)的概念,即“自己吃自己”[3].其后科学家称这种双层膜结构为自噬小体(autophagosome),其膜结构可能来源于内质网(endoplasmic reticulum,简称ER)等细胞器,这一过程是溶酶体依赖的非选择性降解细胞内物质的过程[4].
20世纪60年代到90年代初,对自噬的研究主要是借助电镜在细胞系和各种组织切片中开展形态学上的观察.这一时期的研究发现了自噬小体的初始结构隔离膜(isolation membrane),以及自噬小体与内吞体(endosome)融合的中间结构amphisome[5-6].经过近30年的研究,自噬过程逐渐明朗,如图1所示.自噬过程可以被分为一系列的步骤,包括诱导、隔离膜成核、扩展和闭合、自噬小体与内吞体及溶酶体融合、自噬溶酶体降解以及最后的大分子物质的循环再利用.然而,对自噬的早期研究并没有真正揭示自噬过程的分子机制,科研人员利用大量生化手段虽然寻找到了多个自噬活性的调控因子,但一直没有鉴定出参与自噬过程的关键因子.
图1 细胞自噬的过程
2 酵母模型的建立
自噬过程发现后的30年中,因缺乏合理的研究体系,人们对自噬分子机制的了解几乎停滞.1992年,日本科学家大隅良典(Yoshinori Ohsumi)实验室[7]在单细胞酿酒酵母中观察到自噬的现象.酵母内有一个巨大液泡,类似于动物细胞中的溶酶体.大隅良典通过光学显微镜观察到在蛋白酶缺陷酵母中,在氮源缺失的情况下,液泡内会积累大量的自噬小泡结构(autophagic bodies).这些小泡是在胞质中形成的双层膜自噬小体与液泡融合后释放在液泡里的自噬小体内膜及包裹物.在正常酵母中,液泡里的蛋白酶能非常快地降解这一结构,所以观察不到自噬小泡这一中间结构.大隅良典的这一发现建立了酵母为研究细胞自噬的遗传筛选模型.他们推测如果参与自噬小体形成的自噬基因缺失,自噬过程将会被阻止,饥饿诱导形成的自噬小体就可能被抑制,因此液泡中便不会有自噬小泡的累积.于是,他们饥饿(氮源缺失)处理蛋白酶缺失的酵母,诱导自噬发生,筛选那些在液泡中不累积自噬小泡的突变体.通过遗传筛选,他们得到了第一个酵母自噬基因,命名为apg1(之后被命名为ATG1)[8].ATG1突变体在饥饿条件下存活率显著降低,表明自噬对酵母存活是必需的.随后他们首先筛选那些饥饿处理后存活率降低的突变体,然后再鉴定液泡内无自噬小泡聚集的突变体.通过筛选他们鉴定出了包括ATG1在内的15个ATG相关的基因[8].
在同一时期,美国科学家丹尼尔(Daniel Klionsky)教授研究发现酵母液泡蛋白酶Ape1的前体蛋白(proAPI)由胞质转运到液泡的通路(cytoplasm to vacuole targeting, 简称Cvt)并不需要参与经典的分泌途径的基因,他们通过遗传筛选鉴定了一系列Ape1前体运输缺陷的突变体,命名为Cvt突变体[9].随后,大隅良典教授发现酵母的Cvt通路与自噬过程基本一样,Ape1的前体是通过一种类似自噬过程的双层膜的转运膜泡(cytoplasm to vacuole targeting vesicle, 简称Cvt vesicle)包裹由胞质转运到液泡内[10].不同之处是Cvt小泡比自噬小体要小,进一步研究揭示这些CVT基因与大隅良典实验室发现的自噬基因部分相同.2003年人们将参与自噬通路的基因统一命名为ATG基因(autophagy-related genes)[11].以往人们一直认为自噬是随机的包裹一些胞内物质进行降解,Cvt通路中水解酶前体运输过程提示自噬也可选择性地运送底物.后来发现自噬可以选择性地包裹一些受损伤的细胞器或蛋白聚集体进行降解.
通过上述两个相互独立的酵母遗传筛选共发现了大约20个自噬相关基因,介导自噬小体形成的不同步骤,它们作用于自噬小体的起始、延伸、闭合,以及与液泡融合等不同阶段,构成了自噬通路的核心组分[5-6].Atg1-Atg13-Atg17复合体参与自噬小体形成的早期阶段;磷脂酰肌醇3-激酶复合体(PI3K)结合调控自噬小体的形成;跨膜蛋白Atg9穿梭于自噬起始位点和自噬小体间为自噬小体的形成提供膜来源;Atg12-Atg5和Atg8-PE两个类泛素的结合系统在自噬小体膜的延伸过程中发挥着关键作用.Atg8和Atg12是两个类泛素蛋白,能够被类泛素化的分子共轭系统分别与磷脂酰乙醇胺(phosphatidylethanolamine, 简称PE)和Atg5蛋白连接.Atg8的前体分子被半胱氨酸蛋白酶Atg4剪切后,被类泛素激活酶(ubiquitin-activating enzyme, 简称E1)Atg7激活,随后被转移到类泛素转移酶(ubiquitin- conjugation protein, 简称E2)Atg3上,并最终被连接到PE上.Atg8-PE在自噬小体的外膜和内膜上都有定位,因此Atg8-PE被广泛用作自噬小体的标记分子.在Atg12系统中,Atg12在类E1激活酶Atg7和E2转移酶Atg10的作用下,与Atg5共价连接.Atg12-Atg5偶联后与Atg16相互作用,在Atg16的聚合作用下,形成双倍的Atg12-Atg5-Atg16复合体.该复合体在Atg8与PE的共轭连接中表现出泛素连接酶E3的活性.至此细胞自噬的核心机制逐步展现出来,鉴于大隅良典先生在细胞自噬分子机制方面做出的杰出贡献,2016年被授予诺贝尔生理学或医学奖.
3 多细胞生物的自噬过程
随着人们在多种生物体,如拟南芥、果蝇、线虫、小鼠及哺乳动物细胞系中对自噬的广泛研究,发现自噬过程具有保守性.多细胞生物的自噬小体的形成与单细胞酵母的自噬过程相似,都起始于隔离膜的诱导、延伸、闭合,然后自噬小体与溶酶体融合降解底物,最后大分子物质循环利用.酵母中的研究工作极大地推动了高等动物细胞中自噬作用的研究进程.尽管如此,哺乳动物细胞中的自噬作用比酵母中的自噬作用要复杂得多.首先,在酵母中,所有的自噬小体起始于液泡附近的单一位点.这一位点被称为前自噬小体结构(pre-autophagosomal structure, 简称PAS).而在哺乳动物细胞中,隔离膜可以在胞质内的多个位点同时发生[12-13].研究发现哺乳动物细胞中,自噬小体起源于内质网上PI3P富集的区域,并形成形似希腊字母Ω的膜结构,称为欧米茄小体(omegasome)[14].欧米茄小体可以为Atg蛋白的招募、膜结构的扩张以及自噬小体的形成提供平台.然后,隔离膜结构不断延伸,包裹着需要被降解的胞内物质,最终闭合形成一个双层膜结构的自噬小体.多细胞生物与酵母的自噬过程另一个明显区别是:在酵母细胞中,自噬小体直接与液泡融合降解底物;在高等生物细胞中,自噬小体在与溶酶体融合前,还需要经历一系列的成熟酸化过程.新产生的自噬小体会与一些内吞途径中的成分融合,例如早期内吞体(endosomes)和多泡小体(multivesicular bodies, 简称MVBs)等,从而产生一个混合的结构.这种混合结构被称为中间囊泡(amphisome),较自噬小体更偏酸性.中间囊泡再与溶酶体融合,从而产生具有降解能力的自噬溶酶体[15].
多细胞生物不仅自噬过程高度保守,自噬的分子机制在进化上也高度保守.自1997年发现第一个自噬基因ATG1以来,共发现了大约18个保守的ATG基因构成了细胞自噬的核心分子机制,对自噬小体的形成是必需的(表1).这些基因在拟南芥、果蝇、线虫、小鼠及人中高度保守.多细胞生物自噬过程比酵母中的更复杂,且拥有不同细胞类型,除了拥有高度保守的Atg蛋白外,应该有更多的因子参与或者有更为复杂的分子间互作.其中一种表现方式是同一个酵母Atg蛋白在多细胞生物中会进化出多个同源物,这些同源物也会表现出功能上的冗余和分化.例如线虫中有两个ATG8的同源基因,lgg-1 和lgg-2,在不同的发育时期不同的自噬阶段发挥不同的功能[16];在哺乳动物细胞中至少存在着6个酵母ATG8蛋白的同源物,它们都属于LC3 和 GABARAP/GATE-16家族蛋白[17].
由于多细胞生物的自噬过程比单细胞酵母复杂得多,人们有理由相信,多细胞生物自噬小体的形成与成熟过程中,以及不同的组织细胞中,还存在着众多未知的重要参与基因.尽管已有广泛的生物化学分析方法被应用于发现参与多细胞生物自噬作用的因子,但是这些生化方法鉴定出来的大多是一些自噬活性的调控因子,而非参与自噬过程所必需的新基因.科学家急需寻找到一个适用于遗传筛选的多细胞生物模型来开展自噬新基因的筛选.

表1 酵母ATG蛋白在线虫和哺乳动物细胞中的同源物
4 线虫自噬模型的建立
自1965年Sydney Brenner开始利用线虫进行发育生物学的研究以来,秀丽线虫凭借自身的许多特点,在众多生物学领域得到广泛应用.秀丽线虫作为一个仅有959个体细胞的生物体,它的成虫体长仅1 mm,身体为半透明,以大肠杆菌为食物,它的生殖周期短(仅3 d),后代数量多(约300个),易于在实验室条件下培养.此外,线虫还便于进行多种遗传操作.线虫有2个性别分为雌雄同体和雄性.雌雄同体既能够进行自体受精,也可以利用外源精子繁殖后代.这一特点为研究者对秀丽线虫进行经典遗传学分析提供了极大的便利.目前,科研工作者利用线虫在多个领域取得了重大突破,如细胞凋亡的分子机制、RNA干扰(RNA interference, 简称RNAi)现象的揭示、微RNA(microRNA, 简称miRNA)的发现、衰老等.
线虫胚胎早期发育过程中,一系列不对称分裂将生殖细胞与体细胞分离.比如受精卵第一次分裂成2个细胞AB及P1,AB只分裂形成体细胞,而P1是生殖母细胞(germ blastomere).P1进行不对称分裂形成体细胞EMS及P2生殖母细胞.随后P2分裂成P3、P4生殖母细胞.P4进行对称分裂给出Z2、Z3两个生殖前体细胞.Z2及Z3在胚胎期不再分裂,孵化后分裂形成上千个生殖细胞.20世纪80年代,科学家观察到存在于卵细胞中叫作P颗粒的蛋白/RNA聚合体,在胚胎分裂中只在生殖细胞中,如P1到P4生殖母细胞和Z2、Z3生殖前体细胞中,而在体细胞中不存在.幼虫期P颗粒在生殖细胞中合成,但不存在于精子中.胚胎发育中P颗粒的这种不对称分布机制困扰了发育生物学家多年.张宏实验室利用标记了绿色荧光蛋白的P 颗粒组成性成分之一的PGL-1报告蛋白筛选到P颗粒在体细胞中异常存在的突变体,惊奇地发现自噬基因的突变会引起P颗粒的一些成分包括PGL-1和PGL-3在体细胞中累积,这些聚集体命名为PGL颗粒(图2)[18].野生型线虫胚胎细胞中PGL-1和PGL-3仅在生殖细胞中分布,而在自噬基因lgg-1突变体的胚胎细胞的体细胞中PGL颗粒大量累积[18].进一步分析表明P颗粒随着卵母细胞的分裂也被分配到体细胞中,但位于体细胞中的P颗粒成分PGL-1和PGL-3会被自噬通路降解.这一突破性结果不仅阐明了P颗粒在生殖细胞中特异分布的一种机制,而且揭示自噬可以选择性降解发育过程中的蛋白聚集体[18].
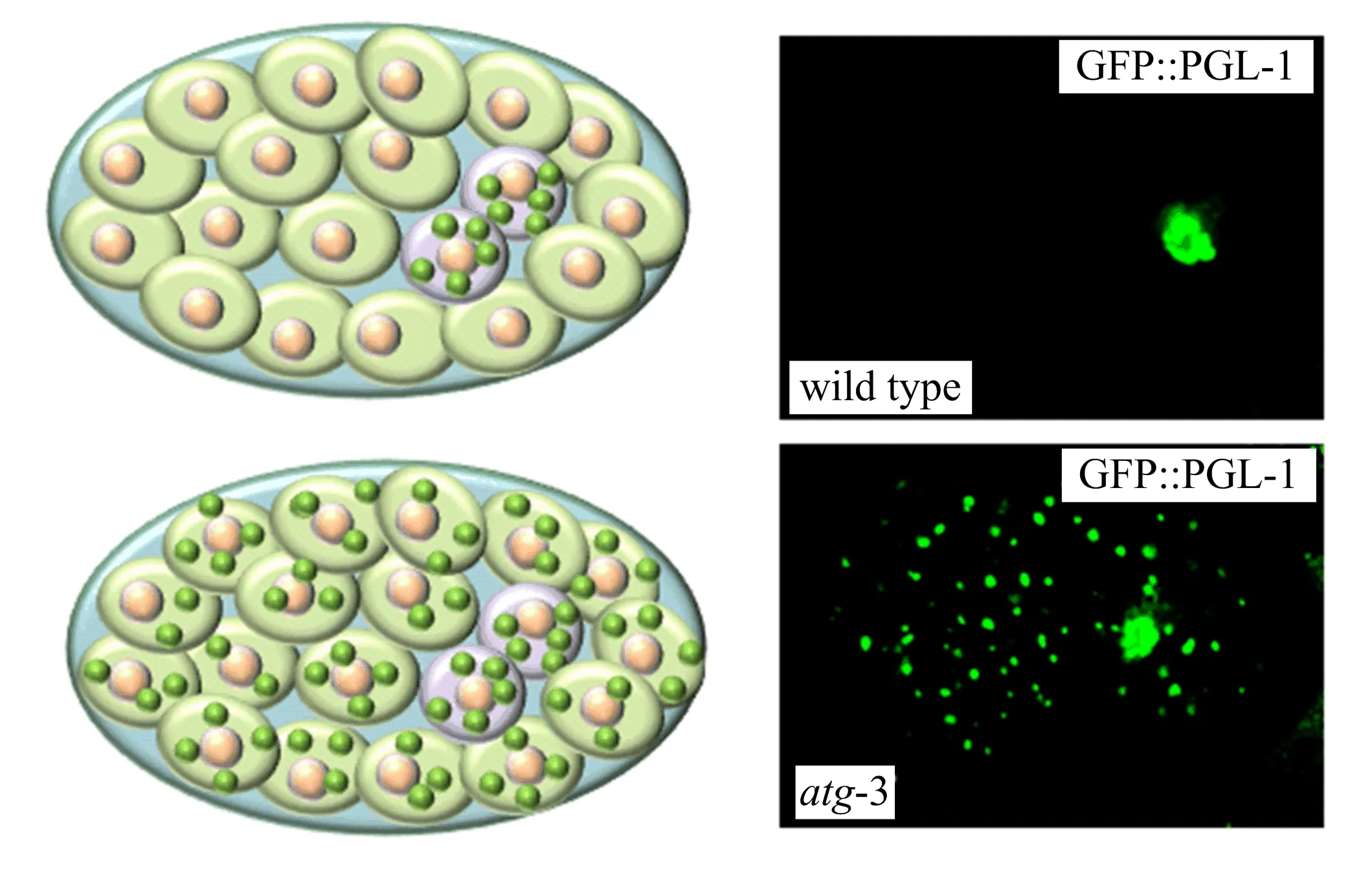
图2 P颗粒组分PGL-1在线虫胚胎中的分布图
5 线虫自噬的研究及自噬的生理意义
5.1 选择性自噬
利用自噬降解PGL颗粒的现象,张宏实验室创立了可用于遗传筛选的多细胞生物自噬研究模型.通过大规模筛选,得到了多个多细胞生物特有的自噬基因,分别命名为epg-1-11(ectopic PGL granules, 简称epg)[19-25].这是继20世纪90年代酵母遗传筛选寻找自噬基因后首次发现的新的自噬基因,这些新基因的鉴定极大地丰富了人们对多细胞生物自噬过程的理解.自噬降解P颗粒成分证明了自噬可以选择性地降解底物,但自噬如何选择性包裹底物的机制仍不清楚.研究人员进一步深入研究筛选到的自噬新基因,发现了多个epg基因在选择性识别和降解蛋白聚集体中发挥重要功能.先前研究表明一类受体蛋白可以同时结合底物以及位于自噬小体内膜的Atg8从而介导底物的识别[26].进一步研究发现在选择性自噬中还需要一类受体支架蛋白.比如EPG-7作为受体支架蛋白,特异性地介导了包括SQST-1(线虫中自噬底物p62的同源蛋白)在内的多种蛋白聚集体的降解.EPG-7可以同时结合降解的底物和多种介导自噬小体形成的ATG蛋白,从而促进包裹底物的自噬小体的形成.支架受体蛋白EPG-7不仅赋予了底物降解的特异性,同时也将底物与自噬机器连接起来,提高了降解的效率[24].此外,工作人员还发现翻译后修饰在蛋白聚集体的降解过程中发挥着重要的作用.比如线虫精氨酸甲基转移酶PRMT-1的同源基因epg-11功能缺失,导致体细胞中PGL颗粒降解缺陷[25].PGL颗粒降解需要与支架蛋白EPG-2直接结合.EPG-11可以对PGL-1和PGL-3的RGG结构域的精氨酸进行甲基化修饰,epg-11基因活性的缺失减弱了PGL颗粒与EPG-2的相互作用,进而减弱了PGL颗粒与LGG-1/ATG8的结合,从而降低了PGL颗粒的降解效率[25].这些研究揭示了选择性自噬的分子机制,并对阐明多种疾病中蛋白聚集体异常累积的机制有重要意义.
5.2 自噬小体形成与成熟
多细胞生物自噬小体的形成与成熟过程与内膜系统紧密联系.从自噬诱导之初的隔离膜形成到自噬小体延伸的膜来源,以及自噬小体闭合后与一系列内吞体和溶酶体的膜融合过程都与内膜系统息息相关.内膜系统尤其是内质网如何参与到自噬过程的各个阶段仍不清楚.电镜下观察发现隔离膜与内质网间存在着广泛的相互作用,但是这种相互作用的形成、维持以及解离的分子机制尚不清楚.
研究发现线虫中鉴定的多细胞生物特有自噬因子EPG-3(哺乳动物中同源蛋白为VMP1)定位于内质网,参与调控隔离膜与内质网的相互作用[27].VMP1缺失会导致隔离膜与内质网的稳定结合,从而阻断自噬小体的正常形成.除了调控隔离膜与内质网互作外,VMP1还可以广泛调节内质网与其他细胞器,如脂滴、线粒体和胞内吞体的相互作用[27].另外广泛介导内质网与其他细胞器互作的ER蛋白VAPA/B也参与隔离膜与内质网的互作[28].自噬被诱导后,VAPA/B通过与在自噬早期发挥功能的Atg1/ULK1蛋白复合体的成分FIP200结合被招募到内质网上的自噬起始欧米茄小体.VAPA/B能够维持FIP200/ULK1复合体的稳定性,也与WIPI2蛋白互作,促进ER-IM 的相互作用.这些工作揭示了ER膜蛋白VMP1和VAPA/B调节自噬小体与ER互作的机制(图3).

图3 ER膜蛋白VMP1和VAPs调节自噬小体与ER互作的模式图
高等生物细胞自噬通路中,自噬小体的成熟过程包括与晚期内吞体的融合.线虫中鉴定的自噬基因EPG5参与调控自噬小体与晚期内吞体/溶酶体之间的特异融合[29].EPG5可以与Rab7及晚期内吞体/溶酶体上的R-SNARE蛋白VAMP7/8直接作用,同时也可以与预组装的Qabc-SNARE复合物STX17-SNAP29结合.EPG5通过结合自噬蛋白LC3/LGG-1(人类和线虫中Atg8的同源蛋白)来识别自噬小体,并促使SNARE复合物STX17-SNAP29-VAMP7/8的组装,从而促进自噬小体与晚期内吞体/溶酶体的融合(图4).EPG5缺失引起自噬小体与多种膜泡结构的错误融合, 从而形成降解功能缺陷的自噬溶酶体.

图4 EPG5调控自噬小体的成熟
5.3 自噬与神经退行性疾病
细胞自噬的功能主要有两个方面:一是在胁迫环境下,自噬可以将一部分胞质降解成氨基酸等,为细胞存活提供能量和物质,这是细胞的一种自我存活机制;另外一方面,自噬可以清除变性或错误折叠的蛋白质、衰老或损伤的细胞器等,进而维持细胞的内稳态.迄今为止,人们对自噬过程的生理功能的了解还很有限.有研究发现,自噬异常与神经退行性疾病的发生密切相关[30].神经退行性疾病主要是由神经元丧失所导致的运动失调、学习认识障碍等.由于神经元是不可再生的,无法通过细胞分裂去除受损的细胞,所以通过自噬途径及时清除胞内有害物质就显得十分重要.在许多神经退行性疾病的受损神经元中发现了自噬小体/自噬溶酶体聚集,如阿尔茨海默症(Alzheimer’s disease, 简称AD)、帕金森病(Parkinson’s disease, 简称PD)、亨廷顿舞蹈病(Huntington disease, 简称HD)、肌萎缩性脊髓侧索硬化症(amyotrophic lateral sclerosis, 简称ALS)等病中都发现了自噬溶酶体聚集,但这些自噬溶酶体的降解功能是缺损的.对自噬的研究将对这些疾病的诊断和治疗提供有利的帮助,参与调控自噬过程的蛋白将可能作为重要的药物靶点.
科学家构建了自噬基因敲除小鼠来研究自噬在神经细胞中的功能.参与自噬小体形成早期的基因Atg5和Atg7敲除小鼠呈现出广泛神经退行性病变,大量神经细胞无选择性地死亡,但未表现出人类神经退行性疾病的选择性神经元丢失这一特征[31-32].近年来,张宏实验室构建了Epg5及Wdr45/Wipi4(epg-6在哺乳动物中的同源基因)缺失的小鼠来研究自噬与神经退行性疾病的关系.Epg5敲除小鼠呈现出进行性神经功能缺陷的表型,随着小鼠年龄的增加,双后肢肌肉萎缩无力,到后期发展成双后肢完全瘫痪[33].Epg5敲除小鼠大脑皮层第五层的和脊髓前角的大椎体细胞选择性地缺失.Epg5基因敲除小鼠由于自噬异常,自噬底物p62在大脑和脊髓中的神经元和神经胶质细胞内异常聚集.中枢神经系统中累积了大量异常的自噬体结构.Epg5基因敲除小鼠表现出选择性运动神经元丢失,进行性肌无力和肌肉萎缩,呈现出肌萎缩性脊髓侧索硬化症(ALS)的主要特征.人类遗传学研究发现人类EPG5基因的隐性突变会引起一种叫Vici syndrome的多系统紊乱综合症[34],Epg5基因敲除小鼠表现出了Vici综合症症状的一些表型,Epg5在自噬通路中分子机制的研究对阐明Vici综合症的发病过程有重要作用.
近期人类遗传学表明WDR45/EPG6突变会导致大脑认知功能的缺陷,引发儿童期静态性脑病伴成年期神经退行性疾病(static encephalopathy of childhood with neurodegeneration in adulthood, 简称SENDA)[35].SENDA是伴随铁聚积的神经退行性疾病(neurodegeneration with brain iron accumulation, 简称NBIA)的一种亚型.SENDA的临床特征为患者幼年时期出现静态性脑病,成年后突发肌张力障碍-帕金森氏症及痴呆.SENDA患者样品检测显示自噬活性明显降低,早期异常自噬结构累积,提示WDR45通过影响细胞自噬调控神经稳态[35].神经系统特异性Wdr45敲除小鼠(Nes-Wdr45fl/Y)会出现运动协调性降低,并且学习记忆功能严重受损[36].组织学分析发现Wdr45敲除小鼠脑内出现严重轴突水肿,并伴有大量嗜酸性小体累积.Wdr45敲除小鼠中自噬通路受到抑制,在神经元和肿胀的轴突中自噬底物p62明显累积.因此Wdr45敲除小鼠出现与SENDA患者类似的表型,包括认知障碍和轴突稳态失衡.这一结果有助于人们进一步了解SENDA的发病机制,并为深入研究自噬在维持轴突稳态中的作用提供了线索.综上,小鼠疾病模型的建立有助于人们了解相关疾病的发病机制,对理解疾病的发病过程以及开展药物筛选有重要的意义.
6 结束语
细胞自噬是维持细胞稳态平衡的重要机制.经过对细胞自噬半个世纪之久的研究,人们对单细胞酵母的自噬机制有了较为深入的了解,但是对更加复杂的高等生物的自噬过程却知之甚少,尤其是自噬与人类相关疾病的研究更是鲜有突破.在自噬分子机制和调控机理的研究中仍然有很多问题和挑战,例如:自噬小体起始成核及自噬小体膜扩张过程的膜来源于何处;高等动物中不同种类的细胞、组织和器官中自噬过程有何异同;生物体的发育过程中如何感知不同的内外部信号来调控自噬的活性.科学家们正在努力开展这些领域的研究,揭示高等生物自噬过程的分子机制,阐明细胞自噬的生理功能以及其在疾病中的作用机制.这些研究将为人类相关疾病的诊疗提供理论依据.

