肾上腺出血的诊断与治疗
——附17例报告
倪安,郭波,周林昌
云南省楚雄州人民医院泌尿外科,云南楚雄 675000
肾上腺出血(Adrenal hemorrhage AH)临床少见,症状不典型,易发生误诊、漏诊。该院2000年3月—2017年10月共收治此病患者17例。现对临床资料作回顾性分析,就其诊断和治疗进行探讨,现报道如下。
1 资料与方法
1.1 一般资料
该研究已通过医院伦理委员会批准,共有病例17例,皆签署知情同意书,其中男10例、女7例,年龄2 d~82岁,左侧6例、右侧10例、双侧1例,血肿直径2~13 cm。其中有明确外伤病史5例,分别为:车祸颅脑外伤1例,车祸腹部外伤(脾破裂)1例,高空坠落多发骨折2例,墙垮塌全身多处受伤1例。无外伤史12例,无外伤史中诊断为肾上腺肿瘤并出血6例,诊断为新生儿缺血性脑病1例,诊断为新生儿黄疸1例,诊断为高血压和肾衰竭透析肝素化后各1例,另两例无明确原因,成人病例中以患侧腰腹部疼痛为主要症状7例,伴发热3例,高血压4例,血压最高达170/100 mmHg,外伤病例中肾上腺出血血肿直径2~4 cm,非外伤病例血肿直径2~13 cm,合并肾上腺肿瘤病例肿瘤直径肿瘤直径3~9 cm。
实验室检查低钾2例,低钠、低氯2例,血糖升高3例。14例行肾上腺功能测定,1例血儿茶酚胺、尿VMA升高。17-羟皮质类固醇、17-酮类固醇、血皮质醇、血醛固酮均在正常范围。彩超检查11例,诊断肾上腺区囊性包块4例,混合回声包块7例。增强CT检查12例,均提示肾上腺出血。MRI检查3例,T2加权为低信号,T1加权为等信号,显示肾上腺区不均匀肿物。
1.2 治疗方法
所有患者均先选择非手术治疗,采用止血、抗感染、补液、输血等手段并配合治疗相关疾病。3个月后复查仍有肾上腺包块存在的采用手术方法切除,术前结合肾上腺功能测定确诊为嗜络细胞瘤1例,所有手术患者术前均按嗜络细胞瘤准备,行经腹开放手术切除。
2 结果
非手术患者11例3个月复查血肿均消失。手术患者6例术后1个月复查肾上腺包块消失。所有患者复查肾上腺功能测定均在正常范围。随诊2个月~1年,无肾上腺皮质功能低下表现,无肾上腺出血再发。
3 讨论
肾上腺出血可分为单侧出血 (Unilateral adrenal hemorrhageUAH)和双侧出血 (Bilateraladrenal hemorrhage BAH),临床症状不典型,出血量较少或肾上腺功能正常时多无临床表现,出血量较大时可表现为急性腰腹部疼痛,伴贫血、发热。肾上腺功能异常时追问病史可发现高血压、头痛、满月脸、水牛背等肾上腺肿瘤表现。双侧出血时可出现肾上腺功能不全表现,症状较重[1],可表现为腰腹部疼痛、休克、昏迷、贫血、发热、高血钾、低钠等。因其临床表现多样,缺乏特异性,因此对于肾上腺出血的诊断较为困难[2]。
肾上腺出血的发病机制不明,动、静脉均可导致出血,静脉出血更常见。其发生原因可能与应激、抗凝治疗[3]、败血症、分娩、高血压、肾上腺原发或转移性肿瘤有关,而创伤性肾上腺出血的原因,主要有交通事故、高处坠落创伤、创伤后感染及外科手术等[4]。
解剖上来看,肾上腺质脆,血供丰富。动脉由膈下动脉发出的肾上腺上动脉、腹主动脉发出的肾上腺中动脉和肾动脉发出的肾上腺下动脉相互吻合供血。但静脉仅有一条,为肾上腺中央静脉,右侧静脉汇入下腔静脉,较短,左侧静脉汇入左肾静脉,较长。该静脉肌层纤维束能产生较大的血流阻力,因此,任何导致肾上腺静脉压力增高的因素,都可能使血管破裂出血[5]。外伤发生时下腔静脉压力突然升高,先影响右侧肾上腺静脉,所以右侧肾上腺出血发生率较左侧高[6]。该组病例右侧10例,左侧6例,与高新营等[7]报道2例均为右侧、李强等[8]之报道右侧35例,左侧1例吻合。
病理生理上看,儿茶酚胺可导致强烈的血管收缩,是肾上腺中央静脉因压力骤增而破裂出血的重要因素,而肾上腺中央静脉恰好是体内儿茶酚胺浓度最高的地方。人体应激状态下,如外伤、心衰、感染时,所分泌的肾上腺激素更明显升高。同时有资料显示,抗凝治疗时使用肝素与双侧肾上腺出血的发生呈显著正相关,肝素使用6 d以上,双侧肾上腺出血的发生率可增加17倍。该组病例中,透析患者发病前两个月时,透析过程中曾出现左侧腰腹部疼痛病史,但未行相关检查,此次为透析后2 h出现同侧腰痛症状,经检查诊断为单侧肾上腺出血。
新生儿时,肾上腺体积相对较大,约为肾脏体积的1/3(成人肾上腺约为肾脏体积的1/30),右侧容易受肝脏、脊柱的压迫,难产时出现产伤,加上围产期窒息缺氧、败血症、凝血机制障碍、维生素K缺乏等因素导致肾上腺出血比率较成年人高,且多为单侧。该组2例新生儿发病,黄疸患儿血液检查直接胆红素正常,总胆红素及间接胆红素值升高,分别为178~389 μmol/L 和 169~383 μmol/L。有报道称肾上腺出血可经腹膜后间隙向下扩散,并通过腹股沟管进入阴囊形成阴囊血肿,但无需手术干预,该组未发现此症状。
肾上腺出血的转归根据影像学表现分为三期[9]。急性期:出血1周内,CT值高,可高于50 HU,增强扫描血肿无强化,彩超呈强回声,MRI T1加权像表现为高信号强度均匀,T2加权像均表现为低强度信号。稳定期:出血2~3周,CT值降低,但仍高于30HU,彩超回声减弱,且边缘高于内部,MRI的T1 T2加权像均表现为高信强度号。吸收期:出血1~3个月,出血范围逐渐缩小,甚至消失,可出现肾上腺区钙化灶,但双侧肾上腺出血可发生肾上腺萎缩。目前肾上腺出血的发病率逐渐上升,有报道称此为高分辨率检查手段普遍使用的结果,特别是增强CT检查的诊断率可高达99%,部分肾上腺肿瘤合并出血的情况,注射非离子碘造影剂后可有效区分肿块及周边的出血灶,MRI增强时也可达到同样的效果。
肾上腺出血的治疗,一般认为,血肿小于5 cm的单侧出血可定期观察,大于5 cm的单侧出血或双侧出血可采取手术治疗[10],手术应在清除血肿的同时尽量保留肾上腺组织[11]。当双侧肾上腺出血时,可预防性使用氢化可的松行激素替代治疗,具体方法为氢化可的松 5~25 mg/(kg·d),应激状态下可适当加量。 若发生肾上腺危象时应积极抢救,除使用激素外,还应大量补充盐水,前2 d每天补充约2 500 mL,同时补充葡萄糖以控制低血糖,并积极纠正休克、酸中毒及对症治疗。除保守治疗外,有报道称介入治疗效果良好。该组资料中血肿最大13 cm,均先行保守治疗,仅有合并肾上腺肿瘤患者3个月后行肾上腺肿瘤切除术,术后均恢复良好,避免了不必要的手术创伤。该组肾上腺肿瘤切除的病例中仅有1例术前确诊为嗜络细胞瘤,术后又诊断为嗜络细胞瘤2例。有报道称未进行充分术前准备的嗜络细胞瘤患者手术死亡率可高达40%以上。所以对于肾上腺肿瘤的手术,除非术前已经可以明确排外嗜络细胞瘤的病例,术前均常规按照嗜络细胞瘤进行准备。手术方式的选择上,目前肾上腺肿瘤手术以腹腔镜为主,而肿瘤直径大于10 cm或与周围组织粘连者多选择开放手术[12]。该组行手术治疗的6例患者中,肿瘤直径3~9 cm,均采用经腹部开放手术切除,术中可见肿瘤周围有明显粘连。对于肿瘤较大者,腹腔镜手术技术提高的前提下,选择经腹腔途径腹腔镜手术是可行的,但选择经腹膜后途径应慎重。
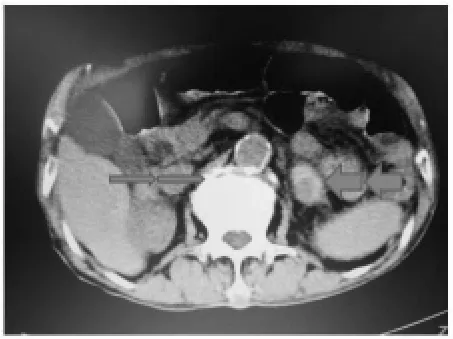
图1 CT细箭头 右侧肾上腺肿瘤 粗箭头 左侧肾上腺肿瘤并出血
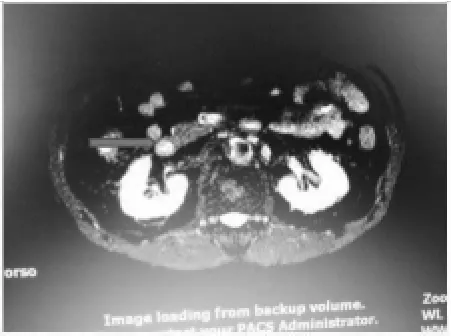
图2 MRI箭头为右侧肾上腺肿瘤并出血
综上所述,肾上腺出血的症状虽然多样,但增强CT及MRI检查可大大提高确诊率,我们结合肾上腺功能评估的非手术治疗病例均取得了良好疗效,但是否适用于所有患者仍有待于进一步观察。

