维生素K1化学合成的研究进展
徐胜辉,胡建良,李志江,黄旺生,李贵洲,俞传明
(杭州格林生物科技股份有限公司,浙江 建德 311604)
0 前言
20世纪30年代,Almquist和 Stokstad报道[1]用苜蓿的乙醚提取物可治愈出血症。随后从苜蓿中分离得到一种黄色油状物,鉴定为2-甲基-3-植基-1,4-萘醌并命名为维生素K1。维生素K1是一种天然产物,在许多植物中的含量较为丰富,因此维生素K1又名叶绿醌。
维生素K1是人体中不可缺少的重要维生素之一。人类可从食物中获取,还可由人体肠道中的大肠杆菌合成并被吸收利用,因此在一般情况下正常人不会发生维生素K1缺乏。维生素K1被称为抗出血维生素,但是随着研究的深入,维生素K1也被人们广泛应用在畜牧业,饲料[2]等领域。
1 化学合成维生素K1路线简介
1.1 Friedel-Crafts烷基化合成法
Friedel-Crafts烷基化合成法是早期合成维生素K1的一种思路。Fieser合成法[1]采用甲萘氢醌1同天然植物醇2在二噁烷溶剂中,以草酸作为催化剂进行F-C反应,然后碱化水洗除去多余的1,接着将有机相用氧化银氧化,得到维生素K1,产率约30%。而Isler[3]是将Fieser合成法中的天然植物醇替换成异植物醇3,其发现三氟化硼乙醚与草酸相比为更好的催化剂。不足的是文中并未对其产率进行报道(Scheme 1)。
该方法操作简单,但是产率太低,选择性不好,限制了其在工业上的应用。由于该F-C烷基化反应选择性差,对甲萘氢醌的2位和3位的取代无选择性,因此会有异构体5的形成。此外,由于在酸性环境下,侧链双键会有部分发生异构化,因此会得到无活性 (Z)双氢维生素K16和共轭二烯 8的产生,这对于后续的产物分离也将是巨大的挑战。另外还有副产物环合的“色满醇”7 产生(Scheme 2)。
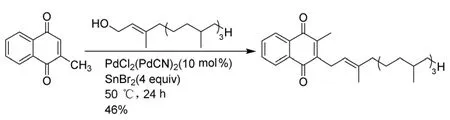
日本研究人员首次报道用甲萘醌与天然植物醇为原料,在金属Pd的作用下实现甲萘醌2位的Friedel-Crafts烷基化,但是整体产率不高,且成本较高[4](Scheme 3)。
由于前人报道F-C合成法多数用到了金属氧化剂[5-8],但是甲萘氢醌1在金属氧化剂条件下非常容易被氧化,不稳定,会带来很多副产物,于是2016年台湾祥翊制药有限公司另辟蹊径,开发一条非金属氧化途径来合成维生素K1[9],具体路线如下 (Scheme 4)。

Scheme 1

Scheme 2
Scheme 3

Scheme 4
该路线首先将甲萘醌9氢化酯化成2-甲基-1,4-萘氢醌二烷基酯10,然后单边水解得到2-甲基-1,4-萘氢醌单烷基酯11,之后化合物11与植物醇发生F-C反应,以较低的产率得到化合物12,化合物12在Na2S2O4氧化作用下得到中等产率的维生素K1。但是Na2S2O4具有自燃性和爆炸性。因此该方法具有很大的安全隐患,并不适合于工业化生产。
1.2 Dötz合成法[10]
Dötz 合成法,首先 Cr(CO)6在苯基锂 13 和三甲氧 四氟化硼14作用下,得到不稳定的关键中间体铬合物15,该中间体在约50℃条件下非常容易失去一份子CO,进而被一分子乙炔物16所亲核进攻,形成不稳定中间体17,随后转化成氢醌单甲基醚三羰基铬络合物18,用常规的氧化剂可以直接将其转化成维生素K1,但是18也可以先与CO作用,得到萘氢醌衍生物19,并回收Cr(CO)6供循环使用,这不仅降低生产成本,也减轻环保压力。随后19经氧化得维生素K1,收率为70%~80% (Scheme 5)。

Scheme 5
在这一合成方法中,由于炔16的反式构型是定量保持的,因此整个过程没有不稳定的中间体烯丙基正离子形成,因而可以保证整个侧链的全反式构型。但是制备关键中间体需要昂贵的Cr(CO)6。 此外苯基锂高度易燃,反应后处理可能较为麻烦,工业生产环保压力大。
1.3 一锅合成法[11]
台湾研究人员在1995年报道了一锅法合成维生素K1的方法,过程如下(Scheme 6)。

Scheme 6
在-78℃条件下,正丁基锂加入到烯丙基苯基砜20的四氢呋喃溶液中,在此温度下滴加植基溴21,滴加完毕后将反应体系升到0℃,加入t-BuOK-t-BuOH溶液,再次升到室温下反应得到烯砜22。接着在-78℃下往反应液中滴加六甲基二硅叠氮化钠(NaHMDS)的四氢呋喃溶液,保温反应20 min后加入23,升温到10℃反应完后,得到维生素K1。
该方法产率一般,得到的产品纯度很高。由于该反应对温度要求极其苛刻,能耗大,试剂难求,成本高等缺点而限制了该方法的广泛应用。
1.4 侧链延长法[12]
这是一条由Jae-Hong Min等人在2003年提出的合成路线(Scheme 7),不同于以往直接一步合成整条侧链的方法,该思路是通过两步合成整个侧链,虽然可以保证侧链的全反式构型,不足之处是过程较为繁琐,产率中等,而且在最后脱除砜基的过程会发生双键的迁移。

Scheme 7
1.5 甲萘醌-环戊二烯合成法

Scheme 8
根据欧洲专利[13]和 Ji等人[14]的详细报道,甲萘醌33同环戊二烯在室温下发生Diels-Alder反应,得到加合物环甲醌34,收率93%。甲萘醌由于其醌羰基α位的非酸性烯属的氢转化成环甲醌酮基α位氢,可以被碱拔去质子,形成碳负离子,从而容易进攻植基卤素32,发生SN2反应,得到烷基化产物35,产物35根据美国专利[15]报道其对热不稳定,用甲苯作溶剂加热到70℃~120℃,极易发生逆Diels-Alder反应,可以定量转化成维生素K1。但是也有其他文献报道[16],其对逆Diels-Alder反应在不同溶剂中的反应速率常数做了计算,发现采用冰醋酸作溶剂时逆Diels-Alder反应速率常数最大。
总体来看,该方法操作简单,仅有四步,而且每一步产率都很高。在烷基化反应中使用的强碱如:氨基钠、氨基钾或叔丁醇钾,常用叔丁醇钾,价格便宜,使用也很安全。烷基化反应过程中有少量O-烷基化物形成,但是在后处理过程中,可以被HCl水溶液所断裂而除去。由于该反应是在碱性条件下进行,所以不至于引起侧链构型的改变,因而可以得到高纯度的维生素K1。烷基化反应快结束时,整个反应最初的血红色渐渐退去,因此这非常有利于判断反应是否结束。
2 讨论与展望
维生素K1的合成方法一直被人们关注,而反式构型双键是维生素K1活性所必须的。综合上述文献报道,经济可靠的合成路线必须满足以下条件。
(1)原料易得,试剂廉价;
(2)进行烷基化反应时产率高,不需要过量的植基侧链;
(3)整个反应过程可以维持侧链的反式构型稳定;
(4)副产物量不能太多,不干扰主产物的分离。
从上述文献分析可以看出,不同合成方法各有优劣。Friedel-Crafts烷基化合成法是早期合成维生素K1思路,对于开拓化学合成维生素K1具有重要意义,但是由于其产率太低,限制其工业化应用。Dötz合成法成本太高,而且整体产率不高。一锅法虽然选择性很好,但是反应条件太过于苛刻,试剂昂贵,应用于工业生产价值不大。侧链延长法在最后一步脱砜基时,不能维持侧链的稳定性,所以很难达到药典要求。甲萘醌-环戊二烯合成法是目前来说比较好的合成方法,其操作简单,收率高,环戊二烯可以考虑循环套用,不需要使用外来试剂和重金属,但是后续产物分离纯化难度较大,这是目前急需解决的问题。

