川陈皮素对糖尿病大鼠认知功能障碍的影响
张红蕊 王耕银 崔昌萌 黄 蕊 刘春梅 赵轶群 高晓红 李春霞 李 伟 郑 佳
(唐山市人民医院,河北 唐山 063000)
糖尿病认知功能障碍(DMCI)严重影响患者生活质量,很多学者认为发病机制与氧化应激、海马神经元凋亡有关。目前认为核因子E2相关因子(Nrf)2-抗氧化反应元件(ARE)信号通路与DMCI有关,其抗氧化应激作用是研究的热点。γ-谷氨酰半胱氨酸合成酶(GCS)是该通路激活后大量产生的抗氧化蛋白,是谷胱苷肽(GSH)合成的关键限速酶之一,由调节活力、催化活力两部分亚单位组成。γ-GCS的含量活性改变可以直接影响GSH合成,转录表达水平升高时增强细胞的抗氧化应激能力,保护中枢神经。血红素氧合酶(HO)-1,也是Nrf2通路中重要的抗氧化蛋白酶。Caspase-12即凋亡因子半胱氨酸天冬氨酸酶12,是内质网应激(ERS)诱导凋亡的关键分子,表达量的变化可以反映ERS的活性,川陈皮素(NOB)主要提取于中药陈皮中,同槲皮素共属多甲氧基黄酮类化合物,在抗炎、抗氧化、营养神经、肝保护〔1〕等方面有重要作用。本研究旨在探讨NOB对糖尿病大鼠海马γ-GCS、HO-1、Caspase-12表达水平的影响。
1 材料与方法
1.1实验材料 12周龄健康雄性Sprague-Dawley(SD)大鼠,清洁级,40只,体重(300±20)g,由华北理工大学动物实验中心提供。按照华北理工大学动物实验伦理委员会有关条例进行实验操作。主要药物及试剂:NOB(陕西慧科生物科技有限公司)、链脲佐菌素(STZ,Sigma公司)、β-actin抗体(北京中杉金桥)、兔抗γ-GCS、HO-1、Caspase-12多克隆抗体(美国 KPL公司)、抗体稀释液(碧云天生物科技研究所)、十二烷基硫酸钠(SDS)凝胶试剂盒(碧云天生物科技研究所)、聚氰基丙烯酸正丁酯(BCA)蛋白浓度测定试剂盒(北京艾德莱生物科技有限公司)、SDS-聚丙烯酰胺凝胶(PAGE)电泳液粉剂(碧云天生物科技研究所)等。仪器设备:Morris水迷宫及分析软件(中国医学科学院药物研究所研发)、体重秤、高速低温离心机、电泳转移槽和垂直电泳仪(北京六一仪器厂)、温控摇床(XMOOOLDR-MLM)(北京中西远大)、凝胶成像分析系统(FluorChen 5500)(美国Thermo)。
1.2建立模型 大鼠适应性喂养2 w。禁食不禁水16 h后,随机选取32只大鼠单次腹腔注射1%STZ(60 mg/kg)溶液〔由0.1 mol/L的枸橼酸缓冲液(pH4.4)配制,浓度为10 g/L〕,72 h后用血糖仪检测大鼠尾血非空腹血糖,两次血糖值均>16.67 mmol/L者视为造模成功,进入实验,余8只大鼠设为正常对照组,予等剂量缓冲液腹腔注射。
1.3分组及给药 将造模成功的32只糖尿病大鼠,按照随机数字表法分组:糖尿病组(n=8),NOB高剂量组(n=6)、中剂量组(n=6)和低剂量组(n=6),α-硫辛酸组(阳性对照组,n=6)。另8只大鼠设为正常对照组。选用NOB干预,按10 mg/kg,20 mg/kg 30 mg/kg剂量,分别予低、中、高三剂量组每日腹腔注射。阳性对照组每日予腹腔注射α-硫辛酸60 mg/kg。正常对照组、糖尿病模型组均予每日腹腔注射等量生理盐水。以上6组均每日给药1次,连续8 w。实验期间动物自由进食水,常规饲料喂养。
1.4Morris水迷宫实验 22周龄时,行Morris水迷宫行为学实验(由固定人员完成,并不了解大鼠具体分组情况)。(1)定位航行实验:在隔音及人工照明环境下,一共进行5 d的测试,每天记录大鼠的成绩。池水每天更换,约30 cm深,21~24℃水温。圆形水池高50 cm,直径214 cm,深30 cm,温度约20℃,用4个标记点把水池分为4个象限,选一象限放置圆形平台。大鼠面对池壁下水,记录其爬到平台时间。如果120 s内未到站台,则120 s为潜逃潜伏期。轮换进行,记录成绩。(2)空间探索实验:实验第6天时把平台撤走,记录120 s内大鼠在目标象限停留的时间。
1.5灌注取材 水迷宫实验结束后大鼠空腹过夜8 h。之后每组随机选取4只大鼠进行心脏灌注,予10%水合氯醛(3.0 ml/kg) 行腹腔注射麻醉,开胸暴露心脏,行左心室插管,同时将右心耳剪开,用生理盐水灌注,至眼球肝脏变白时,以4%中性多聚甲醛灌注固定,快速将脑组织完整取出,并迅速分离海马组织,装到冻存管,用液氮冷冻后,放置于-80℃冰箱储存。
1.6Western印迹检测 (1)制备蛋白样品,将RIPA裂解液加到各组样本中,充分裂解后,离心并取出上清。按照BCA法对蛋白浓度测定。(2)SDS-PAGE电泳:加好蛋白样品后,恒压电泳直到溴酚蓝到凝胶底部时。(3)蛋白质转膜:通过半干转法把蛋白转移到硝酸纤维膜上。(4)封闭:取出膜后,封闭在3%牛血清白蛋白(BSA)-Tris-Hcl缓冲液(TBST)中,放在摇床上60 min。(5)孵育一抗:将1∶1 000稀释的一抗加入,4℃摇床上过夜。TBST漂洗。(6)孵育二抗:将稀释的二抗加入,室温条件下摇床上育60 min,TBST漂洗。(7)蛋白检测:膜上加增强化学发光(ECL)反应5 min。曝光胶片,显影、定影。用凝胶成像分析系统分析条带。
1.7统计学方法 应用SPSS17.0软件行方差分析和LSD-t检验。
2 结 果
2.1定位航行实验结果 在5 d的测试中,各组潜逃潜伏期均呈下降趋势。第2天开始,与正常对照组相比,糖尿病组逃避潜伏期明显延长(P<0.01),提示STZ诱导糖尿病大鼠学习记忆能力显著下降。从第3天开始,与糖尿病组比较,NOB各剂量组、阳性对照组潜逃潜伏期明显缩短(P<0.05,P<0.01),以高、中剂量组变化更显著(P<0.01),且高剂量与中剂量组间差异无统计学意义(P>0.05)。见表1。
2.2空间探索实验 与正常对照组相比,糖尿病组目标象限停留的时间显著缩短(P<0.01);与糖尿病组相比,NOB各剂量组、阳性对照组目标象限停留时间均延长(P<0.05,P<0.01),以中、高剂量组更为显著(P<0.01),但未恢复正常,且高剂量与中剂量组间差异无统计学意义(P>0.05)。表明川陈皮素可以缓解记忆能力的损伤。见表1。
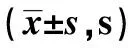
表1 各组Morris水迷宫实验中潜逃潜伏期、目标象限停留时间比较
与正常对照组比较:1)P<0.01;与糖尿病组比较:2)P<0.05,3)P<0.01,下表同
2.3Western印迹检测结果 正常对照组海马CA1区γ-GCS、HO-1、Caspase-12低水平表达。糖尿病组海马CA1区γ-GCS、HO-1、Caspase-12表达水平较正常对照组明显增加(P<0.01)。与糖尿病组比较,NOB各剂量组、阳性对照组海马CA1区γ-GCS、HO-1表达明显升高(P<0.05,P<0.01),而Caspase-12表达均有所下降(P<0.05,P<0.01),以NOB中、高剂量组变化最显著(P<0.01),但高剂量与中剂量组间差异无统计学意义(P>0.05)。见图1、表2。

图1 各组海马CA1区γ-GCS、HO-1、Caspase-12表达

表2 各组海马CA1区γ-GCS、HO-1、Caspase-12的表达
3 讨 论
海马结构与学习记忆能力密切相关,研究认为DMCI时海马结构功能受损。高血糖可透过血脑屏障损害神经元而降低患者学习、推理、记忆等能力。自由基氧化应激损伤学说及ERS诱导凋亡是近年来研究的热点〔2〕,认为二者均与DMCI有关。
正常情况下GSH和80%的γ-GCS结合使细胞失活,在GSH减少时与其结合的γGCS释放就会增加,γ-GCS的水平随之升高。有报道〔3〕Nrf2-ARE信号通路激活可以减少GSH的消耗、神经兴奋性毒素等对神经元的损害,增加神经元的能量、氧化还原电位抑制性神经递质信号和代谢过程,起到保护中枢神经的作用。Nrf2是抗氧化应激反应中重要的转录因子,ARE与其相互作用,调节下游抗氧化蛋白的表达〔4〕,在减轻细胞损伤中具有重要的作用〔5〕,对糖尿病氧化应激脑损伤起到保护作用。莱菔硫烷可激活Nrf2-ARE抗氧化通路,上调下游的Ⅱ相酶如HO-1等的表达,清除自由基,减少脑皮质细胞凋亡及保护血-脑脊液屏障〔6〕。外源性或内源性应激激活Nrf2后,可以上调γ-GCS、HO-1表达水平。
内质网容易受机体内环境的影响,氧化应激即可破坏内质网的稳态,导致未折叠蛋白的聚集或者错误折叠,从而引发未折叠蛋白反应。此反应一定程度上有保护作用,但是过度时将通过ERS导致相关性细胞凋亡。Caspase-12是ERS通路中一种重要的调控蛋白,位于内质网膜上。其表达水平在脑缺血再灌注损伤后明显升高。高糖可使ERS反应激活,活化的Caspase-12可激活Caspase-3、Caspase-9引起细胞凋亡。NOB有抗炎、抗氧化〔7〕、抗癌、抗血小板聚集、抗动脉粥样硬化〔8〕等作用。有报道〔9〕黄酮类化合物甘草黄酮也可以增强糖尿病大鼠抗氧化能力,降低丙二醛(MDA)水平,可推断NOB在糖尿病大鼠DMCI中可具有此作用;枳实、陈皮含有NOB、桔皮素活性成分,对缺血性脑卒中有一定的预防作用;研究〔10〕提出,NOB可以减轻大鼠脑缺血后脑水肿、神经功能受损而保护中枢神经;NOB可改善阿尔茨海默病大鼠的认知功能,有效改善脑缺血导致的认知功能下降。
本实验结果显示,正常对照组大鼠海马神经元中有少量的γ-GCS、HO-1、Caspase-12的表达,考虑为生理状况下的表达量。糖尿病大鼠出现严重的认知功能障碍,学习记忆能力损伤严重,表现为大鼠潜逃潜伏期延长、在空间探索实验中目标象限停留时间缩短,海马CA1区γ-GCS、HO-1、Caspase-12表达量较正常组升高,一方面考虑是大鼠高血糖透过血脑屏障,导致氧化应激增强产生大量有毒物质从而损伤了海马神经元;另一方面是高糖致ERS诱导海马神经元的凋亡,活化的Caspase-12表达水平上升进一步激活其他凋亡因子的表达而损害神经元。这种情况下,机体启动Nrf2-ARE通路,转录因子Nrf2活性增强、表达增多,通过与ARE作用,增加γ-GCS、HO-1等表达,抵御氧化应激对神经元的损害。NOB治疗大鼠认知功能改善,γ-GCS、HO-1表达量升高,NOB可能会使γ-GCS、HO-1表达增多而增强组织细胞抗氧化能力,保护海马神经元;Caspase-12表达水平下降,表明NOB可以抑制海马细胞凋亡,减轻认知功能损伤,机制可能与过度的未折叠蛋白反应中下调Caspase-12表达量等有关。将来可细化NOB的药物作用浓度,更深入地探讨NOB对DMCI的作用强度的曲线变化。
综上,NOB对改善糖尿病大鼠认知功能障碍有较好的作用,表明NOB可以保护海马神经元,机制可能与Nrf2-ARE信号通路激活导致γ-GCS、HO-1等抗氧化应激因子大量表达及抵抗在过度的未折叠蛋白反应中Caspase-12途径所致的细胞凋亡相关。

