利拉鲁肽对糖尿病大鼠肾组织炎症因子表达的影响
江思瑜 梁 婵 李蒙蒙 李雅靖 孙 霓 吴晓光
(承德医学院基础医学院,河北 承德 067000)
糖尿病肾病(DN)是以肾小球硬化伴尿蛋白含量超过正常水平为特点的慢性病,是糖尿病各类并发症中危害性最大的一类疾病〔1〕。至今对于其发病机制尚无准确定论,研究认为DN的发生发展与遗传变异、糖代谢紊乱、肾脏血流动力学的改变、氧化应激反应等因素有关〔2〕,但最新研究表明〔3〕,炎症机制也是DN的发病原因之一,其中Toll样受体(TLR)4/髓样细胞分化因子(MyD)88信号转导通路扮演了极其重要的作用。利拉鲁肽作为胰高糖素样肽的类似物可通过调节胰岛素的分泌产生降糖作用〔4〕,但其抗炎机制不甚明了。本文拟分析利拉鲁肽对糖尿病大鼠肾组织TLR4/MyD88通路表达的影响。
1 材料与方法
1.1材料 健康SD雄性大鼠68只,体重230~250 g,购于北京市维通利华公司。链脲佐菌素(STZ)购于Sigma公司。利拉鲁肽针剂购于丹麦诺和诺德公司。磷酸盐缓冲液(PBS)、TLR4抗体、MyD88抗体、即用型SABC试剂盒、二氨基联苯胺(DAB)显色试剂盒、核因子(NF)-κB试剂盒、肿瘤坏死因子(TNF)-α试剂盒、白细胞介素(IL)-6试剂盒均购于武汉博士德生物工程有限公司。其他试剂均为国产分析纯。
1.2实验分组及给药 将68只SD雄性大鼠随机分为正常对照组、模型组、利拉鲁肽组、二甲双胍组,每组17只。正常对照组给予常规饲料喂养;模型组、利拉鲁肽组、二甲双胍组给予高脂高糖饲料喂养,STZ经缓冲液稀释后按30 mg/kg一次性注射至大鼠腹腔,48~72 h后于大鼠尾静脉取血,以连续3 d所测平均血糖≥16.7 mmol/L且尿糖>()为DN大鼠建模成功。模型建立成功后,利拉鲁肽组按0.12 mg·kg-1·d-1皮下注射给药,二甲双胍组按140 mg·kg-1·d-1灌胃给药,正常对照组及模型组均给予等量溶媒,实验期间各组大鼠均无降糖干预,连续给药8 w。
1.3生化指标检测 饲养大鼠8 w后收集大鼠尿液与血液标本。最后一次给药前24 h,将大鼠放入代谢笼,收集24 h总尿液量,测量尿糖含量后,以1∶100的体积加甲苯防腐剂,充分混匀后,300 r/min离心取上清液,测大鼠24 h尿蛋白含量、24 h尿糖。大鼠3.5%戊巴比妥麻醉,股静脉插管,收集大鼠血液,4℃ 300 r/min离心取上清液分装,-80℃冰箱存储,检测大鼠尿素氮、血糖、血肌酐。
1.4大鼠肾组织病理观察 大鼠左心室插管,剪开右心耳,在120 mmHg压力下注入4℃生理盐水,至肾脏颜色由红转苍白色。剥离身表面包膜,结扎左肾动脉后,摘取左肾,液氮保存。再以4%多聚甲醛溶液灌注大鼠,取右肾组织,梯度酒精,行石蜡包埋,石蜡切片机制作5 μm切片,依次脱蜡、浸水、苏木精染色、盐酸酒精分化、伊红染色、脱水、二甲苯透明,光镜下观察大鼠肾组织细胞结构。
1.5SABC免疫组化检测大鼠肾组织TLR4/MyD88蛋白表达 取5 μm厚肾组织石蜡切片,依次进行脱蜡水化、抗原修复、3%过氧化氢(H2O2)灭活内源性过氧化物酶、山羊血清封闭、枸橼酸盐缓冲液抗原修复,滴加按1∶50比例稀释的TLR4抗体与MyD88抗体、二抗工作液及DAB显色剂,苏木精复染、脱水、透明、封片,光镜观察各组肾组织TLR4、MyD88蛋白表达。
1.6酶联免疫吸附试验(ELISA)检测大鼠肾脏NF-κB、TNF-α、IL-6表达 将肾脏制成匀浆液,经300 r/min离心,取上清液按1∶100比例稀释,检测大鼠肾组织NF-κB、TNF-α、IL-6表达。取0.1 ml样品置于反应孔中,37℃孵育1 h,洗涤;加入酶抗体,37℃孵育0.5 h,洗涤;加底物液,37℃下显色10 min;酶标仪450 nm检测样品吸光度值,所有操作参照ELISA试剂盒说明进行。
1.7统计分析 采用SPSS17.0软件进行t检验、χ2检验。
2 结 果
2.1给药前后各组24 h尿蛋白含量、24 h尿糖、体重、血肌酐、尿素氮及血糖水平比较 给药后,与正常对照组比较,模型组、利拉鲁肽组、二甲双胍组体重及所测指标水平显著增加(P<0.05);与模型组比较,利拉鲁肽组、二甲双胍组体重明显增加(P<0.05),所测指标水平显著下降(P<0.05);利拉鲁肽组、二甲双胍组各项指标差异无统计学意义(P>0.05)。见表1。
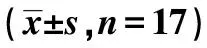
表1 给药前后各组24 h尿糖、尿蛋白、血肌酐、尿素氮及血糖水平比较
与正常对照组比较:1)P<0.05;与模型组比较:2)P<0.05;同表2
2.2给药后各组肾脏形态学比较 光学显微镜下,正常对照组肾组织中肾小球体积正常、基底膜及系膜区无明显增宽增厚现象,与正常对照组比较,模型组肾小球体积增大、系膜区、基底膜增厚明显增厚;与模型组比较,利拉鲁肽组、二甲双胍组肾小球体积变小,系膜及基底膜厚度明显变薄,见图1。
2.3给药后各组TLR4蛋白表达水平比较 显微镜下,在肾组织中可发现褐色或棕黄色沉淀,为TLR4蛋白阳性表达。正常对照组TLR4蛋白微弱表达(0.55±0.08),与正常对照组比较,模型组(0.55±0.08)显著增加(P<0.05);与模型组比较,利拉鲁肽组、二甲双胍组(0.37±0.07,0.46±0.10)明显降低(P<0.05);利拉鲁肽组、二甲双胍组差异无统计学意义(P>0.05)。见图2。
2.4给药后各组MyD88蛋白表达水平比较 显微镜下,在肾组织中可发现褐色或棕黄色沉淀,为MyD88蛋白的阳性表达。正常对照组MyD88蛋白微弱表达(0.39±0.11),模型组、利拉鲁肽组、二甲双胍组(0.76±0.16、0.49±0.12、0.62±0.09)明显增加(P<0.05),但利拉鲁肽组、二甲双胍组明显低于模型组(P<0.05),利拉鲁肽组、二甲双胍组差异无统计学意义(P>0.05),见图3。
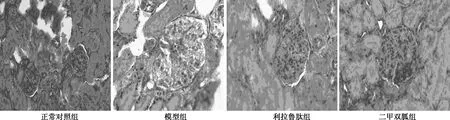
图1 给药后各组肾脏形态学比较(HE,×400)
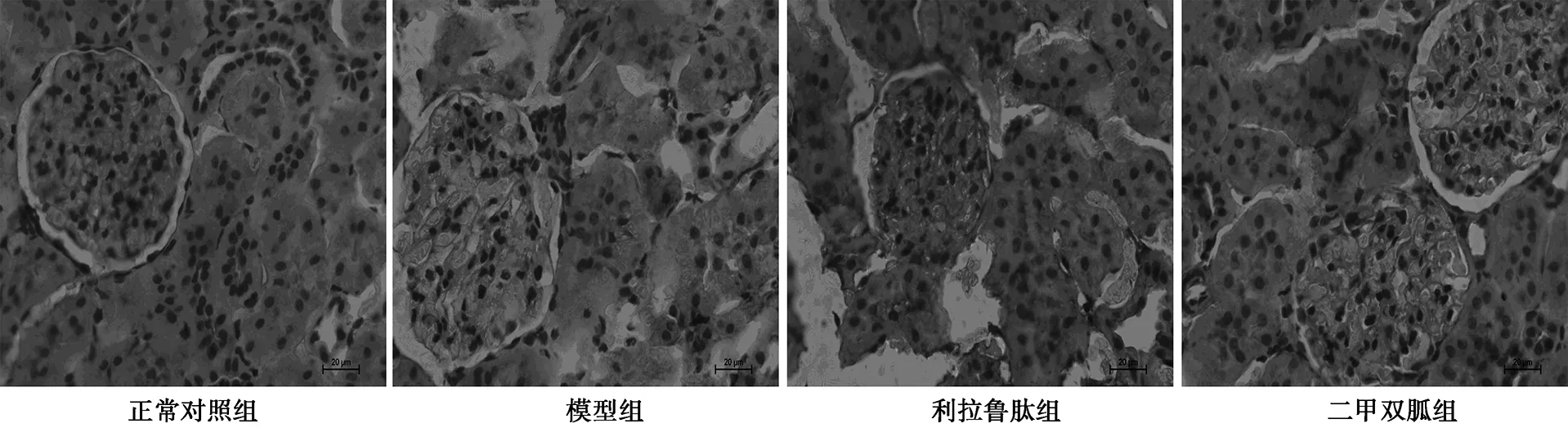
图2 给药后各组TLR4蛋白表达水平比较(×400)
图3 给药后各组MyD88蛋白表达水平比较(×400)
2.5各组NB-κB、TNF-α、IL-6表达比较 与正常对照组比较,模型组、利拉鲁肽组、二甲双胍组NB-κB、TNF-α、IL-6表达明显升高(P<0.05);与模型组比较,利拉鲁肽组、二甲双胍组明显降低(P<0.05)。见表2。
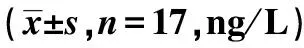
表2 各组NF-κB、TNF-α、IL-6表达比较
3 讨 论
国际糖尿病联盟发布的最新消息显示,在2015年,全球范围内约有4.15亿人罹患糖尿病〔5〕。炎症通路可能是DN进展的中心环节,目前已成为研究的热点。TLR是非特异性免疫中重要组成之一,能够连接特异性免疫与非特异性免疫,并识别多种病原体,由其介导的炎症反应参与了DN的发生及发展〔6~8〕。李曼丽等〔9〕研究发现,高糖环境下,TLR4可以促进肾脏细胞分泌炎症因子,参与了DN的发生。TLR4作为发现较早的TLR相关蛋白,集中分布于单核巨噬细胞、肾系膜细胞、肾小管上皮细胞等〔10〕,可激活TNF-α、IL-1、IL-6等炎症因子表达。TNF-α能通过多种途径使胰岛抵抗现象加重并损害胰岛β细胞;IL-1可以促进NB-κB的进一步激活,放大炎症信号;IL-6能够加重炎细胞浸润,增加肾毛细血管的通透性;三者结合可引起肾脏组织内一系列的非特异性免疫与间质纤维化,最终引发DN〔11〕。
MyD88依赖性通路、MyD88非依赖性通路及β干扰素Toll/IL-1受体同源区(TIR)结构域衔接蛋白依赖通路是目前已知的TLR4介导的信号通路〔12,13〕,其中 MyD88依赖性通路是TLR4的重要组成部分〔14〕,在TLR4介导的炎症反应中发挥无法替代的作用。在MyD88依赖通路中,在TLR4/IL-1配体的刺激下MyD88发生二聚化,同时MyD88羟基端的TIR结构域与Toll的TIR结构域发生作用、氨基端的死亡结构域(DD)激活IL-1受体相关激酶(IRAK)家族。IRAK4可以使自身介导的IRAK1磷酸化途径激活,随后高度磷酸化的IRAK1与MyD88发生解离,转而结合TNF受体相关因子(TRAF)-6。TRAF-6能够通过不同的信号转导途径使丝裂原活化蛋白激酶(MAPK)和IκB激酶(IKK)发生磷酸化,磷酸化的MAPK途径活化转录激活蛋白 (AP)-1,磷酸化的IKK途径激活NB-κB,进而激活TNF-α、IL-1、IL-6等各种炎症分子的转录,参与炎症反应的发生〔15,16〕。本研究结果提示利拉鲁肽能够抑制TLR4/MyD88信号转导通路的表达,降低对大鼠肾脏组织的损害。
利拉鲁肽目前已用于治疗2型糖尿病,且对DN也具有缓解作用,不仅体现在通过葡萄浓度依赖的促胰岛素分泌作用〔17〕,对胰岛β细胞形成保护,还得益于其抗炎作用,刘璠等〔18〕研究发现,利拉鲁肽可以使TNF-α、IL-6等炎症分子的表达下调,在一定程度上缓解了糖尿病及其并发症的发生及发展。利拉鲁肽能够通过对IKK-β参与炎症信号转导的抑制作用,达到改善胰岛抵抗的目的〔19〕;能够抑制单核细胞趋化蛋白(MCP)-1、NF-κB的表达,延缓对肾脏的损害〔20,21〕。本研究提示利拉鲁肽抑制了TLR4/MyD88信号转导通路中的IKK途径,抑制了NF-κB的激活,从而降低了炎症因子的表达,对肾脏产生了保护。

