壁虎活性组分抑制人食管癌KYSE150细胞增殖及迁移
段一梦,孔盼盼,黄泽月,王兵兵,段冷昕,王建刚
食管癌是世界范围内第八大常见癌症,也是导致癌症死亡的第六大常见原因[1-2]。中国食管癌的发病率远远高于其他国家。作为一种传统中药,壁虎具有定惊、祛风、散结和解毒等药理作用[3]。壁虎活性组分(Gecko active components, GACs)已被证明对多种类型的癌症(包括肝癌、宫颈癌和喉癌)显示了抗肿瘤活性,但GACs对人食管癌的抗癌作用及分子机制尚未阐明[4-6]。本实验旨在探讨壁虎活性组分对人食管癌细胞KYSE150细胞增殖及迁移能力的影响与机制。
1 材料与方法
1.1材料
1.1.1细胞人食管癌KYSE150细胞,由河南科技大学第一附属医院新区实验室惠赠。
1.1.2药品与试剂多疣壁虎,批号:090301,安徽省亳州市永刚饮业厂有限公司,经河南科技大学医学院实验动物中心王晓利高级实验师鉴定为多疣壁虎;1640培养液(北京索莱宝公司);胎牛血清(杭州四季青公司);胰蛋白酶(碧云天公司);噻唑蓝(MTT)粉剂(北京索莱宝公司);聚偏二氟乙烯膜(PVDF膜)(美国PALL公司);BCA试剂盒(北京索莱宝公司);RIPA裂解液(北京鼎国生物技术有限公司);彩虹Marker(美国SIGMA公司); ECL发光液(北京康为世纪生物科技有限公司)。E-钙黏蛋白(E-cadherin)一抗、波形蛋白(Vimentin)一抗、GAPDH一抗(武汉ProteinTech公司);辣根过氧化物酶标记二抗山羊抗兔IgG(武汉ProteinTech公司)。
1.1.3仪器JM-L研磨机(上海诺尼轻工机械公司产品),MiniTrans-blot电转膜系统(美国Bio-Rad公司产品),凝胶成像分析系统(美国Bio-Rad公司),倒置荧光显微镜(日本Nikon),ELx800型酶标仪(美国伯腾仪器有限公司)。
1.2实验方法
1.2.1壁虎活性组分的制备GACs是本实验室由干壁虎粉剂经研磨、醇沉、旋转蒸发、冷冻干燥后,经G-25葡聚糖凝胶色谱柱分离,核酸蛋白检测仪检测收集的峰Ⅰ活性组分为壁虎活性组分。每次用时称取适当样品,实验前用1640培养液稀释, 0.22 μm滤膜过滤后用于体外实验。
1.2.2人食管癌KYSE150细胞培养用含10%灭活胎牛血清的1640完全培养液,于37 ℃细胞培养箱中培养,传代培养至对数生长期备用。
1.2.3MTT法检测GACs对KYSE150细胞增殖的影响取对数生长期的KYSE150细胞,加入胰酶消化、计数,计数后将KYSE150细胞调至2.5×104个·mL-1的细胞浓度,将细胞接种到96孔板中(每孔200 μL)并同时设置6个重复孔。按每孔200 μL接种到96孔板,设6个复孔。待细胞贴壁后,加入不同浓度壁虎活性组分培养液,调整GACs浓度分别为0.1、0.15、0.2、0.25、0.3、0.35、0.4、0.45,0.5 mg·mL-1,置于37 ℃恒温培养箱继续培养。在壁虎活性组分作用于人食管癌KYSE150细胞20、44、68 h后,加人MTT溶液(每孔20 μL)后继续培养4 h,弃去上清,将DMSO加入96孔板中(每孔200 μL),将96孔板放置避光处,进行震荡(10 min),用酶标仪检测96孔板每孔的吸光度值(A490)。用下列公式计算抑制率:抑制率(%)=[1-A药物组/A对照组]×100%。
1.2.4分组与给药将处于对数生长期的细胞进行消化、计数并种板,根据MTT的实验结果分为正常组(0)、壁虎活性组分低、中、高3个实验组 (GACs:0.1、0.15、0.225 mg·mL-1)观察组。
1.2.5划痕实验检测GACs对KYSE150细胞水平迁移能力的影响取对数生长期细胞接种至六孔板中,接种两孔,分别为对照组和壁虎活性组分处理组,培养至细胞密度达到80%时,用无菌200 μL枪头划痕,PBS轻柔冲洗3次,洗去脱落细胞,对照组用无血清培养液,处理组用不同浓度壁虎活性组分的无血清培养基继续培养,在0、24 h用显微镜观察并拍照,记录划痕愈合面积的变化。
1.2.6Transwell迁移实验检测GACs对KYSE150细胞迁移能力的影响利用Transwell检测细胞的迁移能力。将KYSE150细胞用不含血清的1640培养基饥饿处理后重悬于不含血清的培养基中,浓度为1×105个·mL-1,上室加入100 μL细胞悬液,同时加入100 μL不同浓度壁虎活性组分无血清培养液;在下室中加入含20%胎牛血清的培养基,培养24 h后,取出小室,进行固定及结晶紫染色,显微镜下观察、拍照。
1.2.7免疫印迹法检测GACs对KYSE150细胞内蛋白表达的变化将KYSE150细胞接种于6孔板中,分别设置空白组、观察组。空白组不加药,观察组分别加0.1、0.15、0.225 mg·mL-1GACs培养液,继续培养24 h后,提取各组细胞全蛋白,进行变性SDS-PAGE电泳转膜,5%脱脂奶粉封闭1 h,TBST洗膜4次,每次5 min;加入稀释的E-钙黏蛋白(1∶2 000)、Vimentin(1∶4 000)、GAPDH(1∶1 000)一抗溶液,放置冰箱4 ℃孵育过夜。二抗(1∶2 000)室温下震荡孵育1 h,采用Bio-Rad凝胶成像系统对实验结果进行处理及分析。

2 结果
2.1GACs对KYSE150细胞的增殖抑制作用采用梯度浓度壁虎活性组分分别处理KYSE150细胞24 h、48 h、72 h后,24、48、72 h 的IC50值分别为0.22、0.18、0.15 mg·mL-1,结果显示,随着壁虎活性组分浓度的增大及时间延长,细胞的相对存活率下降,呈剂量和时间依赖性,见图1。

图1 壁虎活性组分(GACs)对KYSE150细胞的增殖抑制作用
2.2GACs抑制KYSE150细胞的水平迁移通过倒置显微观察,对照组划痕面积明显减少,且趋近融合。GACs组与对照组比较,KYSE150细胞的迁移较慢,划痕面积较大;随着GACs药物浓度的增加,划痕的愈合率明显减少。提示GACs能够抑制KYSE150细胞的水平迁移能力,且药物浓度越高抑制作用越明显,见图2。

图2 壁虎活性组分(GACs)对KYSE150细胞水平迁移的影响(×200)
2.3GACs抑制KYSE150细胞的迁移GACs药物组与对照组比较,3个浓度GACs组穿透基膜的KYSE150细胞数显著减少,且随着GACs浓度的升高,穿透的KYSE150细胞数目越少。由此可见,GACs可计量浓度依赖性抑制KYSE150细胞迁移,见图3。
2.4GACs对KYSE150细胞内E-钙黏蛋白、波形蛋白表达的影响对照组比较,3个浓度GACs组的KYSE150细胞内E-钙黏蛋白的表达明显增高,而波形蛋白的表达明显降低,且差异有统计学意义(P<0.05),见图4。
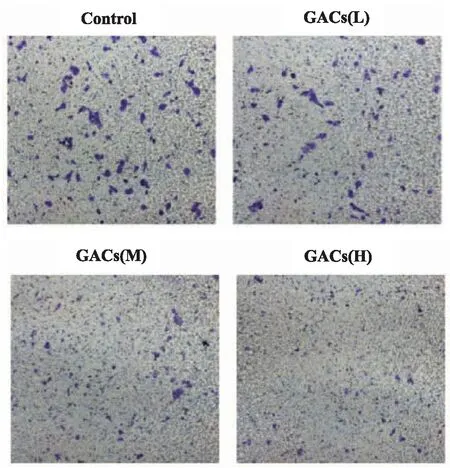
图3 倒置显微镜下壁虎活性组分(GACs)对KYSE150细胞迁移的影响(结晶紫染色,×200)

图4 壁虎活性组分(GACs)对KYSE150细胞E-钙黏蛋白、波形蛋白表达的影响
3 讨论
食管癌是以预后不良为主要特征的癌症[7-8]。目前,除手术和化疗药辅助治疗外,食管癌治疗领域缺少疗效好、副作用小的治疗药[9-11]。壁虎活性组分能够通过多种途径对多种瘤细胞具有抑制作用。本实验结果显示,GACs可浓度依赖性地抑制KYSE150细胞的增殖能力及迁移能力。
细胞增殖在肿瘤的发生发展中起着关键作用,肿瘤细胞增殖速度快,侵袭邻近组织并发生迁移,是肿瘤迁移过程中至关重要的一步[12-14]。本实验发现,GACs能够抑制KYSE150细胞的增殖能力。恶性肿瘤进一步恶化和引发死亡的病理基础之一是肿瘤的转移与侵袭,而肿瘤细胞的转移是肿瘤转移的关键因素之一。EMT是与肿瘤细胞转移密切相关的生物学过程,其中E-钙黏蛋白是EMT代表性分子之一[15]。上皮细胞表达的黏附分子主要有E-钙黏蛋白等分子,E-钙黏蛋白是影响细胞黏附强度的蛋白分子之一,在肿瘤细胞中,E-钙黏蛋白常表现为表达下降,这意味着细胞的活动性增加,黏附能力减弱,进而导致肿瘤的转移[16-18]。相关研究表明,当细胞发生EMT现象时,肿瘤细胞中E-钙黏蛋白表达降低,Vimentin表达升高。Vimentin是一种存在于简直充质细胞的中间丝蛋白,能够对细胞骨架蛋白、细胞黏附分子等蛋白产生调节,进而对肿瘤细胞的迁移、侵袭、黏附和信号转导等过程进行调控[19-20]。本研究发现,GACs可上调E-钙黏蛋白的表达,下调Vimentin的表达,提示壁虎活性组分可能调控KYSE150细胞的EMT进程,进而增加KYSE150细胞间的黏附作用。总之,壁虎活性组分GACs可抑制KYSE150细胞的增殖、迁移,可能与上调E-钙黏蛋白,下调波形蛋白有关。

