姜黄素联合阿霉素对肝癌PLC/PRF/5细胞增殖凋亡及化疗药物增敏的作用及机制研究
刘学飞,张俊梅,徐 龙
0 引言
肝癌是世界范围内的一类常见恶性肿瘤,其在发展中国家发病率极高[1],在我国,肝癌在所有恶性肿瘤的发病率中位居第二[2]。目前,临床上治疗肝癌的首选方案以肝脏切除手术和化疗相结合的方式为主[3],但因为肝癌细胞对化疗药物敏感性差,因此预后效果不佳[4]。阿霉素是临床上常用的一类广谱抗肿瘤药物,治疗肝癌有一定效果,但同时有很强的毒副作用和耐药性[5],因而影响了治疗效果。姜黄素是提取自姜黄根茎的一种多酚,具有抗炎、抗氧化、抗肿瘤等药理作用[6]。有研究表明,姜黄素可通过对化疗药的增敏作用,联合抑制人前列腺癌、喉癌等多种肿瘤细胞,且安全性较高[7-8]。本次实验通过比较姜黄素和阿霉素联用与单用阿霉素对人肝癌PLC/PRF/5细胞增殖、凋亡和化疗敏感性的作用效果,为临床治疗肝癌筛选更合理、更有效的化疗药物治疗方案提供理论支持。
1 实验材料
1.1 细胞和动物 人肝癌PLC/PRF/5细胞株(中国科学院上海细胞所);裸鼠,雄性,4~6周龄,体重15~20 g(济南朋悦实验动物繁殖有限公司)。
1.2 试剂 姜黄素:南京道斯夫生物科技有限公司;盐酸阿霉素:浙江海正药业股份有限公司;胎牛血清、含双抗的DMEM、胰蛋白酶:武汉普诺赛生命科技有限公司;PBS缓冲液、MTT溶液:上海奥陆生物科技有限公司;TUNEL荧光一抗:武汉博士德生物工程技术有限公司;RT-PCR逆转录试剂盒、Trizol、Marker:北京TRANSGEN生物技术有限公司。
1.3 实验仪器 恒温培养箱;Olympus BX5显微镜;低温离心机;高压蒸汽灭菌锅;-80 ℃超低温冰箱;电子天平仪。
2 实验方法
2.1 体外实验
2.1.1 细胞培养与实验分组 将人肝癌PLC/PRF/5细胞接种于含10%灭活的胎牛血清和双抗的DMEM培养基中,置于37 ℃、5% CO2的恒温细胞培养箱中培养,待细胞长满至培养皿约90%时,用0.25%胰蛋白酶进行消化制成单细胞悬液,进行下一步传代。根据不同的干预药物将细胞分为3组,分别为对照组、阿霉素组(2 μmol)、姜黄素(10 μmol)联合阿霉素(2 μmol)组(联合组)。
2.1.2 MTT法检测各实验组药物对人肝癌PLC/PRF/5细胞生存抑制情况 ①细胞接种:将单细胞悬液接种于96孔板中,每孔内含细胞数量5×103个/180 μl,将96孔板置于37 ℃、5% CO2的恒温细胞培养箱中培养12 h,待细胞贴壁后,按实验分组向培养孔中加入相应药物。将盐酸阿霉素和姜黄素分别溶解在DMEM培养液中,并分别稀释至浓度为0.054 mg/ml和0.018 mg/ml,对照组培养孔中加10 μl空白的DMEM培养液,阿霉素组培养孔中加入10 μl溶有盐酸阿霉素的DMEM培养液,联合组培养孔中加入10 μl阿霉素溶液和10 μl姜黄素溶液,另外增设只含培养基组,作为空白孔。每组设置6个平行实验孔。将其置于37 ℃、5% CO2的恒温细胞培养箱中培养48 h。②MTT法检测细胞抑制情况:将培养48 h后的96孔板取出,每孔加入MTT溶液(5 mg/ml)20 μl,孵育4 h后弃去上清液,每孔加入DMSO 150 μl,微孔振荡器震荡10 min,490 nm波长条件下用紫外-荧光酶标仪测定各培养孔的吸光度值(OD值),重复测量3次,根据公式计算人肝癌PLC/PRF/5细胞在不同药物作用下的抑制率,存活率(%)=(1-待测孔OD值/对照孔OD值)×100%。
2.1.3 RT-PCR方法检测人肝癌PLC/PRF/5细胞内Caspase-3基因表达 Trizol提取总RNA,行逆转录反应。取2 μl进行PCR扩增,内参为GAPDH,内参引物序列:Sense,GTATAATGAGAAGCCAGACCAT;Antisene,ACAGCTTCTCAAGTCT。Caspase-3 mRNA的引物序列:Sense,GTTATCCCTGCTTCACTACT;Antisense,GAGACACTCTGTCCACACC。Caspase-3 mRNA及内参扩增条件:94 ℃预变性2 min,1个循环;94 ℃变性30 s,55 ℃退火30 s,72 ℃延伸2 min,共35个循环;72 ℃总延伸6 min。取5 μl PCR扩增产物进行琼脂糖凝胶电泳,紫外线投射仪下观察电泳条带,分析目的基因Caspase-3 mRNA和参比基因的条带灰度值。
2.2 体内实验
2.2.1 动物模型建立 本实验一共15只裸鼠,在SPF级环境下饲养。取对数期人肝癌PLC/PRF/5细胞,用0.25%胰蛋白酶进行消化,制成1×108/ml单细胞悬液,每只裸鼠注射2 ml于肩背部皮下,接种后第14天左右,裸鼠背部出现直径为5 mm左右的肿瘤结节,当肿瘤组织体积至少61 mm3时,证明裸鼠人肝癌PLC/PRF/5细胞移植瘤模型建立。肿瘤体积的测量方法是,用游标卡尺分别测量肿瘤的长径和短径,按公式计算肿瘤体积,体积(cm2)=(长径×短径2)/2。
2.2.2 动物分组及给药 将实验动物随机分为空白对照组(对照组)、阿霉素治疗组(阿霉素组)、姜黄素联合阿霉素治疗组(联合组),每组5只。建模成功(即第14天起)开始给药,每天1次,持续给药10 d。其中阿霉素组裸鼠给予腹腔注射阿霉素溶液1 mg/(kg·只),联合组裸鼠给予腹腔注射阿霉素溶液1 mg/(kg·只)+姜黄素溶液10 mg/(kg·只),对照组给予等量生理盐水。每天称量体重,测量肿瘤组织体积,观察实验动物饮食及精神状态的变化,并加以记录。
2.2.3 测量肿瘤体积和重量 在开始给药前(第14天),量取裸鼠皮下肿瘤组织的长径和短径,并计算体积,经过10 d的治疗后,将裸鼠处死,取出皮下的肿瘤组织,同时计算此时肿瘤组织的体积,并称取重量。
2.2.4 实验动物的处死及标本提取 在肿瘤移植后第24天,将所有实验裸鼠脱颈椎处死。将肿瘤组织剥离,称量重量,测量体积后,将每个肿瘤分成两部分,其中一部分固定于10%甲醛溶液中,24 h后用石蜡包埋制成蜡块,另一部分保存于-80 ℃冰箱。
2.2.5 TUNEL染色检测肿瘤组织中细胞凋亡情况 参照文献中实验步骤[8],用TUNEL免疫荧光试剂漂染肿瘤石蜡标本切片,用Olympus FV1000激光共聚焦显微镜拍照,每个肿瘤组织随机选取3张切片,每张切片在荧光显微镜下随机选取5个视野,观察TUNEL阳性细胞数量在总细胞数量中所占比例。
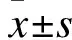
3 结果
3.1 MTT法检测不同治疗药物对人肝癌PLC/PRF/5细胞增殖的影响 阿霉素组细胞抑制率为27.68%,显著高于空白对照组的3.96%(P<0.05);联合组细胞抑制率为39.83%,显著高于阿霉素组(P<0.05)。三组间比较差异有统计学意义(P<0.05)。见表1。
3.2 TUNEL免疫荧光法检测肿瘤组织中凋亡细胞数量 由图1可见,阿霉素组TUNEL阳性细胞染色数量多于对照组,而联合组肿瘤细胞的荧光染色数量最多。在显微镜镜下相同的视野范围内,对照组凋亡的肿瘤细胞数量为(202.64±11.72)个,阿霉素组凋亡的肿瘤细胞数量为(289.75±25.37)个,多于对照组(P<0.05),联合组凋亡的肿瘤细胞数量为(426.93±31.58)个,显著多于对照组和阿霉素组(P<0.05)。
3.3 RT-PCR检测肿瘤细胞内Caspase-3基因表达情况 对照组条带相对灰度值为0.132±0.005,阿霉素组条带相对灰度值(0.386±0.025)高于对照组(P<0.01),联合组条带灰度值(0.588±0.054)高于阿霉素组(P<0.01)。见图2。

图1 体内实验各组肿瘤组织内TUNEL阳性细胞数量比较

图2 体外实验各组细胞Caspase-3 mRNA表达情况比较
3.4 三组动物肿瘤体积比较 治疗前,三组动物肿瘤体积比较差异无统计学意义(F=45.82,P>0.05);各组治疗后体积及治疗前后体积差之间差异有统计学意义(F=67.96,P<0.01;F=63.39,P<0.01)。治疗前,阿霉素组肿瘤体积与对照组比较差异无统计学意义(P>0.05);治疗10 d后,阿霉素组肿瘤体积小于对照组(P<0.01),治疗前后体积差小于对照组(P<0.01)。治疗前,联合组肿瘤体积与对照组、阿霉素组比较差异无统计学意义(P>0.05);治疗后,联合组肿瘤体积和治疗前后体积差均小于阿霉素组(P<0.01)。见表2。

表2 治疗前后裸鼠皮下肿瘤体积比较(mm3)
注:与阿霉素组比较,**P<0.01
3.5 三组肿瘤重量比较 三组肿瘤重量比较差异有统计学意义(F=52.47,P<0.05)。阿霉素组肿瘤组织重量小于对照组(P<0.05);联合组肿瘤组织重量小于阿霉素组(P<0.05)。见表3。

表3 不同治疗手段对裸鼠皮下肿瘤重量的影响
注:与阿霉素组比较,**P<0.01
4 讨论
肝癌是发病率、死亡率都很高的一类恶性肿瘤,极大地威胁着人类健康[1-2]。目前,临床首选的治疗方案是手术联合化疗,但肝癌细胞对常规的化疗药物有很强的耐受性,敏感性差,因此,治疗效果往往不理想,不能改善患者的治疗结局[3-4]。阿霉素是临床上一种重要的化疗药物,通过诱导肿瘤细胞的DNA损伤而诱发其凋亡,能有效抑制多种癌细胞[5],因为其毒副作用明显,临床上往往与其他药物联合使用,以降低对患者的损伤[9],但肝癌患者对该药的敏感性较差[5]。姜黄素是一种从植物姜黄中提取的多酚,有研究报道,姜黄素可通过对化疗药的增敏作用联合抑制人前列腺癌、喉癌等多种肿瘤细胞,且安全性较高[7-8,10-13],但其对人肝癌细胞的作用尚未见报道。
癌症之所以难以治愈,其重要原因之一是癌细胞能够在机体内无限增殖[14],因此,抑制癌细胞增殖是治疗癌症的关键[15]。本研究通过MTT法,检测不同干预药物对人肝癌PLC/PRF/5细胞增殖的影响,结果显示,阿霉素干预组的细胞抑制率为27.68%,显著高于对照组,说明阿霉素能抑制人肝癌PLC/PRF/5细胞的存活和增殖,联合组细胞抑制率为39.83%,明显高于阿霉素干预组,说明姜黄素和阿霉素联用后,增强了对人肝癌PLC/PRF/5细胞增殖的抑制作用。
阿霉素抑制癌细胞的主要作用机制是诱导肿瘤细胞的凋亡,前期研究表明,姜黄素对HepG2细胞的凋亡有促进作用[16],但对于人肝癌PLC/PRF/5细胞的作用鲜有报道。本研究将姜黄素和阿霉素联合作用于人肝癌PLC/PRF/5细胞,检测其对人肝癌PLC/PRF/5细胞凋亡的影响,并与单独使用阿霉素的凋亡反应相比较,结果显示,在显微镜镜头下相同的视野范围内,阿霉素组凋亡肿瘤细胞的数量显著多于对照组,证明阿霉素能促进人肝癌PLC/PRF/5细胞的凋亡,而联合组凋亡的肿瘤细胞数量多于阿霉素组,说明两药联用之后促凋亡作用增强,表明姜黄素增加了阿霉素对人肝癌PLC/PRF/5细胞的凋亡作用。
Caspase家族是凋亡信号转导过程中重要的凋亡蛋白酶,而Caspase-3处于各凋亡途径的枢纽环节,是最重要的凋亡调控因子[17],因此,Caspase-3的表达能侧面反映细胞的凋亡程度。本研究的体外实验中检测了不同药物干预后人肝癌PLC/PRF/5细胞Caspase-3的基因表达,结果显示,联合组的Caspase-3基因表达最强烈,显著高于阿霉素组和对照组,阿霉素组Caspase-3基因表达显著高于对照组。因此,进一步证实了姜黄素与阿霉素联用对人肝癌PLC/PRF/5细胞凋亡的促进作用要强于阿霉素。
肝癌之所以预后性差,主要原因是肝癌细胞对化疗药物存在高度的耐受性[3-4],因此,提高肝癌细胞对化疗药物的敏感性是治疗肝癌的重要切入点。本研究中,我们通过比较不同药物治疗后小鼠体内肿瘤体积的变化,评估肝癌细胞对不同化疗药敏感性的差异,结果发现,三组治疗后肿瘤体积以及治疗前后体积差之间差异均有统计学意义,治疗后三组肿瘤的重量差异也有统计学意义,且姜黄素与阿霉素联合组肿瘤的体积和重量均小于对照组和阿霉素组,表明阿霉素能有效抑制肿瘤的增长,其与姜黄素联合使用后,抑制作用更显著,证明姜黄素联合阿霉素后,能使肝癌肿瘤对化疗药敏感性增加,具有化疗药增敏作用,且这种增敏作用可能是通过抑制肿瘤细胞的增殖、促进肿瘤细胞的凋亡而实现的。
综上所述,姜黄素与阿霉素联合使用后,较单独使用阿霉素更能增加人肝癌PLC/PRF/5细胞的药物敏感性,这种作用可能与抑制人肝癌PLC/PRF/5细胞的增殖,促进人肝癌PLC/PRF/5细胞的凋亡有关。

