HIF-1α慢病毒和小孔径髓芯减压治疗兔早期激素性股骨头坏死的研究
丁 路, 黄 涛, 李 榕
(新疆医科大学1第五附属医院, 2公共卫生学院, 乌鲁木齐 830011)
股骨头坏死是一种进展性疾病,且发病率较高。股骨头坏死患者年龄大多在20~50岁之间[1]。其中激素性股骨头坏死(steroid-induced femoral head necrosis,SFHN)主要表现为股骨头血供受损,大量骨细胞及骨髓成份丢失,继而导致股骨头骨结构改变、股骨头塌陷、引起关节功能障碍。有研究表明,约75%的患者3年内可发展为股骨头塌陷,且超过65%的患者可发展为关节强直、疼痛(难以忍受)[2]。髋关节置换通常是缓解疼痛和关节活动度恢复的唯一有效手段[3]。关节置换术虽发展迅速,也取得较好的进展,但其远期效果并不太理想,其中部分治疗后的患者仍需要持续接受相关治疗[4]。目前认为,激素性股骨头坏死发病机制主要包含骨小梁稀疏引起微骨折、血管栓塞、血管壁损伤、脂代谢紊乱、血管内凝血和骨内高压等。无论何种发病机制其最终发展结局均为成骨组织局部缺血坏死[5-6],激素性股骨头坏死的关键形成因素是组织缺血缺氧[7]。因此临床迫切需要探索血运重建、新骨形成的新的治疗策略,这对提高患者生活质量具有深远意义。本研究探讨低氧诱导因子(HIF-1α)慢病毒和小孔径髓芯减压治疗早期激素性股骨头坏死的疗效。
1 材料与方法
1.1实验动物本项研究使用的实验动物为新西兰大白兔,共15只,均为雄性(研究表明:兔激素性股骨头缺血坏死模型发生早期存在性别差异,雄性动物更容易受激素影响发生骨损伤)[8]。HIF-1α基因扩增引物及其相关实际均来自中国长春纵横寰宇生物科技有限公司。
1.2方法
1.2.1 引物合成 通过pEGFP-N1-HIF-1α载体质粒中提取公认的HIF-1α基因的基因片段,在其上下游加上酶切位点序列,5′端上游为BamHI酶切位点序列,3′段下游为Asc Ⅰ酶切位点序列。具体引物信息见表1。

表1 引物信息
1.2.2 HIF-1α基因扩增 模板为pEGFP-N1-HIF-1α载体质粒,扩增目的序列为HIF-1α基因序列,PCR扩增体系见表2。
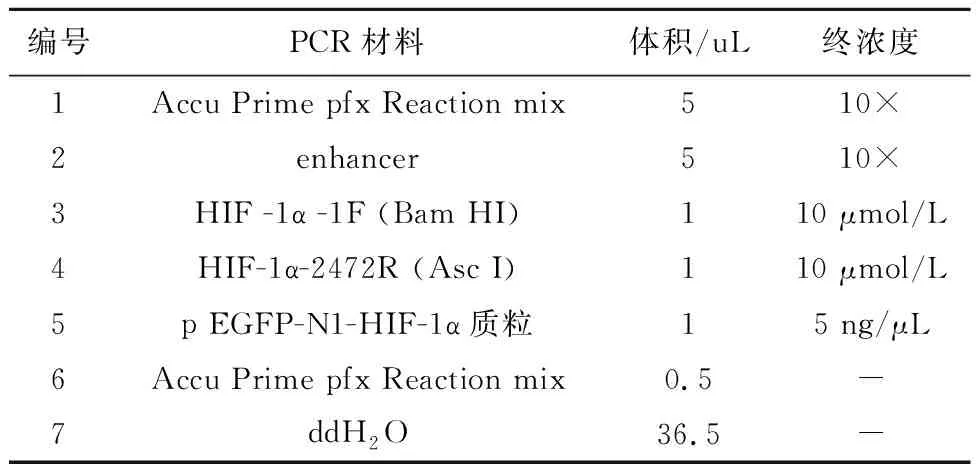
表2 HIF-1α基因PCR扩增体系
1.2.3 HIF-1α慢病毒载体构建 本实验使用pLenti6.3-HIF-1α-IRES2-EGFP载体,具体操作为:(1)采用BamHI和Asc Ⅰ双酶切目的基因片段。(2)同时使用BamHI和Asc Ⅰ双酶切进一步处理。(3)连接目的基因片段和基因载体,连接体系为10× Ligation buffer 0.5 μL、基因片段,0.5 μL T4 NDA Ligase (10 U/μL)。16℃处理2 h转化到感受态。(4)重组克隆载入基因片段送中国长春纵横寰宇生物科技有限公司完成测序验证序列信息检测。
1.2.4 HEK293T细胞培养 培养基DMEM加HG培养基置于培养箱(5% CO2、37℃)中培养。传代时使用0.25%胰酶(含0.02%EDTA) ,进行5 s细胞消化。
1.2.5 动物模型分组 15只新西兰大白兔(雄性),耳缘静脉注射脂多糖(10 μg/kg),连续3 d每日肌肉注射甲泼尼龙(20 mg/kg),每次注射时间间隔24 h。以最后一次注射起2 w后3%的戊巴比妥钠耳缘静脉麻醉大白兔,将大白兔体位调整为俯卧位,通过磁共振扫查证实大白兔股骨头内是否出现骨坏死。15只动物中有12只发生了早期股骨头坏死,将12只造模成功大白兔作为后续研究对象,随机将实验动物分为3组:A组:5只大白兔接受双侧股骨头髓芯减压和 HIF-1α慢病毒治疗;B组:5只大白兔仅接受双侧股骨头髓芯减压治疗;C组:空白对照组,2只大白兔不接受任何治疗。3%的戊巴比妥钠麻醉,俯卧于手术台,双侧股骨近端被毛。股骨大转子为中心,作长度为4 cm左右的纵形手术切口,切开深筋膜,将大转子和周围肌肉暴露,并露出骨组织。DSA透视的情况下,使用直径为1 mm的钻头经大转子后下方与股骨长轴成135°向股骨头内钻孔,同时确认钻头已进入股骨头坏死病灶内。退出钻头后,使用注射器抽取生理盐水冲洗,将细胞悬液(5×106的HEK293T细胞悬液)注入A组中。术后3 d,预防感染采用庆大霉素8万单位。
1.2.6 重组慢病毒滴度检测 使用有限稀释10倍病毒后感染HEK293T细胞在倒置显微镜下观察增强绿色荧光蛋白(EGFP)的表达量,病毒滴度计算公式使用T=(I × M)/V。其中I表示荧光细胞比例,M表示病毒加入时细胞总数,V表示加入病毒液中所含病毒原液体积数。
1.2.7 结果验证 8 w后行MRI检查、X线检查、显微CT检查。
2 结果
2.1HIF-1α慢病毒载体构建通过PCR扩增获得HIF-1α基因片段,其大小约2 500 bp。通过公司检测测序验证表明HIF-1α慢病毒载体构建成功(图1、图2)。

图1 显微镜下HIF-1α慢病毒感染图像

图2 HIF-1α慢病毒的表达情况
2.2重组慢病毒滴度检测结果采用病毒滴度计算公式T=(I ×M)/V,终测定病毒滴度结果显示为4×106TU/mL。
2.3影像检查结果
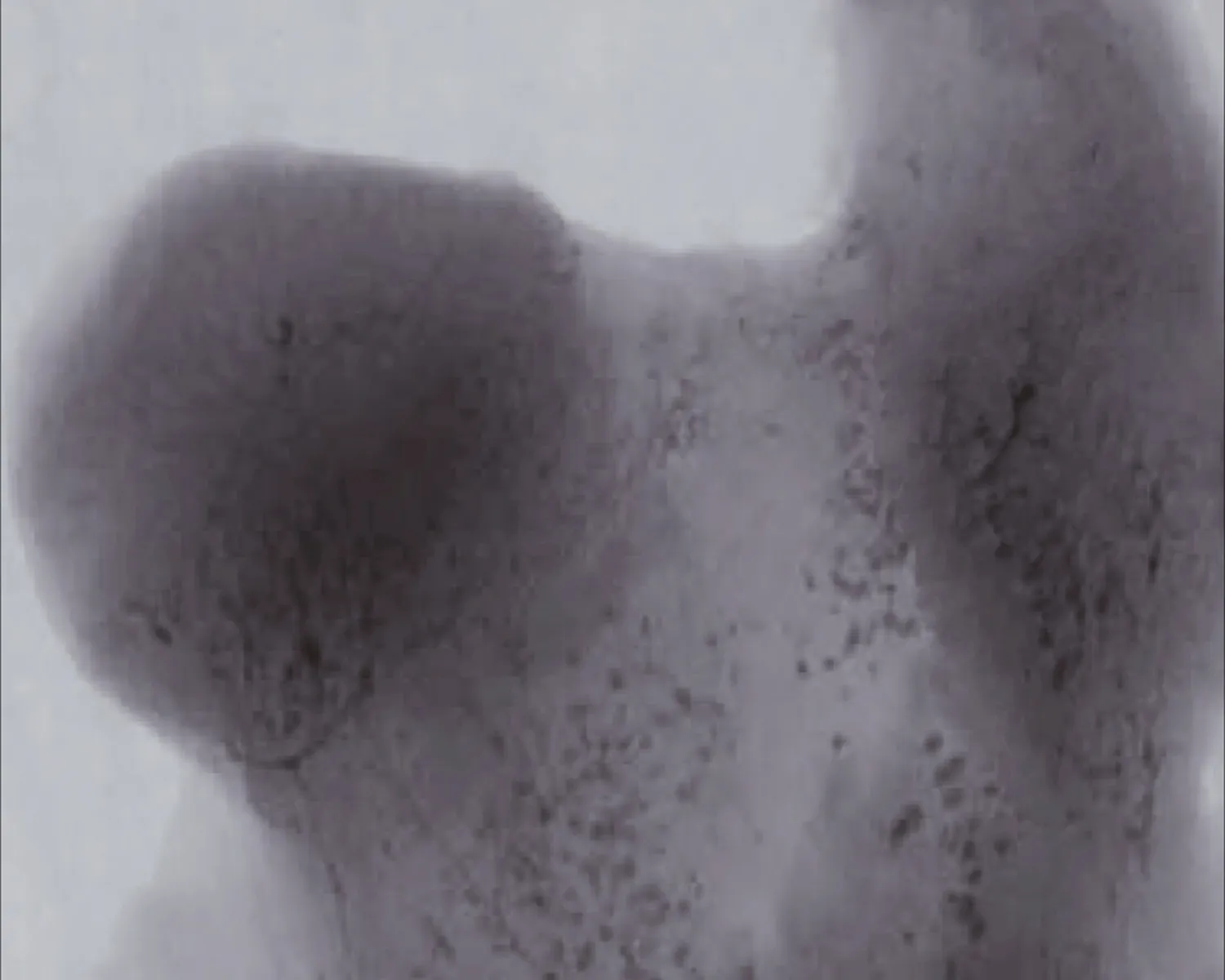
2.3.1 MRI观察结果 干预治疗后8 w行MRI检查图像显示HIF-1α慢病毒和髓芯减压联合治疗组(A组)双侧股骨头及头下信号不均匀区域减少,股骨头表面软骨退变减轻、变厚。单纯髓芯减压治疗组(B组)中双侧股骨头及头下斑片状信号较术前减少,部分软骨退变、变薄;髋臼内少量积液;对照组(C组)股骨头出现明显坏死区,呈低信号,未见股骨头塌陷,提示股骨头已经坏死(图3)。


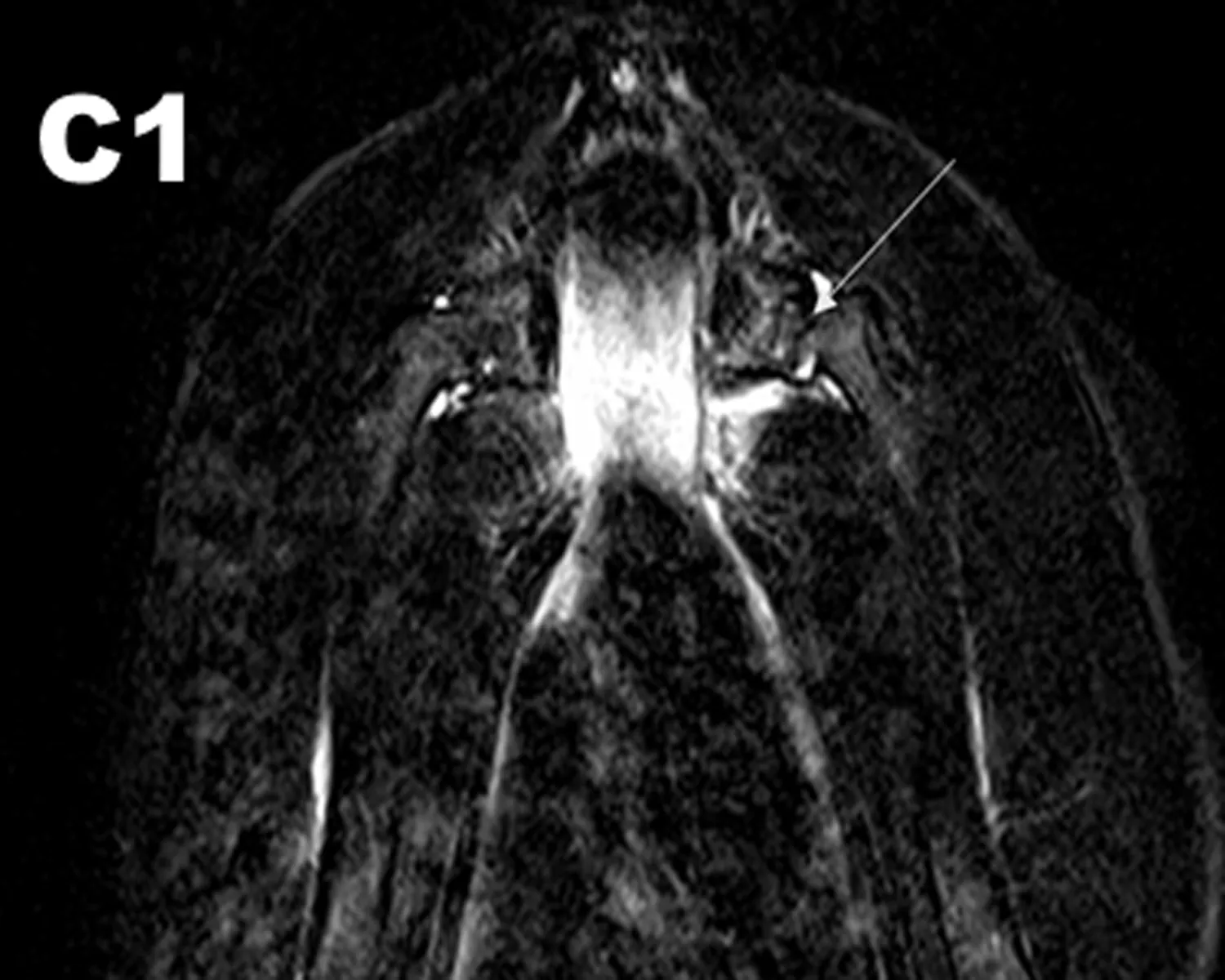
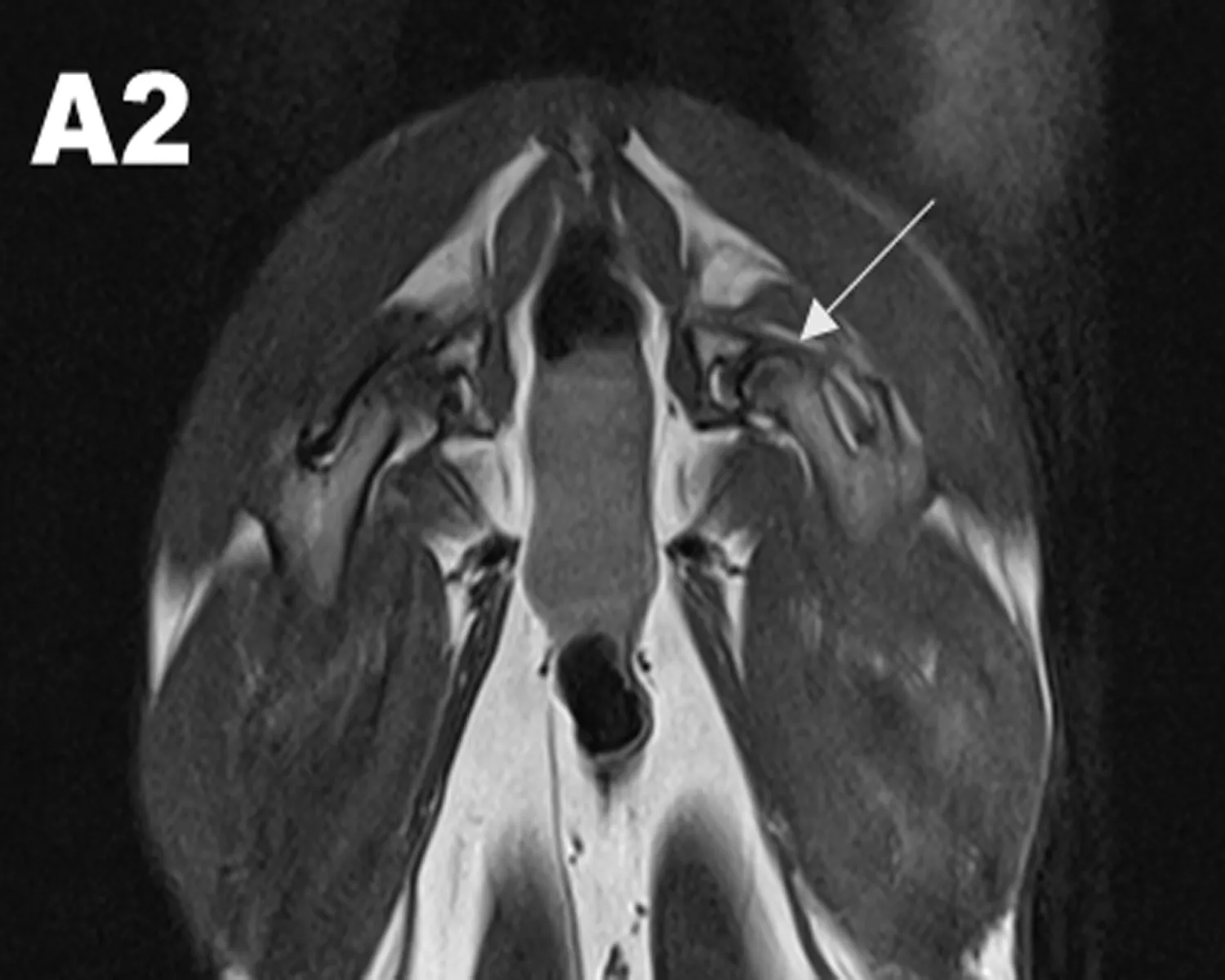
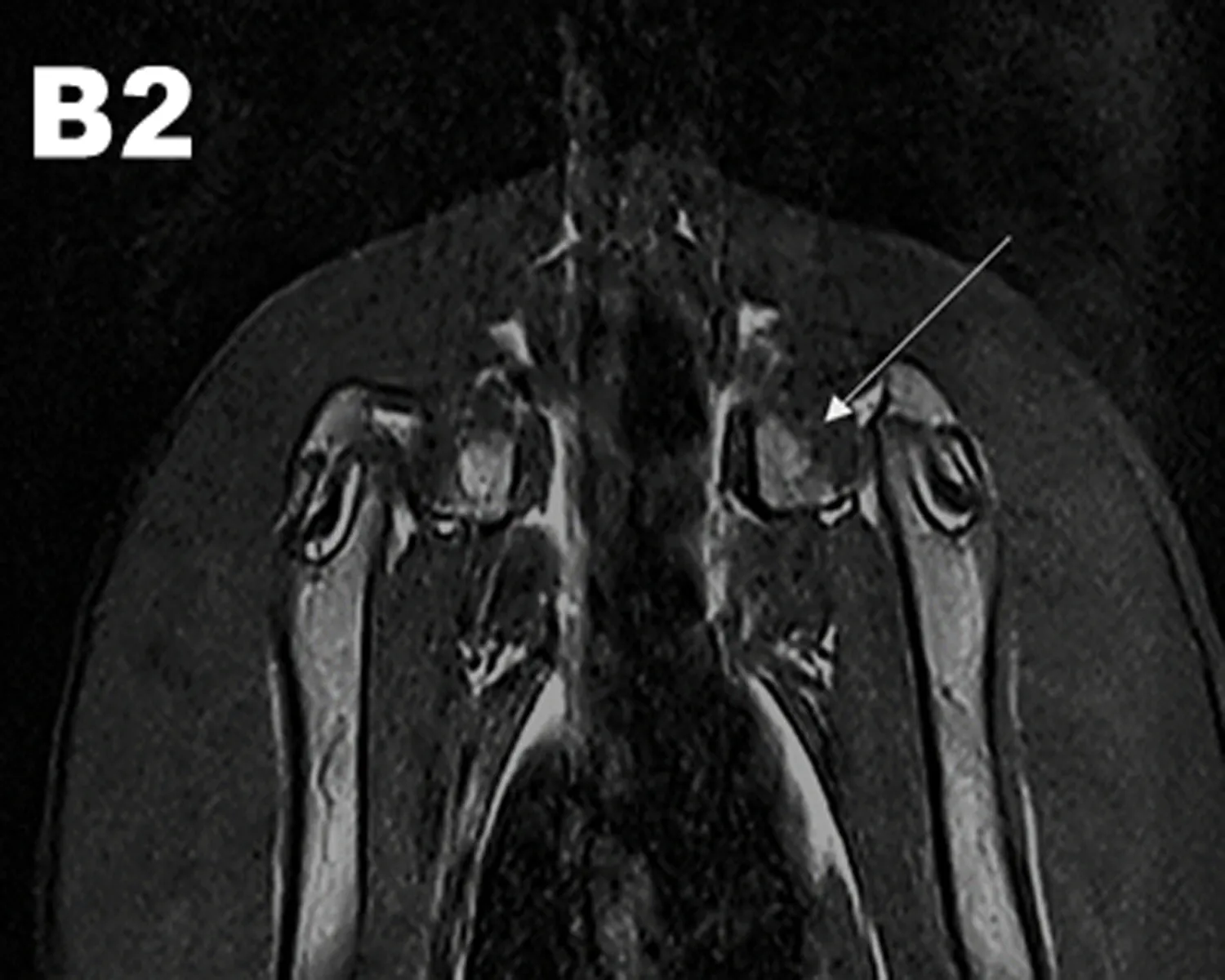
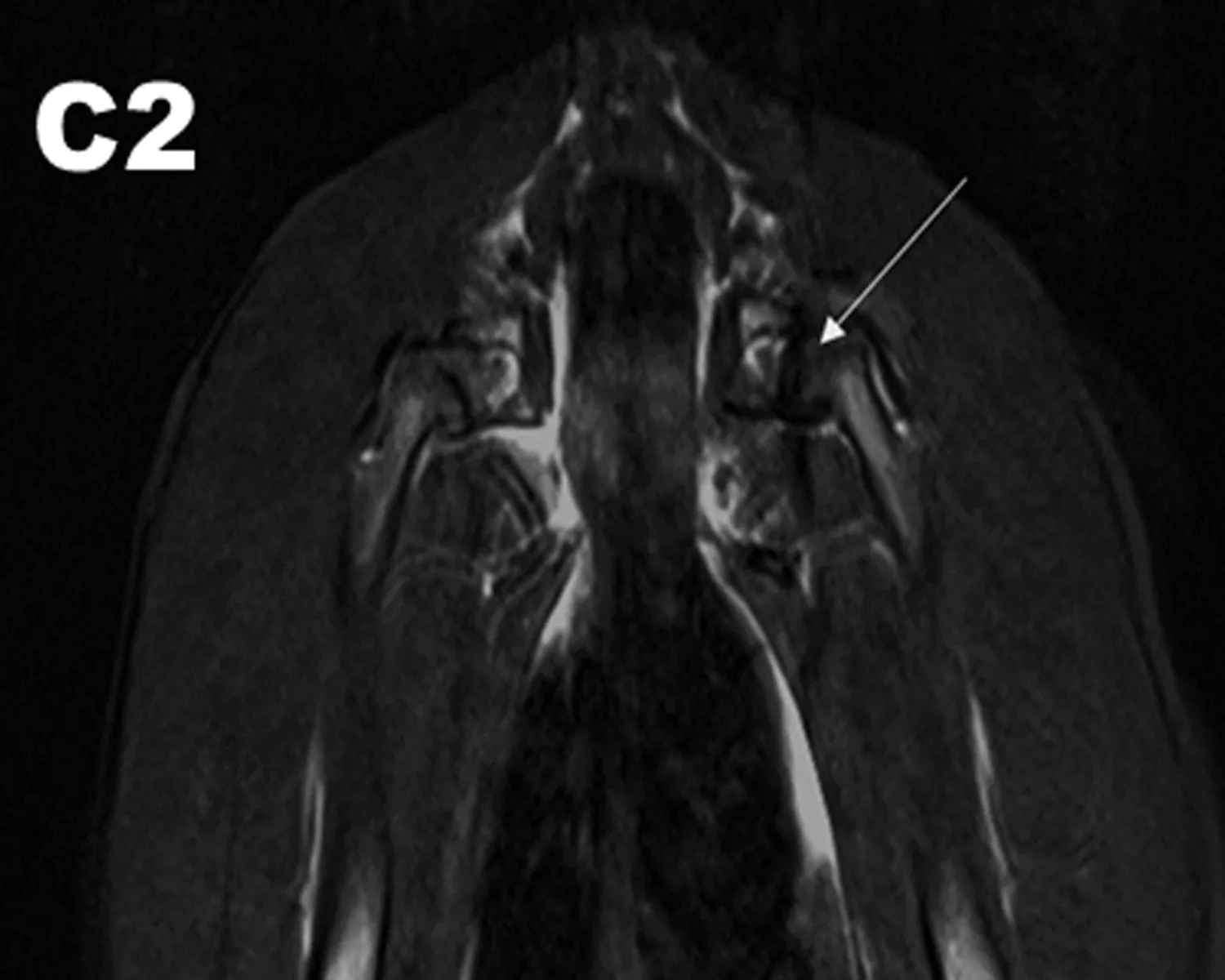
图3 MRI检查结果
注: A1: 联合治疗前,MRI图像显示在T2WI图像上股骨头出现混杂性低信号,关节腔少量积液,提示股骨头已经出现坏死;A2: 联合治疗后的MRI结果,股骨头及头下信号不均匀区域减少,股骨头表面软骨退变减轻、变厚。
2.3.2 X线检查结果 术后8 w行X射线检查,结果提示HIF-1α慢病毒和髓芯减压联合治疗组(A组)股骨头密度明显增高,关节间隙基本正常;单纯髓芯减压治疗组(B组)股骨头大体轮廓基本正常,但股骨头局部呈现密度不均匀影像,骺板尚清晰,未观察到股骨头出现明显塌陷,髋关节间隙无明显变化;对照组(C组)股骨头体积缩小、股骨头表面毛躁、不光滑、骺板比较模糊、关节间隙增宽(图4)。
2.3.3 显微CT检查结果 标本脱钙后行显微CT结果示:A组坏死区域有大量新生血管组织,B组坏死区域内新生血管组织较A组少,C组几乎没有新生血管组织(图5)。
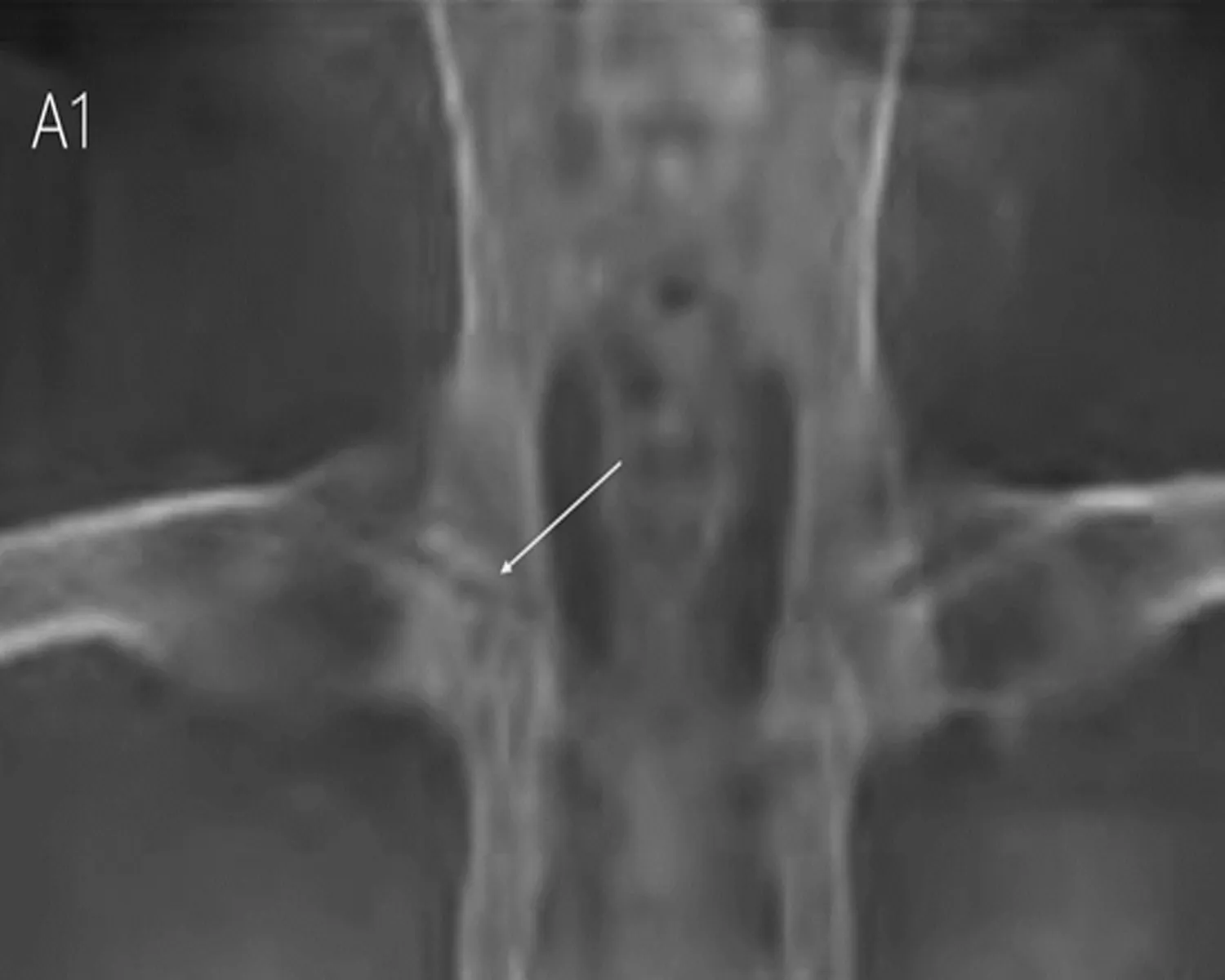



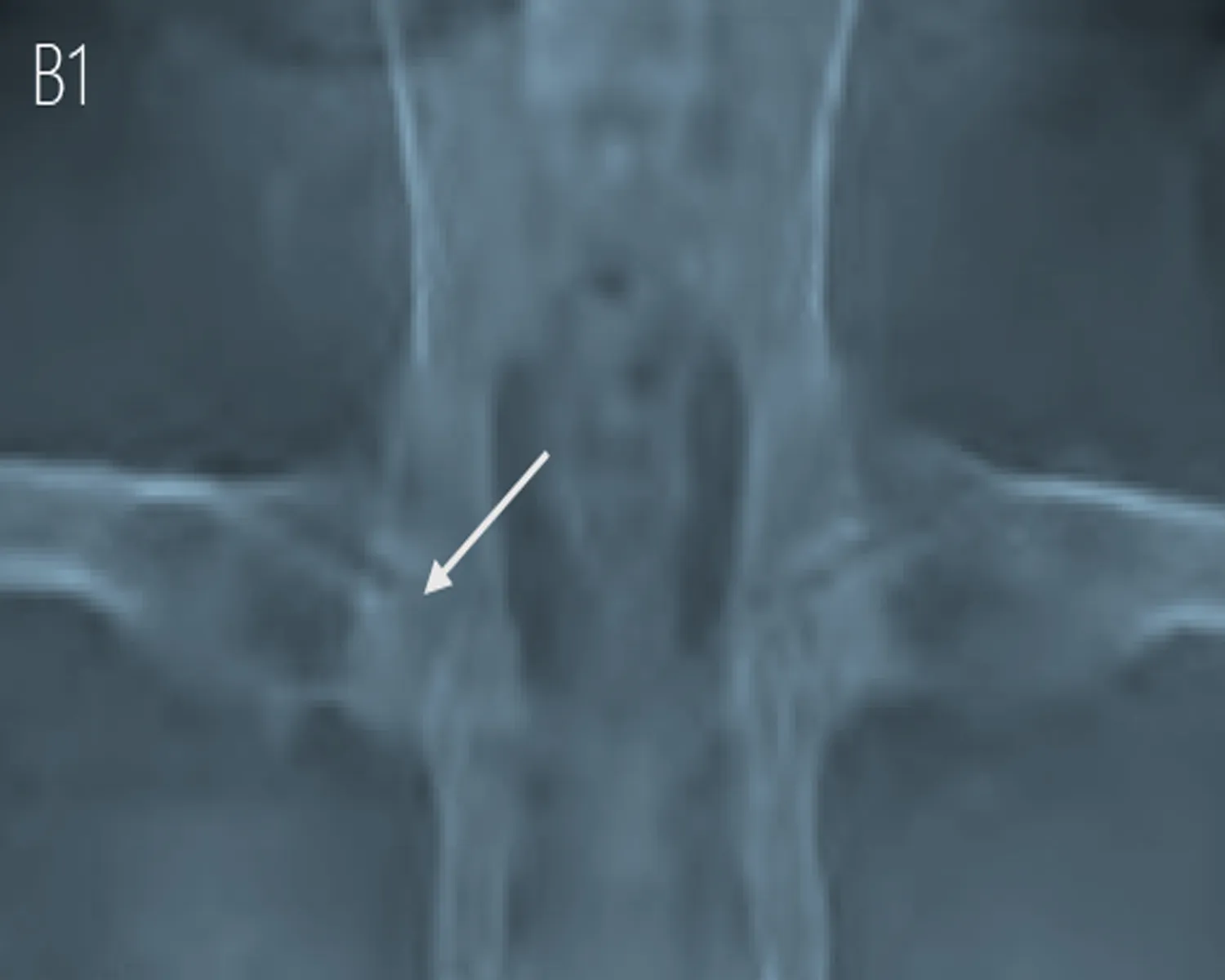
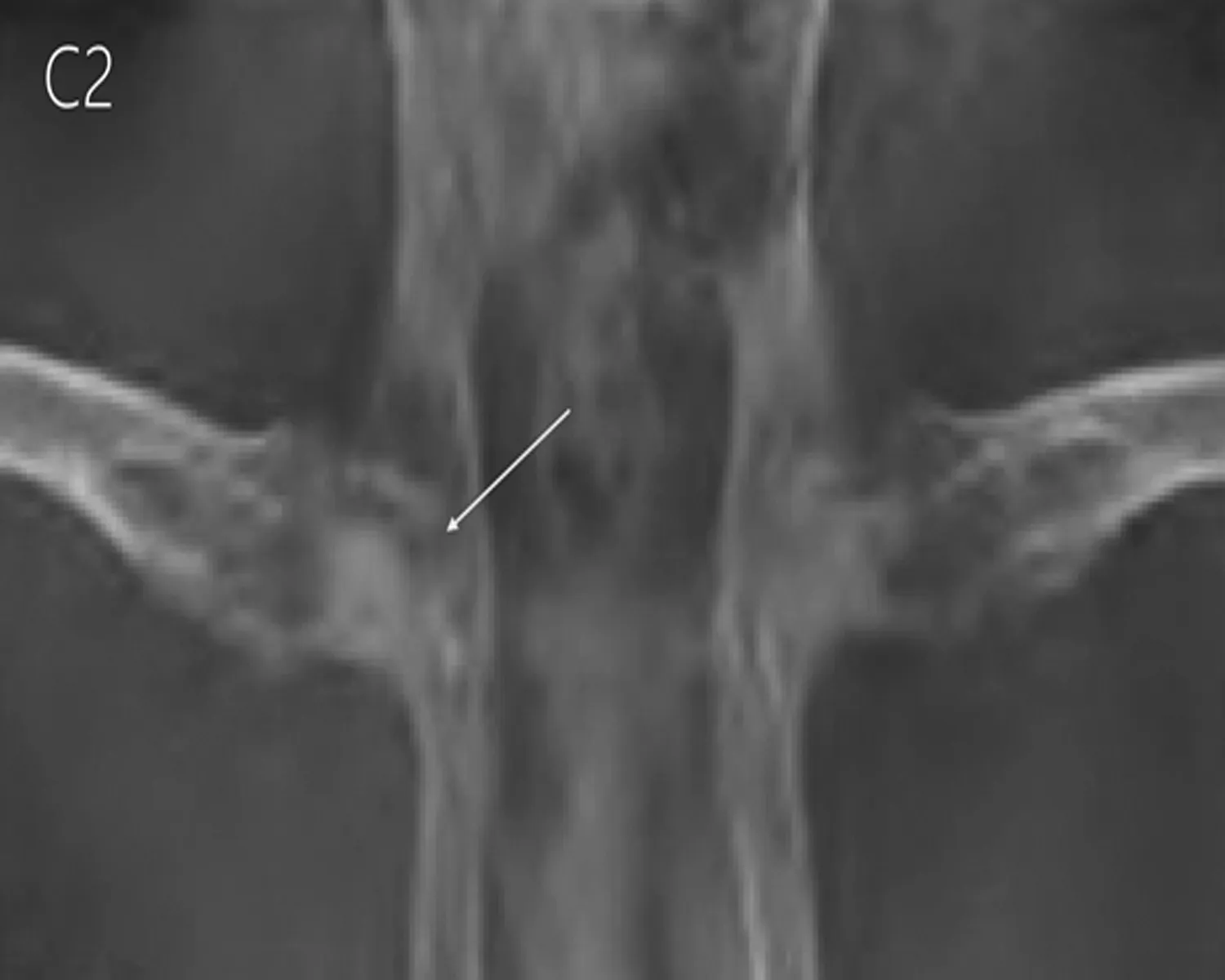
图4 X线检查结果
注: 联合治疗组(A组)股骨头密度明显增高,关节间隙基本正常;单纯髓芯减压治疗组(B组)股骨头大体轮廓基本正常,但股骨头局部呈现密度不均匀影像,髋关节间隙无明显变化;对照组(C组)股骨头体积缩小、股骨头表面毛躁、不光滑、关节间隙增宽。


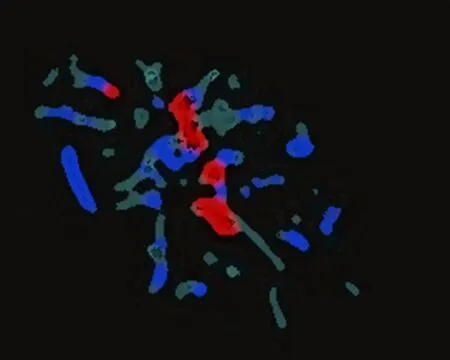
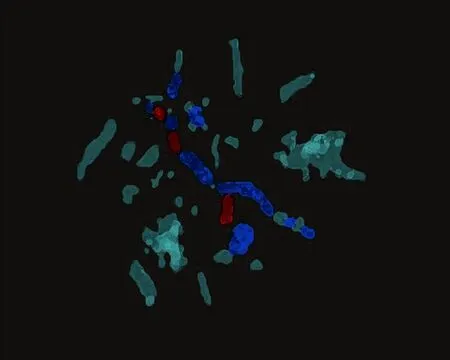
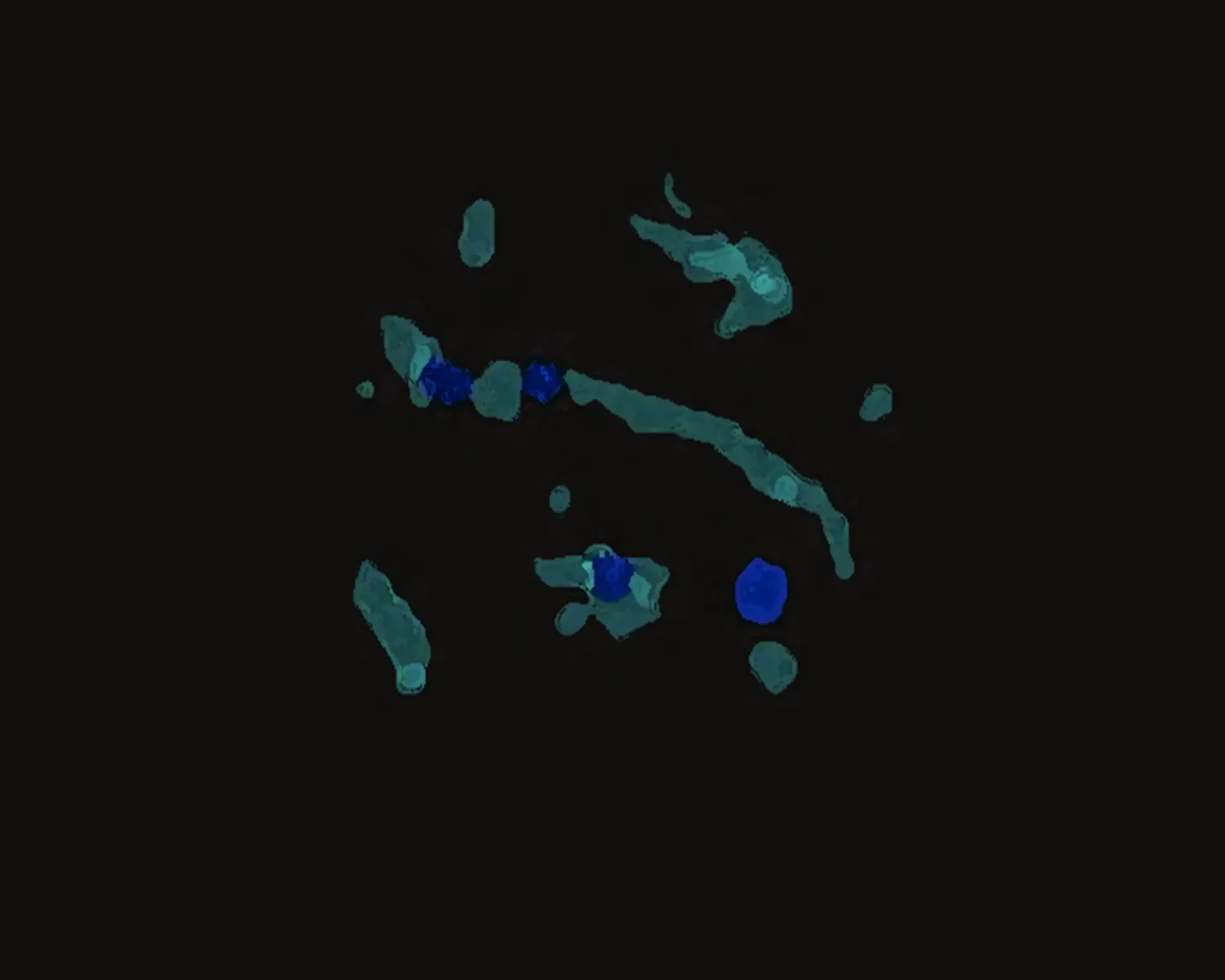
A组 B组 C组
3 讨论
股骨头坏死是一种发病率较高的进展性疾病。其中激素性股骨头坏死以股骨头血供受损,骨细胞及骨髓成份丢失,继而引起股骨头骨结构改变、股骨头塌陷、关节功能障碍。近年来干细胞、生长因子移成为发展迅速的一种全新治疗模式,在研究中被广泛的用于促进组织修复,成为治疗骨缺血性坏死疾病的研究热点,但在实际应用中,受移植部位氧化压力等恶劣环境影响,治疗效率还较为低下。
HIF-1α在组织细胞缺血缺氧状态下表达,是诱导低氧基因和维持细胞内氧环境稳定的核心转录因子,参与调控血管生成、炎性细胞及干细胞归巢、细胞分化、糖代谢等众多生理病理反应。机体内大部分组织器官生理条件下氧分压均可维持在20%左右,而骨骼和骨髓腔内可处于低氧状态,氧分压仅为1%~7%,因此骨骼内的多种细胞,如成骨细胞、骨细胞等在生理状态下都表达HIF-α。近年来的研究表明,HIF-α信号通路对骨发育及骨重塑均有至关重要的作用。通过对骨形成、血管形成的影响,HIF-α仅信号通路能够调控骨发育时的骨量。HIFs为转录因子,属于Per/Anrt/Sim超家族成员,异二聚体,由α和β亚基组成的。其中α亚基包括3种亚型(HIF-1α、HIF-2α、HIF-3α)。当氧气浓度大于5%时被降解,且半衰期仅5 min;在常氧条件下β亚基可恒定表达。HIFs信号通路的调节主要机制为HIF-α调节;其中HIF-1α是一种核转录因子,在低氧环境中表达量增加,可提高组织对缺氧的耐受。在缺血缺氧情况下,HIF-1α信号通路在骨形成和血管生成过程中起着不可代替的调节作用[9-11]。
Li 等[12]发现缺血坏死的股骨头组织内检测到HIF-1α表达。CHI等[13]对缺血性股骨头坏死动物模型进行研究发现, HIF-1α通过上调Sox9的活性,从而调节缺血性股骨头坏死的软骨代谢。HIF-1α蛋白的缺失的情况下,使生长板内部缺氧细胞大量坏死[14]。提示HIF-1α蛋白在软骨细胞正常生长过程中起着不可代替的作用。这可能是HIF -1α激活其部分下游基因,使软骨细胞转向缺氧代谢途径,并使软骨无氧酵解激活,从而适应缺氧环境[15]。上述大量研究均表明HIF-1α信号通路与激素性股骨头坏死密切相关。
HIF-1α 在体外可促进间充质干细胞产生更多的碱性磷酸酶(ALP)、骨钙素(OCN)、核心结合蛋白因子2(RUNX-2)等成骨标志物。同时 HIF-1α 过表达时,且在成骨诱导的条件下可生成更多的钙结节、碱性磷酸酶,从而证明 HIF-1α促进间充质干细胞向成骨细胞分化[16]。本研究的X线和MRI结果可以看到,联合治疗组较单纯组、对照组治疗后坏死区域骨密度增加,坏死面积减小,这可能与成骨细胞分化增加有关。众所周知,HIF-1α是血管内皮生长因子(VEGF)上游基因,HIF-1α过表达增强VEGF在干细胞中表达[17]。促进血管形成能力最强的生长因子是VEGF,诱导新生血管的形成[18-21]。HIF-1α与多种细胞因子共同相互作用,更好地促进形成完整的新血管[22-23]。本研究显微CT结果可以看到联合治疗组较单纯组、对照组的坏死区域出现大量新生毛细血管网,这可能与HIF-1α过表达后增强VEGF的表达,从而促进新生血管的形成有关。Murata等[24]研究发现低氧状态下诱导HIF-1α表达,激活其下游相关基因,刺激破骨细胞形成,包括血管生成肿瘤坏死因子、素样蛋白4、血管内皮生长因子、白细胞介素等。低氧不仅能够影响破骨细胞的生成,还可影响破骨细胞功能。Hulley等[25]对基因敲除小鼠破骨细胞的前体细胞进行相关研究,发现通过抑制调节性脯氨酰4羟化酶(PHD)可以促进HIF表达并诱导破骨细胞生成,并证实其能促进成熟破骨细胞的骨吸收。
以上研究表明激活HIF-1α信号通路能上调VEGF、碱性成纤维细胞生长因子(FGF-2)、血小板衍化生长因子(PDGF)等成血管因子的表达,诱导血管长入,骨折的愈合至关重要的条件是具备良好的血供及血管生成能力。
本研究结果表明,通过HIF-1α慢病毒加股骨头髓芯减压治疗后,实验兔的早期激素性股骨头坏死均能够得到较好修复,然而单纯股骨头髓芯减压治疗,其恢复效果不理想,未接受任何治疗的实验兔均未得到较好修复。且通过HIF-1α慢病毒加股骨头髓芯减压治疗后股骨头坏死区域血管组织生长丰富,提示HIF-1α 转染的组织在体内具有更强的成血管能力,这可能是由于它能够分泌更多的VEGF。VEGF 能促进血管内皮细胞的增殖、迁移和成管能力,同时抑制内皮细胞的凋亡。它还能促进内皮祖细胞的迁移,并参与血管的形成。
综上所述,本研究将含HIF-1α基因的慢病毒载体注射到早期兔股骨头坏死区域,较好地将坏死区域的组织修复,可能较单纯的髓芯减压术可更有效地促进局部血运重建、骨组织的修复和再生,并能够促进髋关节功能恢复的更加完善。

