血必净对免疫抑制脓毒症模型的保护作用
张晶晶,孔宪斌,霍景瑞,王蕾,刘颖,陈锋,杨晓晖,田毅,孙世中,陈旭义,黄梦强,刘英富△
脓毒症是公认的世界性难题[1],且治疗费用非常高昂[2]。随着年龄的增长,老年人出现免疫低下等状况,可能会导致脓毒症的发病率增加[3]。免疫功能降低是脓毒症的重要发病因素,而现有研究在评估药物或新的治疗手段时忽视了免疫抑制的起始因素,直接采用正常动物进行造模实验,与临床脓毒症发病过程相脱节[4],这可能是导致目前脓毒症有效治疗药物或技术推进缓慢的重要原因[5]。本研究围绕脓毒症发病过程,构建了模仿脓毒症发病前免疫低下状态的新模型,为评估新模型,观察了经典脓毒症药物血必净对新型免疫抑制脓毒症模型的治疗效果。
1 材料与方法
1.1 材料
1.1.1 实验动物 雄性BALB/c小鼠,清洁级,6~8周龄,体质量22~30 g,购自解放军军事医学科学院实验动物中心[北京,中国SCXK-(军)2012-0004]。小鼠于无病原体的环境中,自由进食饮水,室内温度(22±2)℃,人工光暗周期12 h,所有实验均遵循武警后勤学院附属医院动物伦理规范。
1.1.2 试剂与仪器 环孢素A购买于美国Med Chem Express公司;血必净注射液购自天津红日药业股份有限公司;肝素钠注射液购自山东惠诺药业有限公司;大肠杆菌CMCC44102购自广东环凯微生物科技有限公司;小鼠肿瘤坏死因子(TNF)-α、白细胞介素(IL)-6酶联免疫吸附试验(ELISA)检测试剂盒购自北京四正柏生物科技有限公司;红细胞裂解液购自美国Solarbio公司;兔抗小鼠HMGB1抗体购自英国Abcam公司;兔抗小鼠β-Tubulin抗体、辣根过氧化物酶标记羊抗兔抗体购自北京康为世纪生物科技有限公司;ECL发光液购自Millipore公司。抗小鼠CD3-FITC单克隆抗体、抗小鼠CD4-PE单克隆抗体、抗小鼠CD8-PerCP单克隆抗体购自美国BioLegend公司。电热恒温培养箱(上海喆图科学仪器有限公司),FACS CantoTMⅡ型流式细胞仪(美国BD公司),全自动生化分析仪(美国Beckman Coulter公司),Western blot电泳仪、转膜仪(美国Bio-Rad公司),化学发光凝胶成像系统(美国Aplegen公司)。
1.2 方法
1.2.1 细菌悬浮液的制备及浓度测定 将大肠杆菌44102接种于100 mL的无菌培养基中,在37℃、200 r/min的摇床上培养12 h,随后分别在培养基中取1 mL进行稀释,稀释梯度为10倍,稀释到10-9倍。在10-5~10-9稀释倍数中各取500 μL倒入装有无菌琼脂培养基的培养皿中,并顺时针转动培养皿,使菌液充分平铺,随后倒置37℃培养箱内培养12 h。将培养12 h的培养皿取出,计平板的细菌菌落形成单位(clonal formation unit,CFU),推算出原液中每毫升的细菌菌落形成数量(clonal formation unit/milliliter,CFU/mL)。
1.2.2 分组造模 雄性BALB/c小鼠152只,使用随机数字表法将小鼠分为对照(Control)组,免疫抑制(IM)组,免疫抑制脓毒症模型(ISM)组和血必净治疗(XT)组,每组各38只。IM组:小鼠禁食12 h后,沿下腹正中线旁边腹腔注射环孢素A进行免疫抑制,剂量为25 mg/kg,隔日1次,共3次[6-7]。ISM组免疫抑制小鼠后腹腔注射300 μL浓度为1×109CFU/mL的大肠杆菌44102;XT组免疫抑制脓毒症造模后30 min,腹腔注射血必净4 mL/kg[6],30 min后按相同剂量重复注射血必净1次;Control组腹腔注射等体积的生理盐水。
1.2.3 流式细胞法测定CD3+CD4+、CD3+CD8+以及CD4+/CD8+造模12 h,各组取10只小鼠,通过取眼球法采血,肝素钠抗凝,加入红细胞裂解液处理10 min,至外周血无色清透,1 500 r/min离心5 min。取外周血分别加入抗小鼠CD3-FITC单克隆抗体、抗小鼠CD4-PE单克隆抗体、抗小鼠CD8-PerCP单克隆抗体。剧烈震荡后,置于4℃冰箱孵育30 min,加入Hanks液洗涤离心,定容并上流式细胞仪检测。在前散射光(FSC)和侧散射光(SSC)散点图中,设定淋巴细胞门,然后对淋巴细胞做PerCP、FITC、PE荧光强度检测。使用流式细胞仪检测CD3+CD4+、CD3+CD8+,并用Flowjo软件对数据进行处理。
1.2.4 血细菌培养 造模8 h,各组取4只小鼠,小鼠眼眶静脉丛无菌取血,肝素抗凝,各血液标本10倍稀释后分别取0.5 mL均匀涂布于LB固体平板,37℃孵育18 h,统计菌落数并拍照,最终的计量单位为菌落形成单位(CFU)。
1.2.5 炎症因子检测 造模12 h,各组取10只小鼠,通过取眼球法采血,离心后取血清置于EP管中,-80℃冻存待测,ELISA法检测炎症因子TNF-α和IL-6水平。
1.2.6 蛋白质免疫印迹试验(Western blot) 造模12 h,各组取4只小鼠,通过取眼球法采血,离心后取血清置于EP管中,小鼠血清经生理盐水适当稀释并用还原上样缓冲液处理后,经12%聚丙烯酰胺凝胶电泳分离,应用湿式电转移法将胶上的蛋白转移至预先处理好的PVDF膜上;PVDF膜经5%脱脂奶粉室温封闭2 h;封闭结束后,用PBS洗膜3次,加入兔抗小鼠HMGB1抗体(1∶1 000稀释),室温孵育90 min;用PBST(内含0.05%Tween-20)洗膜3次,每次10 min;加入羊抗兔IgG/HRP(1∶5 000稀释),室温孵育1 h,PBST洗膜3次,每次10 min;暗室内加显色底物显色曝光并扫描成像。同时以β-Tubulin为内参进行校准。实验结束后,利用Image J图像分析软件计算条带灰度值,以目的条带与内参条带灰度值的比值反映目的蛋白的表达水平。
1.2.7 肝肾功能检测 造模12 h,各组取10只小鼠,通过取眼球法采血,离心并吸取上清液于干净的EP管中,使用自动生化分析仪检测血清中丙氨酸转氨酶(ALT)、天冬氨酸转氨酶(AST)、尿素氮(BUN)和血肌酐(CR)水平。
1.3 统计学方法 采用SPSS 20.0软件进行统计分析。计量资料以均数±标准差(±s)表示,2组间比较采用独立样本t检验,多组间比较采用单因素方差分析,组间多重比较用Tukey法,P<0.05为差异有统计学意义。
2 结果
2.1 各组CD3+CD4+/CD3+CD8+比值 与Control组比较,IM组和ISM组的CD3+CD4+/CD3+CD8+明显下降(P<0.05),与ISM组相比,XT组CD3+CD4+/CD3+CD8+明显升高(P<0.05),见图1。

Fig.1 Comparison of CD3+CD4+/CD3+CD8+between four groups图1 各组CD3+CD4+/CD3+CD8+的比较
2.2 血必净干预后血细菌培养情况Control组和IM组小鼠血液中未检出细菌,XT组与ISM组相比,细菌培养明显减少[(246.75±61.15)CFUvs.(1 726.00±363.52)CFU,t=8.026,P<0.01]。
2.3 各组IL-6、TNF-α水平变化 与Control组比较,ISM组和XT组释放IL-6和TNF-α增多(P<0.05);与ISM组相比,XT组释放IL-6和TNF-α减少(P<0.05);Control组与IM组差异无统计学意义,见表1。
Tab.1 Comparison of IL-6 and TNF-α between four groups表1 各组IL-6、TNF-α的比较 (n=10,±s)

Tab.1 Comparison of IL-6 and TNF-α between four groups表1 各组IL-6、TNF-α的比较 (n=10,±s)
**P<0.01;a与Control组比较,b与ISM组比较,P<0.05
组别Control组IM组ISM组XT组F IL-6(ng/L)68.98±4.70 65.39±3.93 87.85±5.08a 82.39±2.35ab 66.408**TNF-α(ng/L)11.94±2.38 10.23±1.71 23.51±2.63a 20.30±1.74ab 88.944**
2.4 各组HMGB1表达水平 与Control组比较,ISM组HMGB1表达水平升高(P<0.05);与ISM组相比,XT组HMGB1表达水平明显下降(P<0.05);Control组与IM组差异无统计学意义,见图2。
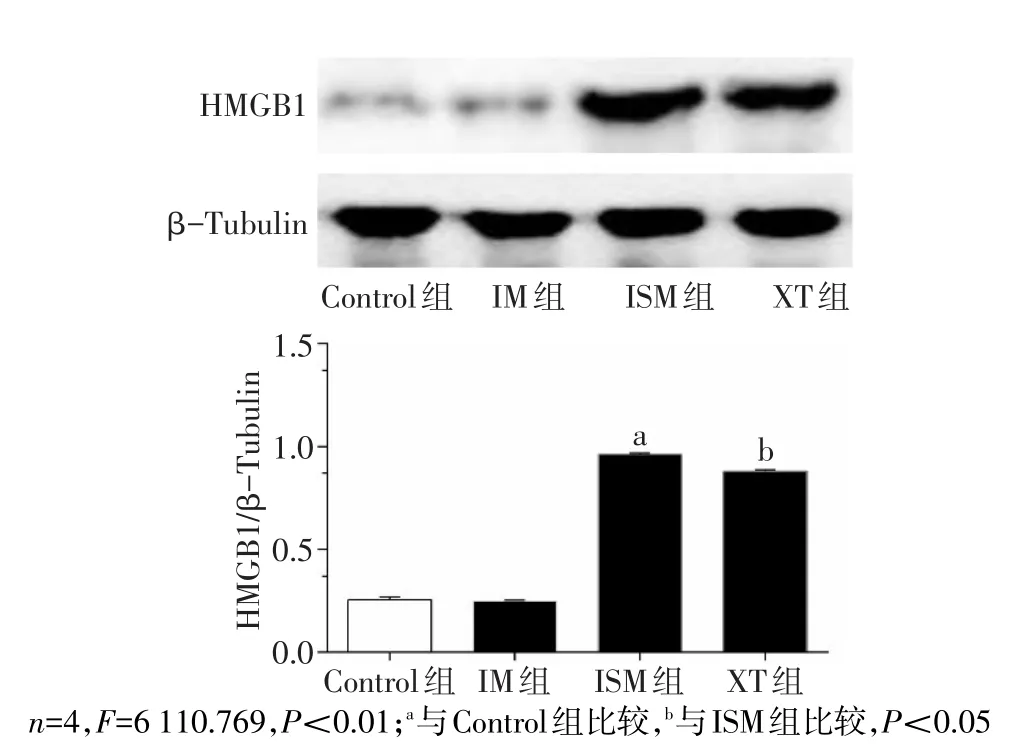
Fig.2 Comparison of HMGB1 between four groups图2 各组HMGB1的比较
2.5 各组肝肾功能比较 与Control组比较,ISM组的ALT、AST、BUN、CR显著升高(P<0.05);与ISM组比较,XT组ALT、AST、BUN、CR明显降低(P<0.05);Control组与IM组差异无统计学意义,见表2。
3 讨论
流行病学显示严重脓毒症和脓毒症休克主要集中在老年患者,因脓毒症死亡的人群中,65岁以上患者约占80%[8]。免疫低下和老年人脓毒症高发息息相关,目前有很多脓毒症的治疗方法都在动物研究转化到临床推进中失败[9-10]。动物模型不能完全模仿临床患者是重要因素之一。因此模拟免疫功能抑制的脓毒症动物模型制备研究,对脓毒症新型治疗方法的研发与评估,解决脓毒症免疫调节治疗方法的争论具有重要意义。
Tab.2 Comparison of ALT,AST,BUN and CR between four groups表2 各组ALT、AST、BUN、CR的比较 (n=10,±s)
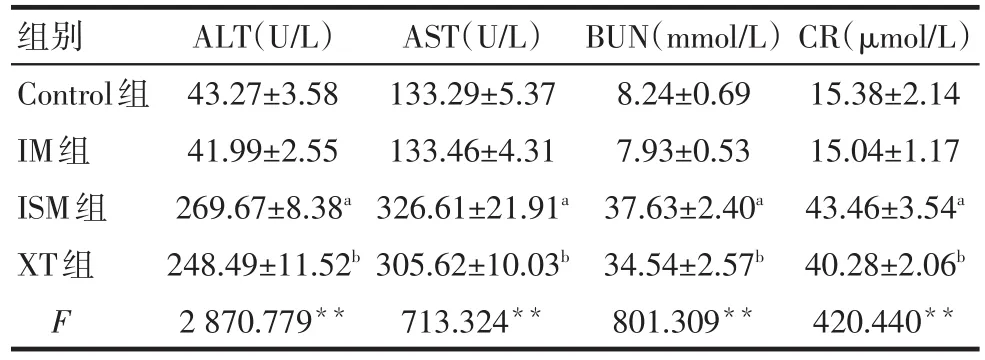
Tab.2 Comparison of ALT,AST,BUN and CR between four groups表2 各组ALT、AST、BUN、CR的比较 (n=10,±s)
**P<0.01;a与Control组比较;b与ISM组比较,P<0.05
组别Control组IM组ISM组XT组F ALT(U/L)43.27±3.58 41.99±2.55 269.67±8.38a 248.49±11.52b 2 870.779**AST(U/L)133.29±5.37 133.46±4.31 326.61±21.91a 305.62±10.03b 713.324**BUN(mmol/L)8.24±0.69 7.93±0.53 37.63±2.40a 34.54±2.57b 801.309**CR(μmol/L)15.38±2.14 15.04±1.17 43.46±3.54a 40.28±2.06b 420.440**
环孢素A常作为免疫抑制模型制备的药物[11],已在人转移结肠癌模型等[12-13]研究中得到广泛应用,而有关免疫抑制脓毒症模型制备方面的研究,目前鲜见相关研究报道。本实验发现,小鼠通过腹腔注射环孢素A后,CD3+CD4+/CD3+CD8+比值明显低于对照组,抑制了小鼠免疫系统,成功模拟了脓毒症发病前免疫抑制状态,在此基础上腹腔注射大肠杆菌后成功制备脓毒症模型。本研究将免疫抑制这一脓毒症发病关键因素考虑在内而制备的新型实验动物模型,更贴近临床脓毒症发病实际,在一定程度上减少了脓毒症无效研究的发生,提高了基础研究向临床转化的效率[14]。
为进一步验证模型的评估效果,本研究选择了目前临床常用的药物血必净进行干预研究,结果提示,ISM组的CD3+CD4+/CD3+CD8+的比值低于对照组,出现明显免疫抑制;与ISM组相比,经血必净干预后,XT组CD3+CD4+/CD3+CD8+的比值升高,提示血必净能够调节免疫抑制;与ISM组相比,经血必净治疗后,XT组血细菌培养数量明显下降。血必净注射液由赤芍、川芎、丹参、红花、当归等组成,其化学成分中含有红花黄色素A、川芎嗪、丹参素、阿魏酸、芍药苷等21种化合物[15],是具有活血化瘀、疏通经络、溃散毒邪功效的复方中药制剂。本研究结果也表明其能够调节免疫功能,对抗细菌,降低内毒素水平。
本研究提示,与ISM组比较,经血必净治疗后XT组TNF-α、IL-6、HMGB1释放明显减少,说明血必净能够减少免疫抑制脓毒症小鼠炎症因子的分泌。与Control组比较,ISM组和XT组的小鼠AST、ALT、BUN、CR显著升高,提示2组小鼠均出现了肝脏、肾脏的急性损伤。与ISM组相比,血必净治疗后的XT组肝肾损伤相对较轻。早期促炎因子IL-6,TNF-α导致脓毒症是引发炎症过程、氧化应激和多器官损伤的关键介质,晚期炎症因子HMGB1是介导器官损伤一种重要的细胞因子,且能够与炎症细胞因子相互作用[16]。血必净干预后,减少了HMGB1、IL-6、TNF-α的释放,减少炎性渗出,改善微循环,保护血管内皮细胞,有效减少损伤因子对机体重要器官的损害[17-18]。上述结果提示血必净对免疫低下脓毒症模型的疗效确切,能够改善小鼠的预后,新型免疫抑制脓毒症模型也表现出了贴近临床的治疗效果,同时为血必净适用于老年脓毒症患者提供了理论基础。
目前脓毒症的治疗仍面临无特异性诊断方法、靶向药物缺乏、炎症反应、免疫损害、凝血功能紊乱等复杂问题。免疫抑制新型脓毒症动物模型的深入研究可能会为探寻脓毒症治疗方法研究,提供新的评判标准。

