缺乏维生素D受体激活及CYP27B1代谢调控在心肾综合征中的作用
王蕾,孙凤姣,李旭
天然维生素D(vitamin D,VitD)包括Vit D2和Vit D3,均无生物活性,必须在体内经过连续的转化才能成为活性VitD分子,即1,25-二羟维生素D3[1,25(OH)2D3]。肾脏近曲小管上皮细胞的25-羟基维生素D-1α-羟化酶(CYP27B1)是VitD代谢过程中的关键酶,可催化25-羟基维生素D3[25(OH)D3]转化为1,25(OH)2D3,从而调节循环血液中活性VitD水平[1-3]。活性VitD主要通过与维生素D受体(vitamin D receptor,VDR)结合发挥其生物学效应。VDR除了在肾脏表达外,还广泛表达于心血管系统[4]。近年来发现,VitD和VDR激活缺乏不仅与肾脏疾病的发生发展关系密切,而且对心血管系统疾病也有重要影响[5],可能成为治疗心肾综合征(cardiorenal syndrome,CRS)的潜在靶点。本文主要就VDR和CYP27B1的代谢调控在CRS中的研究进展作简要综述。
1 VDR的生物学特征
1.1 VDR的分布和类型VDR是介导活性VitD发挥生物效应的生物大分子,属于类固醇激素/甲状腺激素受体超家族中的一员,广泛分布于体内各组织细胞中,在传统的靶器官,如肠道、肾脏、骨骼分布最多。另外,心血管系统的主要细胞类型中均有一定的表达,如血管平滑肌细胞、内皮细胞、心肌细胞、多种免疫细胞和血小板[4]。
VDR由膜受体(membrane VDR,mVDR)和核受体(nuclear VDR,nVDR)两大类组成。1,25(OH)2D3由VDR诱导结合血浆内维生素D结合蛋白(vitamin D binding protein,BDP),循环到不同的靶组织,从而通过“基因组”和“非基因组”两种方式来介导其内分泌的功能[6-8]。活性Vit D与mVDR结合后,能在极短的时间内迅速引发下游信号转导事件,属于非基因组效应,主要发挥经典的钙磷调节作用;而nVDR本质上是一种配体依赖性的核转录因子,其与DNA反应元件相互作用产生基因效应,参与调节细胞增殖、分化、凋亡、氧化应激、膜转运、细胞外基质稳态、细胞黏附及免疫调节等非钙磷调节作用[4]。
1.2 VDR的分子结构 人类VDR基因位于第12号染色体上,长度大于100 kb。由8个外显子以及至少6个内含子组成[1,5]。VDR分子由427个氨基酸组成,依据氨基酸N端到C端的序列可分为A~F六个功能区,依次为A/B区(转录激活功能区,包含激活功能结构域,activation function,AF-1),C区(DBD区,DNA binding domain),D区(铰链区,hinge region),E/F区(LBD区,ligand binding domain,该区包含有AF-2),每个功能区分工不同但又相互协作[9-10]。其中,N端高度保守的DBD区和C端可变的LBD区是VDR的两个核心功能结构域,两者由铰链区进行衔接[9-11]。DBD区为DNA结合区,包含两个锌指结构,每个锌离子与4个半胱氨酸残基构成四面体结构,其中残基参与识别靶基因上的维生素D反应元件(vitamin D response elements,VDREs)。LBD区为配体结合区,由12个α-螺旋(α helices,H1-H12,AF2对应于H12)和3个β折叠(β sheets,S1-S3)组成,主要包含配体结合口袋和二聚体形成区域。1,25(OH)2D3与核内nVDR结合后,使nVDR磷酸化并发生构象改变后吸引核内维甲类X受体(retinoid X receptor,RXR),形成VDR-RXR异二聚体,进而与靶基因上游启动子区的VDREs相互作用,从而引起各种相应的生物学效应[11]。
1.3 VitD生物活性的检测 目前,VitD的体外活性检测方法主要包括高效液相色谱法、液相色谱-串联质谱法(LC-MS)、酶联免疫吸附测定法(ELISA)、化学发光免疫测定法(CIA)、单荧光实时定量PCR和双重实时荧光定量PCR等[12-13]。相比较而言,在体外细胞水平上,荧光素酶报告基因技术可更直观地监测细胞内1,25(OH)2D3与基因表达有关的信号级联。然而,细胞转染时对目的基因片段进行扩增会增加其与转录因子的结合效率,所获得的生物活性往往比实际要高。而在生理状态下,由于染色质高级结构的存在,这段DNA很可能并不与其相对应的转录因子相结合,是没有功能的[14]。另外,VDREs存在众多可变序列和VDR亲和力谱,这种可变性使得采用单一传统生物学方法已经很难真实地反映VDREs的转录活性[14]。近年来发展的染色质免疫共沉淀技术(chromatin immunopreciptation assay,ChIP)与芯片(chip,microarray)或测序(sequencing)相结合的ChIP-chip和ChIP-seq技术能在全基因组范围内识别生理状态下某个DNA结合蛋白与DNA序列的结合位点,从而反映体内真实的基因表达调控情况[11,15]。Pike等[11]采用ChIP-chip技术确定了1,25(OH)2D3诱导1,25-二羟维生素D3-24-羟化酶(CYP24A1)基因表达的转录活性受多个增强子的影响,这些增强子无方向性,不仅位于启动子近端,并且位于启动子远端和CYP24A1基因下游区域,均可通过启动子来增加转录活性。Meyer等[2]研究表明1,25(OH)2D3抑制CYP27B1基因表达,并进一步采用ChIP-seq方法确定了转录因子结合的启动子区域,而1,25(OH)2D3调控CYP27B1基因的转录模式表现为肾脏组织特异性,在肾外来源细胞未观察到类似的调控模式。相比而言,ChIP-chip和ChIP-seq技术可以找出1,25(OH)2D3调控不同靶基因启动子区的DNA序列结合位点,并结合计算生物学技术推测这个过程中起关键作用的转录因子,为预防与1,25(OH)2D3相关的各种疾病提供了依据。
2 CYP27B1在VitD代谢通路中的作用
人类的CYP27B1基因含有9个外显子,长度大于5 kb。CYP27B1由细胞色素P450、铁硫蛋白(又称铁氧还蛋白)和黄素蛋白(又称铁氧还蛋白还原酶)3个成员组成,主要存在于肾脏近曲小管上皮细胞线粒体中[1]。CYP27B1将25(OH)D3C-1位羟基化形成1,25(OH)2D3,其是VitD在体内的活化形式。实验研究表明,CYP27B1基因突变失活或敲除小鼠能够诱发Ⅰ型维生素D依赖性佝偻病(vitamin D dependency rickets type 1,VDDRⅠ,也被称作假性维生素D缺乏性佝偻病)。与此同时,给予充足VitD喂养的小鼠仍然表现出血清1,25(OH)2D3缺乏、低血钙和继发性甲状旁腺功能亢进症(secondary hyperparathyroidism,SHPT),提示CYP27B1对于维持循环血液中活性VitD水平具有重要作用[1-2,16]。
CYP27B1主要在肾脏以及孕期胎盘表达,此外皮肤、免疫系统等肾外区域中也存在少量表达。如在干扰素γ(interferon-γ,IFN-γ)和脂多糖(lipopoly⁃saccharides,LPS)的免疫刺激下,巨噬细胞活化诱导CYP27B1基因上调,从而促进1,25(OH)2D3生成,而血清1,25(OH)2D3升高对巨噬细胞CYP27B1表达无影响[1]。此外,癌细胞、甲状旁腺等也可检测到CYP27B1表达。然而,除肾脏和胎盘以外,体内其他部位CYP27B1的表达及活性在正常生理状态下对相应部位功能是否有影响仍需进一步确认。
CYP27B1的表达受到多种因素的调节,包括钙离子水平、甲状旁腺激素(parathyroid hormone,PTH)和1,25(OH)2D3[1-2]。低钙血症引起PTH升高能够诱导肾脏组织中CYP27B1转录,导致1,25(OH)2D3生成增多,而1,25(OH)2D3升高反过来又抑制CYP27B1的表达。除了钙离子水平、PTH和1,25(OH)2D3外,成纤维细胞生长因子23(fibroblast growth factor 23,FGF-23)也参与了CYP27B1基因表达的调控。在肾脏组织中,FGF-23可高度抑制CYP27B1基 因 的表达[17],从而减少循环1,25(OH)2D3水平。Meyer等[2]发现,上述因素对CYP27B1基因的转录模式调控选择性存在于肾脏组织,而在肾外来源的细胞可能存在其他调控方式。
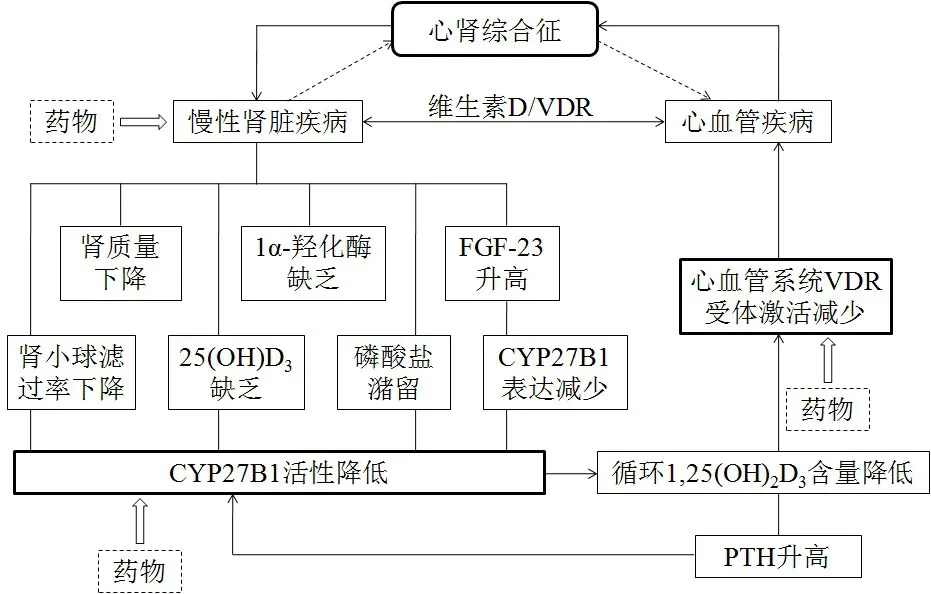
Fig.1 The role of CYP27B1 and VitD/VDR in the cardiorenal syndrome图1CYP27B1、VitD和VDR在心肾综合征中的作用
3 VitD/VDR及CYP27B1与CRS
3.1 VitD/VDR与慢性肾脏病 慢性肾脏病(chronic kidney disease,CKD)中普遍存在VitD缺乏,随着病情的加重,并发VDR减少及敏感性减低,即导致VitD抵抗[5,17]。导致VitD缺乏的原因如下[5,18-19]:首先是由于肾体积的减小、磷酸盐潴留、肾功能障碍,特别是肾小球滤过率(glomerular filtration rate,GFR)下降至60 mL/min时导致肾脏1α-羟化酶活性降低;其次,25(OH)D3被催化转化为代谢失活产物24,25(OH)2D3增多,而还原产物1,25(OH)2D3减少;再者,近年来研究报道血清FGF-23浓度在CKD进展的早期即升高,FGF-23可高度抑制CYP27B1基因的表达[17],使得1,25(OH)2D3生成减少。总之,上述多种因素共同造成了CYP27B1活性降低,进而导致循环中内源性1,25(OH)2D3的产生受限(见图1)。而肾外其他组织合成对于循环1,25(OH)2D3的水平影响甚小。1,25(OH)2D3减少又可刺激甲状旁腺细胞分泌PTH增多,而PTH升高反过来又抑制CYP27B1基因的表达,继而导致1,25(OH)2D3合成障碍,形成恶性循环。此外,肾脏本身作为VitD的主要靶器官,VitD缺乏及其受体抵抗不仅导致钙磷代谢紊乱及骨营养不良,且加速肾小球纤维化及肾小管硬化,进而加重肾脏病的进展。
目前,活性VitD相关制剂帕立骨化醇(paricalcitol)和度骨化醇(doxercalciferol)已被批准用于治疗CKD相关的SHPT。与传统制剂相比,该类VitD类似物可选择性地降低血清PTH水平,因而不影响钙磷吸收,无升高血钙的不良反应[1]。Han等[20]通过Meta分析证实paricalcitol能有效抑制未透析CKD患者的PTH分泌,也能显著减少糖尿病CKD患者蛋白尿水平,该研究进一步指出paricalcitol治疗组患者钙磷代谢产物显著升高且具有高钙血症的发展趋势,提示应用paricalcitol的患者预后存在血管钙化的风险。因此,临床CKD患者使用VitD活性制剂的早期生化指标的变化,包括PTH、钙、磷、25(OH)D3和1,25(OH)2D3水平只能反映疗效的一个侧面,还应该在前瞻性随机对照试验中关注长期的预后过渡指标(如血管钙化、骨密度和组织学)以及终点指标(心血管疾病、死亡率和骨折等)来反映疗效的全面性[1]。
3.2 VitD/VDR与心血管疾病VitD与分布于心血管系统VDR结合,可调控与细胞的增殖、分化、凋亡、氧化应激、膜转运、细胞外基质稳态和细胞黏附相关基因的表达,通过多通路的调节来减少心血管疾病的发生率和死亡率[4]。研究表明,VitD可以通过调节其他信号通路,如肾素、一氧化氮(NO)信号等,参与心血管疾病的发生发展。一方面,VitD缺乏可以激活肾素-血管紧张素内分泌系统,该信号系统在调控外周血管阻力方面起重要作用。当诱导VDR或CYP27B1敲除时,小鼠血清肾素和血管紧张素Ⅱ(angiotensinⅡ,AngⅡ)水平显著升高,诱导高血压和心脏肥大[21-22]。另一方面,血钙正常的VDR缺失小鼠表现出血管内皮功能障碍,其机制与NO合成酶表达减少、造成NO的生物利用度降低有关[23]。通过特异性敲除内皮细胞VDR,发现内皮型NO合酶(NOS)表达减少,引起舒张功能受损,导致内皮功能障碍[24],且这种作用机制不依赖于肾素-血管紧张素系统的改变。此外,VDR缺失小鼠可表现出血栓前状态,其机制与抗凝血酶和血栓调节蛋白生成减少有关[25]。研究显示,VDR激动剂能改善CKD大鼠心功能并减少心肌纤维化[26],也可拮抗高盐饮食大鼠心肌肥厚[27],而心肌特异性敲除VDR小鼠表现出左室肥厚[28]。这些结果进一步证明VDR激动剂可通过多信号多环节调控对心血管系统疾病起到保护作用。
临床流行病学研究也证实了VitD缺乏与心血管疾病的危险因素,如高血压、胰岛素抵抗、代谢综合征、糖尿病等密切相关。Vit D低水平状态可触发炎性级联反应,诱导内皮功能障碍,促进动脉硬化,从而增加患心血管系统疾病的风险。然而,最近的随机对照试验研究显示,VitD对心血管疾病危险因素的影响不一致,尚不能确定补充VitD与心血管事件下降之间的关系[1]。因此,通过补充VitD以降低人群患心血管疾病风险的方法尚未纳入常规疗法。
3.3 CYP27B1、VitD和VDR与CRS心血管疾病和肾脏病常合并存在并相互影响,互为因果,这两者共存的状态称为CRS[5,29]。CRS的病理生理学机制错综复杂,迄今尚未完全阐明。目前普遍认可的机制主要包括肾素-血管紧张素-醛固酮系统(renninangiotensin-aldosterone system,RAAS)过度激活、炎症反应、NO/活性氧(NO/ROS)失衡、交感神经系统(SNS)过度兴奋及贫血等方面[5]。然而目前针对相关的信号通路所采取的干预措施并不能完全缓解CRS。这提示可能还存在其他机制参与了CRS的病理生理调控。
近年来研究发现,1,25(OH)2D3/VDR信号途径也参与了CRS的病理生理调控[5]。循环中90%以上的内源性1,25(OH)2D3必须经由肾脏CYP27B1的羟化作用而产生。CRS时,肾功能进行性损伤导致肾小管上皮细胞1α-羟化酶活性降低,1,25(OH)2D3生成减少,并继发VDR减少。由于VitD/VDR信号的心脏保护作用遭到破坏,诱发如高血压、动脉粥样硬化、糖尿病等心血管危险因素发生,导致心血管疾病的发生率增加,从而加重CRS的进展。
肾组织CYP27B1基因的转录调控模式与肾外其他组织不同[2],这使得选择性激活肾脏CYP27B1表达成为可能。肾脏CYP27B1表达上调后,1α-羟化酶活性增强,从而使循环血液中活性VitD水平升高。1,25(OH)2D3再与肾脏和心血管受体广泛作用,对CRS发挥间接保护作用。因此,CYP27B1和VDR可能成为联系肾脏和心脏疾病的重要靶点,即肾脏选择性CYP27B1激动剂可能成为治疗CRS的极具潜力的新型药物。在中医药研究领域,已证实具有补肾活血作用的药方在调节VDR环节起到确切作用。笔者课题组前期研究表明,冠脉通片全方有明显升高1,25(OH)2D3效果,同时对CYP27B1和VDR蛋白表达均有增加作用,冠脉通片通过促进CYP27B1表达,升高循环1,25(OH)2D3水平,从而间接或直接激活VDR的表达,是其对肾阳虚心肌梗死模型大鼠产生心肾保护作用的机制[30]。最新研究表明,淫羊藿苷可提高D-半乳糖致衰老大鼠肾脏CYP27B1和VDR的mRNA表达水平,提示淫羊藿苷抗衰老作用与增高VitD活性有关[31]。
流行病学调查显示,VitD缺乏与CKD患者的心血管疾病发病率和死亡率密切相关[32-33]。CKD患者应用VitD补充剂(主要为Vit D3)能延缓病情进展并提高生存率[33]。然而,旨在阐明VitD补充剂在心脏保护方面作用的前瞻性研究尚未取得统一的结论。近年来一项来自妇女健康倡议的研究指出,绝经后妇女采用VitD联合钙剂进行治疗不能降低心肌梗死和冠心病的致死风险[33]。另有研究表明,CKD患者口服paricalcitol后,左心室质量指数并未减少[34],但左心房容积和脑利钠肽(brain natriuretic peptide,BNP)的水平显著降低[35]。尽管如此,已有大量临床研究证实VitD补充剂可降低CKD患者心肾共同损伤标志物——尿蛋白的含量,结果提示进一步探究VitD作为RAAS阻断剂的补充疗法治疗CRS具有重要意义[33]。
4 小结
目前,CRS仍然是医学界待攻克的难关。VitD/VDR信号与CRS的发生发展关系密切。目前,临床已经应用VitD补充疗法及其类似物治疗CRS,对延缓CRS的进展、降低CRS的死亡率具有重要意义[5]。CYP27B1是活性VitD产生的代谢调控关键酶,也是CRS发生发展过程中病理生理学机制的关键点。近年来研究发现,肾组织CYP27B1基因的转录调控模式与肾外其他组织不同[2],这种组织特异性的基因调控模式使得选择性激活肾脏CYP27B1基因表达成为可能,是具有重大研究价值和发展潜力的药物靶点,尤其对CRS患者,但仍需更多的基础研究及临床试验进一步证实。

