miR-146a在大鼠缺血再灌注肝损伤中的表达及作用*
晏春根, 朱冬芳
(绍兴文理学院附属医院 1消化内科, 2检验科, 浙江 绍兴 312000)
肝脏外科手术中,常常需要肝门阻断以控制和减少出血,当肝脏恢复血供后不可避免发生缺血再灌注(ischemia-reperfusion,I/R)损伤。缺血再灌注损伤的发病机制虽然复杂,但所有的病理过程都有一个共同的信号途径——Toll样受体信号通路,后者在缺血再灌注损伤后的级联信号网络中发挥关键性的调节作用[1]。缺血再灌注损伤中虽然并不存在明显的外源性感染,但却有典型的非感染性炎性损伤,这可能是缺血再灌注后组织细胞释放热休克蛋白、脂肪酸、透明质酸降解片断和内源性DNA片段等多种分子,这些分子可作为内源性配体被Toll样受体识别而启动炎性应答,产生致炎细胞因子,从而导致缺血再灌注肝损伤[2-3]。因此,调控Toll样受体信号通路可能有助于减弱缺血再灌注的炎性损伤程度。
微小RNA(microRNA,miRNA)存在于各种生物体内,广泛调节细胞代谢、增殖、凋亡、分化和发育。目前已鉴定的人类miRNA约600余种,调控数千种靶基因mRNA的表达,众多的miRNA和靶基因之间形成的复杂功能网络,在免疫反应强度、时效性、细胞分化和功能调节等各环节发挥重要调控作用。miR-146a是参与炎性应答最重要的miRNA之一,多项研究表明,miR-146a能减少Toll样受体介导的核因子κB(nuclear factor-κB, NF-κB)信号通路炎性细胞因子分泌[4-6]。本研究探讨缺血再灌注肝损伤模型中miR-146a及Toll样受体炎性信号分子的表达变化及其与肝损伤的关系。
材 料 和 方 法
1 实验动物及主要试剂
72只健康雄性清洁级10~12周龄SD大鼠购于浙江大学医学院实验动物中心,许可证号为SCXK(浙)2016-0037,雌雄不限,体重220 g~250 g,给予标准饮食、(22±2)℃、12 h白天/黑夜循环、湿度(55±5)%的动物房饲养。Trizol购于Invitrogen;real-time PCR试剂盒购于Promega;Triton X-100蛋白裂解液购于Sigma;TaqMan MicroRNA检测试剂盒购于ABI;山羊抗大鼠β-actin、白细胞介素6(interleukin-6, IL-6)、肿瘤坏死因子α(tumor necrosis factor-α, TNF-α)和Toll样受体4(Toll-like receptor 4, TLR4)单克隆抗体及过氧化物酶标记的兔抗山羊IgG 抗体购于Santa Cruz Biotechnology;大鼠IL-6 ELISA试剂盒购于Stress Gen Biotechnologies;大鼠TNF-α ELISA试剂盒购于深圳晶美公司;其余试剂均购于上海生工公司。β-actin、TLR4、IL-6和TNF-α mRNA引物由上海生工公司合成。大鼠miR-146a与U6引物购于中国锐博公司。具体引物序列见表1。

表1 PCR引物序列
2 实验分组及标本采集
SD 大鼠随机分为3组(n=24),即肝缺血再灌注损伤组(I/R组)、假手术组(S组)和非手术组(N组)。I/R组:用2.5%戊巴比妥钠腹腔注射麻醉大鼠,上腹正中切口,切开腹壁各层,分离肝十二指肠韧带,暴露肝门部,用无创动脉夹阻断门静脉进入肝脏第1次分叉的远端,造成约70%肝脏缺血,保留动脉夹,关闭腹腔,45 min后恢复灌注;S组:用2.5%戊巴比妥钠腹腔注射麻醉大鼠,开腹、再关腹,不阻断肝叶供血; N组:大鼠正常饮食,实验前30 min大鼠尾静脉注入生理盐水,不开腹。
各组大鼠处理前(0 h)及经上述处理后2、12和24 h分别采集外周血及肝组织(各时点n=6),检测血浆ALT活性、TNF-α和IL-6含量及肝组织中TLR4、IL-6、 TNF-α和miR-146a mRNA及蛋白表达变化。
3 检测方法
3.1血浆丙氨酸转氨酶(alanine aminotransferase,ALT)活性的测定 ALT于TMS-1024全自动生化仪检测,操作按说明。
3.2ELISA法检测血浆IL-6和TNF-α含量 按说明书进行操作,于波长450 nm检测样本吸光度(A)值,分别用IL-6和TNF-α标准液绘制曲线,从曲线中得出各组大鼠血浆IL-6和TNF-α含量。
3.3总RNA抽提和real-time PCR检测TLR4、IL-6和TNF-α的表达水平 肝组织匀浆,Trizol抽提RNA,A-MV酶(禽类成髓纤维病毒逆转录酶)42 ℃逆转录为cDNA。扩增参数:94 ℃ 5 min;94 ℃ 40 s,56 ℃ 40 s,72 ℃ 90 s,35个循环;72 ℃ 5分钟。选取β-actin作为内参照,TLR4、IL-6和 TNF-α的相对表达量采用 2-ΔΔCt计算。
3.4miRNA-146a检测
3.4.1反转录 采用ABI公司TaqMan MicroRNA Reverse Transcription Kit和特异miRNA的茎环引物,所有操作均在冰上完成。15 μL的反应体系包括:0.15 μL的dNTP、1.0 μL的MutiScribe Reverse Transcriptase、1.5 μL的10×Reverse Transcription Buffer、0.19 μL的RNase Inhibitor及4.16 μL的Nuclease-free Water组成的Master Mix,再加上3 μL反转录茎环引物和5 μL RNA稀释样品。反应条件: 16 ℃ 30 min, 42 ℃ 30 min, 85 ℃ 5 min。
3.4.2Real-time PCR 采用TaqMan MicroRNA检测试剂盒。20 μL的反应体系包括:1.0 μL的TaqMan MicroRNA Assay(20×),1.33 μL的反转录产物,10.0 μL的TaqMan2×Universal PCR Master Mix和7.67 μL的Nuclease-free Water。在ABI7300定量PCR仪上扩增和检测,反应条件:95 ℃ 10 min,40个扩增循环(95 ℃ 15 s,60 ℃ 60 s)。选取 U6 snRNA作为内参照,miR-146a的相对表达量采用 2-ΔΔCt计算。
3.5蛋白质抽提及Western blot分析 肝组织加1%Triton X-100蛋白裂解液匀浆,离心,弃沉淀,上清液用冰磷酸盐缓冲液漂洗3次,离心,弃上清液,加50 μL 95 ℃ 2×Laemmli SDS缓冲液,将样本放沸水振荡水浴5 min,10% SDS-PAGE分离蛋白质。将蛋白转到尼龙膜上,将膜放入含5%脱脂牛奶的Tris-HCl缓冲液37 ℃孵育1 h。更换新鲜5%脱脂牛奶TBS溶液,加入山羊抗大鼠TNF-α (1∶2 000)、IL-6(1∶2 000)、TLR4(1∶2 000)和β-actin(1∶3 000)单克隆抗体,37 ℃孵育2 h,1%脱脂牛奶TBS溶液洗膜4次,每次15 min,分别加入过氧化物酶标记的兔抗山羊IgG(1∶2 000)室温振荡孵育1 h,压片、定影、显影、洗片。Tanon Gis 2.0软件半定量分析TNF-α、IL-6和TLR4与β-actin灰度比值。
4 统计学处理
以SPSS 13.0软件统计分析。数据以均数±标准差(mean±SD)表示,同一组不同时点多个均数比较采用单因素方差分析,同组内不同时点均数两两比较采用q检验;两组间同一时点均数比较采用两样本t检验,方差不齐时采用近似t检验。以P<0.05为差异有统计学意义。
结 果
1 血浆ALT活性及IL-6和TNF-α含量
N组大鼠各时点血浆ALT活性及IL-6和TNF-α含量均无显著变化;S组大鼠假手术后各时点血浆ALT活性虽然有升高,但与假手术前(0 h)比较无显著差异,而血浆IL-6及TNF-α含量却显著升高(P<0.05);I/R组大鼠在处理前的血浆ALT活性及IL-6和TNF-α含量与S组及N组比较均无显著差异,但缺血再灌注处理后大鼠血浆ALT活性及IL-6和TNF-α含量随时间延长逐渐增高,均显著高于S组及N组相应时点(P<0.01),见表2。
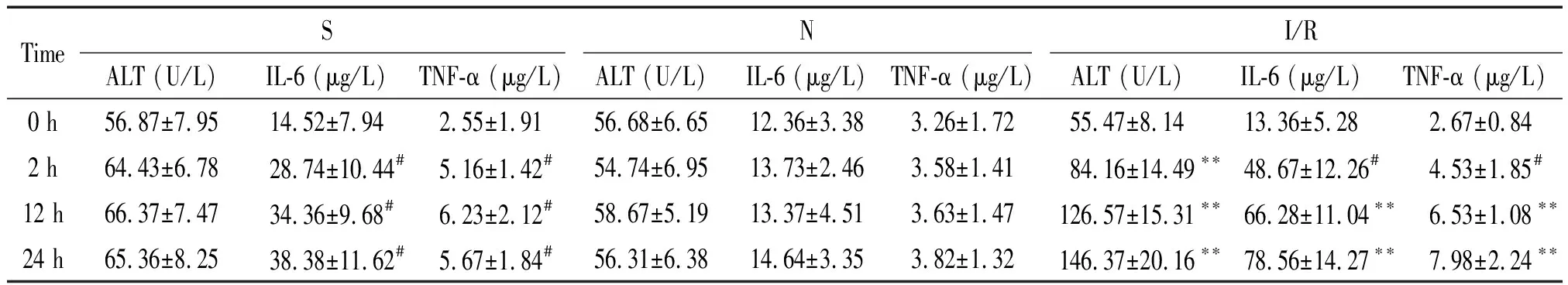
表2 各组大鼠不同时点血浆ALT活性及IL-6和TNF-α含量
#P<0.05vs0 h,**P<0.01vsS or N group.
2 各组大鼠肝组织TLR4、IL-6和TNF-α mRNA的表达
I/R组大鼠缺血再灌注后肝组织TLR4、IL-6和TNF-α的mRNA水平均较处理前(0 h)明显升高(P<0.01),虽然随着缺血时间的延长,TLR4、IL-6和TNF-α mRNA表达量有所下降,但始终高于0 h(P<0.01);而S组及N组大鼠肝组织各时点相关指标却无明显变化,见图1。
3 各组大鼠肝组织TLR4、IL-6和TNF-α蛋白的表达情况
I/R组大鼠肝组织TLR4、IL-6和TNFα的表达量在缺血再灌注后各时点均较缺血再灌注前(0 h)显著升高(P<0.01),其中2 h与12 h 3种蛋白的表达量无显著差异,而24 h则较2 h和12 h显著减少 (P<0.05);S组和N组大鼠肝组织各时点TLR4、IL-6和TNF-α的表达量无明显变化,见图2。

Figure 1. The liver tissue mRNA expression of TLR4, IL-6 and TNF-α at different time points in I/R (A), S (B) and N (C) groups. Mean±SD.n=6.**P<0.01vs0 h.
图1各组大鼠缺血再灌注不同时点肝组织TLR4、IL-6和TNF-α的mRNA表达
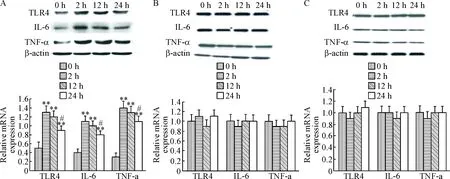
Figure 2. The liver tissue protein expression of TLR4, IL-6 and TNF-α at different time points in I/R (A), S (B) and N (C) groups. Mean±SD.n=6.**P<0.01vs0 h;#P<0.05vs2 h or 12 h.
图2各组大鼠缺血再灌注不同时点肝组织TLR4、IL-6和TNF-α的蛋白表达
4 各组大鼠肝组织miR-146a的表达
各组大鼠不同时点肝组织均有miR-146a表达,I/R组缺血再灌注前(0 h)肝组织miR-146a表达与S组和N组无显著差异。I/R组缺血再灌注处理后各时点肝组织miR-146a表达较0 h及S组、N组各时点均明显降低(P<0.01),尤其12 h时点下降最为明显;S组大鼠假手术后肝组织miR-146a虽然也有所下降,但与假手术前差异无显著性;N组大鼠各时点肝组织miR-146a表达无显著差异,见图3。
讨 论
缺血再灌注损伤是导致急性肝功能衰竭及影响移植肝存活的重要因素,发病机制尚未完全阐明。目前已认识到[7],缺血再灌注中释放的一些分子(如热休克蛋白)可以作为内源性配体启动Toll样受体炎性信号通路, TLR4 介导的炎性应答是缺血再灌注肝损伤发生的重要机制。
我们在缺血再灌注肝损伤大鼠模型中检测到,大鼠缺血再灌注后,各时点血浆ALT活性及致炎细胞因子IL-6和TNF-α含量均较缺血再灌注前明显升高;且随着时间延长,各指标仍持续升高;假手术组大鼠虽然血浆IL-6和TNF-α含量有升高,但血浆ALT含量却无明显变化;非手术组大鼠各时点各指标含量无显著差异,提示缺血再灌注造成了大鼠肝组织细胞炎性损伤。实验中我们同时检测了各组大鼠肝组织细胞TLR4及致炎细胞因子的表达情况,结果表明,缺血再灌注后各时点大鼠肝组织TLR4、IL-6和TNF-α mRNA及蛋白的表达量均有升高,虽然随着时间延长,各指标表达量有下降趋势,但均显著高于缺血再灌注前。因此,大鼠缺血再灌注后,由于肝组织TLR4、IL-6和TNF-α mRNA及蛋白的表达升高引起了致炎细胞因子IL-6和TNF-α的释放增多,最终导致肝细胞损伤。
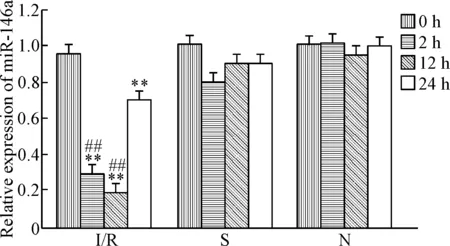
Figure 3. The miR-146a expression in rat liver tissue at different time points in I/R, S and N groups. Mean±SD.n=6.**P<0.01vs0 h;##P<0.01vsS or N group.
图3I/R、S和N组各时点肝组织miR-146a的表达
miR-146a是第一个被发现的在免疫系统中具有调控作用的miRNA,参与了先天性及获得性免疫,在先天性免疫中主要是负调控Toll样受体-NF-κB通路中的信号分子而抑制NF-κB活性;在获得性免疫中,主要影响调节性T细胞的表达而发挥作用[8]。有研究报道,miR-146a的表达水平与TNF-α mRNA的含量负相关[9];miR-146a能减少TLR4信号通路中的关键信号分子IRAK-1的表达,并显著减轻肠黏膜内皮细胞的免疫损伤[10]。研究中我们检测到,缺血再灌注后大鼠肝组织miR-146a显著下降,其中在缺血12 h时下降尤为明显,缺血24小时表达量虽然较2 h、12 h表达量升高,但始终显著低于缺血再灌注前;假手术组及非手术组大鼠各时点肝组织miR-146a表达量始终高于缺血再灌注组,然而,这2组大鼠缺血再灌注后血浆ALT、IL-6、TNF-α以及肝组织TLR4、IL-6和TNF-α mRNA及蛋白的表达量却较缺血前无显著变化,提示它们不存在明显的肝组织细胞损伤。因此,大鼠肝缺血再灌注后,一方面肝组织miR-146a的表达量下降,另一方面血浆ALT活性、致炎细胞因子IL-6和TNF-α含量,以及肝组织TLR4、IL-6和TNF-α mRNA与蛋白的表达量均有升高,提示缺血再灌注可以导致肝组织miR-146a表达下降、激活TLR4炎症信号通路及缺血再灌注炎性肝损伤发生,调控miR-146a的表达可能有助于减弱缺血再灌注肝损伤。

