p38 MAPK在顺铂诱导肾小管上皮细胞凋亡中的作用*
娄 强, 张 芳, 李淑莲
(1河南大学基础医学院抗体药物开发技术国家地方联合实验室, 河南 开封 475004; 2河南大学第一附属医院, 河南 开封 475000)
急性肾损伤(acute kidney injury,AKI)是由某种原因引起肾功能急剧持续下降,导致机体代谢产物在体内蓄积的一种临床综合征。在我国最近的一次对住院患者的调查中发现,AKI病人的病死率达到12.4%[1-2]。在我国,肾毒性药物仍然是AKI发生的最主要的致病原因,占比达30%~39%[3],已成为临床医务工作者亟待解决的问题。顺铂(cisplatin)被广泛应用于抗肿瘤治疗中,然而由于其产生明显的肾毒性限制了其应用。肾小管上皮细胞被认为是顺铂肾毒性的主要靶细胞,肾小管上皮细胞的凋亡在顺铂致肾脏组织损伤中发挥重要作用。但是,顺铂通过影响肾小管上皮细胞凋亡致AKI发生的机制尚未完全阐明。
p38蛋白属于有丝分裂原活化蛋白激酶(mitogen-activated protein kinase,MAPK)家族成员,其激活与顺铂所致AKI发生密切相关[4-5]。在顺铂致小鼠和大鼠AKI模型中,有报道p38 MAPK抑制剂能明显降低肾脏组织损伤[6-7]。然而,在最近的一项关于顺铂致小鼠急性肾损伤的实验中,并没有观察到p38 MAPK的激活[8]。因此,p38 MAPK信号通路在AKI中的作用及机制需要进一步实验验证。另外,细胞外酸性环境可以引起p38 MAPK的磷酸化激活[9],然而在顺铂诱导肾小管细胞凋亡时,p38 MAPK是否影响了细胞外酸性环境仍有待进一步研究。
本文拟采用顺铂诱导大鼠近端肾小管上皮细胞(renal proximal tubular cell,RPTC)凋亡模型,研究p38 MAPK在顺铂致肾小管细胞凋亡中的作用及其对下游凋亡因子的影响,探讨是否细胞外酸性环境参与了p38 MAPK的凋亡通路,为有效防治药物性肾损伤提供潜在靶点和实验依据。
材 料 和 方 法
1 主要试剂
大鼠近端肾小管上皮细胞来源于Zheng Dong实验室(Augusta University)。兔抗PARP、caspase-3、p38及p-p38单克隆抗体均购自Cell Signaling;鼠抗β-actin抗体、p38 MAPK抑制剂SB203580及顺铂均购自Sigma;辣根过氧化物酶标记的抗兔或抗小鼠II抗购自Jackson ImmunoResearch;用于caspase活性分析的DEVD-AFC和AFC均购自Enzyme Systems Products。
2 主要方法
2.1细胞培养和实验分组 RPTC在Ham’s F-12-DMEM培养基中培养,同时培养基中添加了10%胎牛血清、5 mg/L转铁蛋白、5 mg/L胰岛素、1 μg/L表皮生长因子、4 mg/L地塞米松和1% 双抗(均购自Sigma)。参照我们以前的报道[10],RPTC以1×106的数量接种于35 mm培养皿中,在第2天培养达到铺满皿底的程度时,以不同浓度的顺铂(0、5、10和20 μmol/L)处理细胞24 h,Western blot检测cleaved PARP的变化;采用ImageJ 1.6软件定量cleaved PARP条带。加入20 μmol/L的顺铂处理后,将培养液上清离心并测量pH值,另外,在检测完凋亡细胞的形态后将细胞裂解以进行细胞生物学实验。实验分为对照(control)组(细胞经DMSO处理)、顺铂组(细胞经顺铂处理24 h)及顺铂+SB203580组(加入50 mg/L SB203580处理RPTC细胞1 h后给予顺铂处理24 h)。
2.2凋亡细胞的形态学观察 RPTC的凋亡通过形态学观察确认。20 μmol/L的顺铂处理后,在细胞培养皿中加入10 mg/L Hoechst 33342后,染色2~5 min,然后在相差荧光显微镜下观察并拍照。每种细胞选取3个不同的视野,随机选取视野中不超过200个细胞计数培养皿中的凋亡细胞数目。该实验重复3次。
2.3流式细胞术检测细胞凋亡 采用细胞凋亡检测试剂盒(eBioscience,货号88-8007)分析细胞凋亡率。待各实验组6 孔板细胞生长至覆盖率约70%时采用20 μmol/L顺铂诱导RPTC凋亡。收集上清细胞和胰酶消化后的细胞,4 ℃预冷的D-Hanks洗涤细胞沉淀。细胞沉淀重悬后加入10 μL Annexin V-APC染色,上机检测。
2.4Caspase活性的检测 RPTC裂解液中的caspase活性由Ac-DEVD-AFC试剂盒检测。首先,将顺铂处理后的RPTC在冰预冷的Triton X-100裂解液[10 mmol/L Tris·HCl,10 mmol/L NaH2PO4/Na2HPO4(pH 7.5),130 mmol/L NaCl,1% Triton X-100]中裂解10 min后,以最大转速离心后取上清蛋白。蛋白定量后取25 μg与包含50 μmol/L DEVD-AFC的酶反应缓冲液在37 °C孵育1 h;设置激发光波长为360 nm,发射光波长为530 nm后检测荧光强度。样品的caspase活性由每 mg蛋白含有的游离AFC的量(nmol)表示。
2.5Western blot分析 RPTC接种于35 mm培养皿,过夜培养后加入顺铂和SB203580处理24 h,后将细胞于冰预冷的PBS缓冲液中润洗1次,然后加入SDS裂解液[62.5 mmol/L Tris·HCl (pH 7.4),2%(W/V)SDS,10% 甘油,蛋白酶抑制剂(Roche),核酸酶]裂解5 min,以最大转速离心10 min后取上清即为细胞总蛋白。用BCA法检测上清中总蛋白含量。取30 μg蛋白进行12% SDS-PAGE,然后电转印至PVDF膜上,封闭液室温封闭2 h后,与I抗[抗p38抗体、抗p-p38 (Ser36)抗体、抗PARP和抗caspase-3抗体稀释度均为1 ∶1 000;抗β-actin 和抗cyclophilin B抗体稀释度为1 ∶10 000]于4 ℃孵育过夜,加入相应 II 抗室温孵育1 h后进行化学发光法检测。
3 统计学处理
数据的处理采用GraphPad Prism 7软件分析。实验均重复3 次,实验结果用均数±标准差(mean±SD)表示。用方差分析对多组间的差异进行比较,再用Bonferroni校正的t检验对各组均数进行两两比较。以P<0. 05为差异有统计学意义。
结 果
1 顺铂诱导大鼠RPTC凋亡和p38 MAPK磷酸化
以不同浓度(0、5、10和20 μmol/L)的顺铂处理RPTC 24 h后,通过Western blot分析发现20 μmol/L的顺铂能明显促进PARP的剪切,见图1A。因此在后续的实验中顺铂处理均采用20 μmol/L的浓度。同时,与对照组相比,顺铂可诱导RPTC中p38 MAPK的磷酸化,并在顺铂处理15 min时达到高峰,这种效应持续至1 h仍然存在,见图1B。
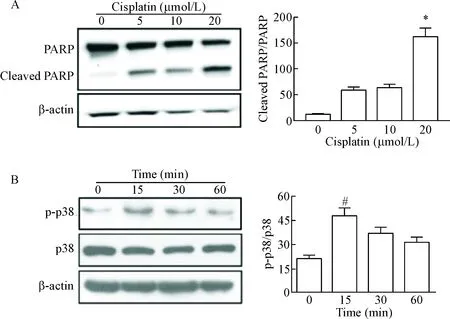
Figure 1. Cisplatin induced RPTC apoptosis and led to p38 phosphorylation. A: the cleaved PARP was examined by Western blot; B: the cell lysates were collected and the protein levels of p-p38, p38 and β-actin were determined by Western blot. Mean±SD.n=3.*P<0.05vs0 μmol/L;#P<0.05vs0 min.
图1顺铂诱导RPTC凋亡及p38MAPK磷酸化
2 p38 MAPK抑制剂降低顺铂诱导的RPTC凋亡
与正常对照组相比,顺铂处理24 h能明显诱导RPTC凋亡,可观察到细胞碎片化明显,细胞皱缩,细胞核碎片增多,见图2A;顺铂诱导凋亡细胞数占总细胞数的12.08%,加入p38 MAPK抑制剂SB203580后,顺铂诱导的RPTC凋亡率降低至6.38%,见图2B;另外,与顺铂处理组相比,顺铂+SB203580处理组细胞的caspase活性明显降低(P<0.05),见图2C;流式细胞术分析发现顺铂处理组细胞的凋亡率较对照组明显升高,SB203580和顺铂处理组细胞的凋亡率降低(P<0.05),见图2D。
Western blot实验结果显示顺铂处理组的cleaved PARP和cleaved caspase-3水平升高(P<0.05);加入p38 MAPK抑制剂SB203580后,cleaved PARP和cleaved caspase-3水平也分别回落;磷酸化的p38水平降低(P<0.05),见图3。这些结果显示p38 MAPK的磷酸化在顺铂诱导的RPTC凋亡中发挥重要作用。
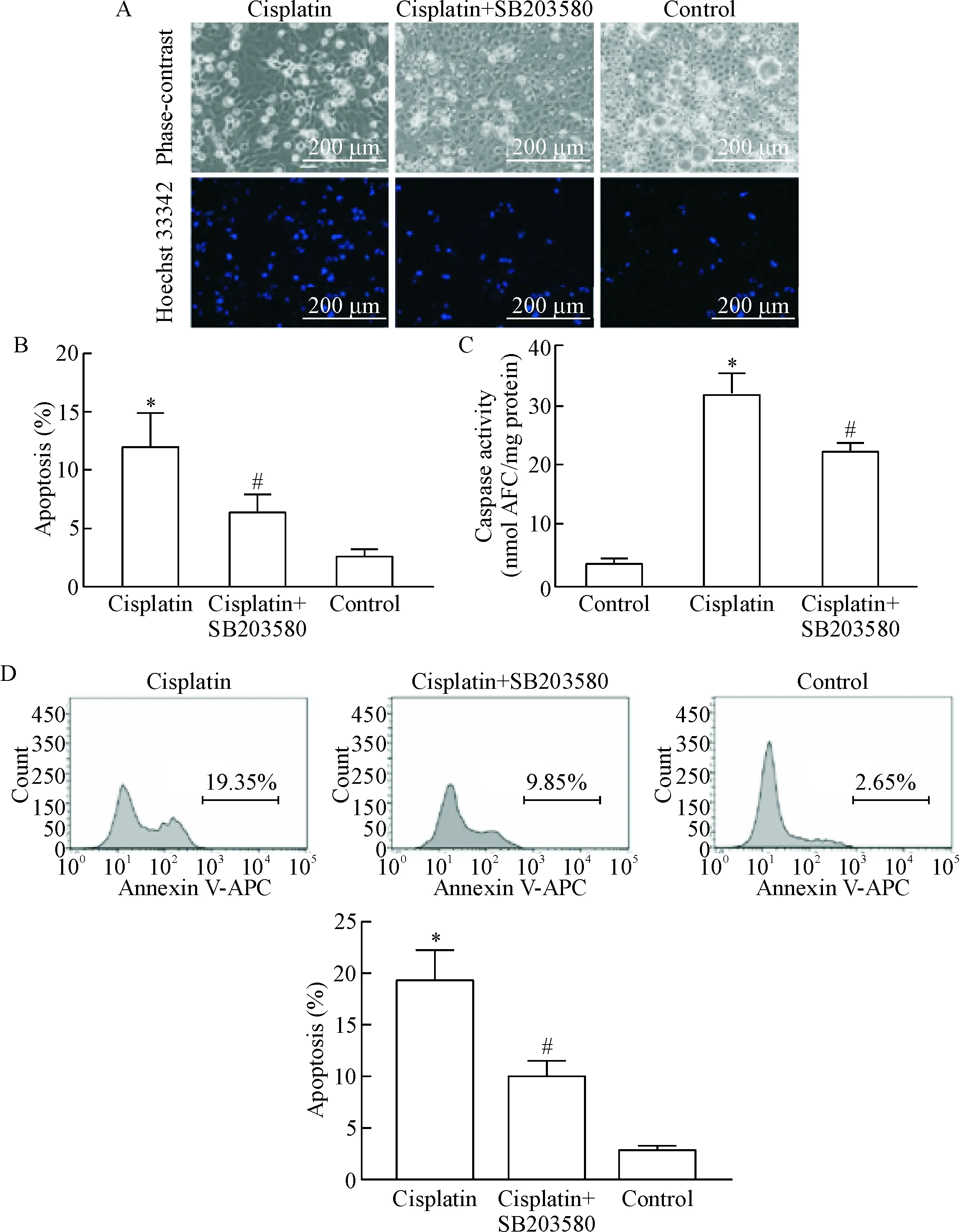
Figure 2. p38 MAPK inhibitor SB203580 decreased apoptosis of RPTC with cisplatin treatment. A: the representative images of cell morphological changes were observed; B: the percentage of apoptosis evaluated by counting cells with typical apoptotic morphological changes; C: the caspase activity was measured by enzymatic assay; D: the apoptosis was analyzed by flow cytometry with Annexin V-APC staining. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscisplatin group.
图2p38MAPK抑制剂SB203580降低顺铂诱导的RPTC凋亡
3 p38 MAPK抑制剂增加了顺铂诱导的RPTC培养基的pH值
加入p38 MAPK抑制剂SB203580后检测RPTC细胞培养基的pH值,结果显示顺铂处理RPTC能明显降低培养基的pH值,这种效应可以被p38 MAPK抑制剂SB203580抑制,并使pH值回升(P<0.05),见图4。单独添加SB203580至RPTC细胞培养基中培养细胞24 h后,与未添加组相比,培养基的pH值并没有明显改变,说明pH值的变化并非由加入SB203580引起。这些结果表明顺铂诱导RPTC凋亡后,可改变细胞外酸性环境,并可被p38 MAPK抑制剂SB203580抑制。
讨 论
顺铂引起的急性肾损伤是限制抗肿瘤药物顺铂广泛使用的主要因素,然而有关的病理生理学机制仍不明确。我们研究发现,顺铂诱导大鼠RPTC发生明显凋亡,并上调p38 MAPK信号分子表达,这一过程可被p38 MAPK抑制剂SB203580抑制,从而减少细胞凋亡的发生。
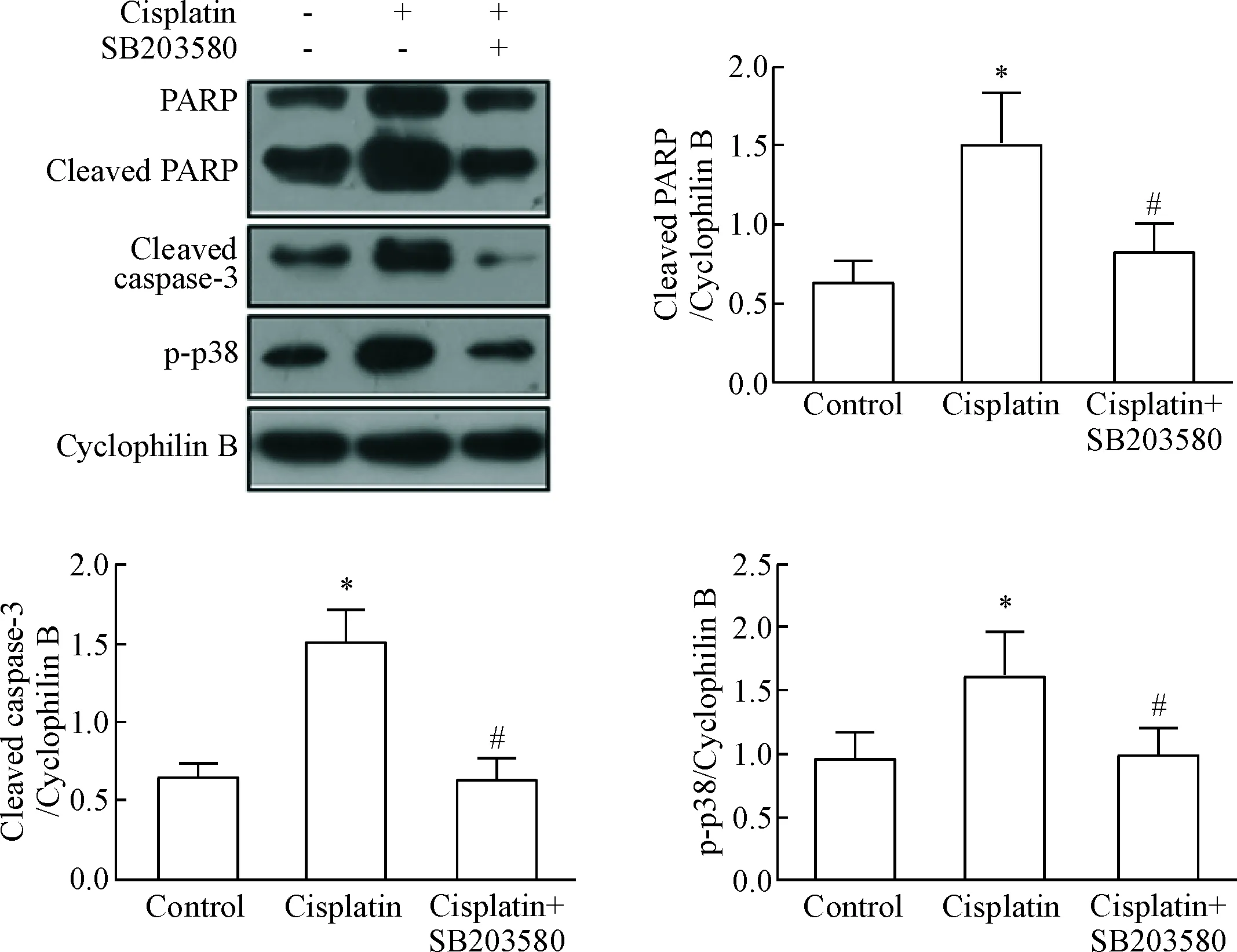
Figure 3. Wesrern blot analysis of the protein levels in the RPTC after treated with p38 MAPK inhibitor SB203580 and cisplatin. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscisplatin group.
图3p38MAPK抑制剂SB203580降低顺铂诱导的RPTC相关蛋白表达
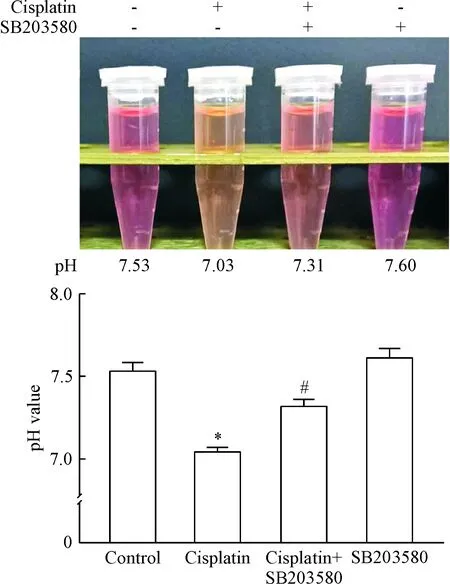
Figure 4. p38 MAPK inhibitor SB203580 increased pH value during cisplatin treatment. Mean±SD.n=3.*P<0.05vscontrol group;#P<0.05vscisplatin group.
图4p38MAPK抑制剂SB203580增加顺铂刺激时的RPTC培养基的pH值
p38 MAPK 属于丝氨酸/苏氨酸蛋白激酶家族成员,在介导细胞凋亡、炎症及分化过程中是重要的信号分子,参与顺铂或者缺血/再灌注[11]引起的急性肾损伤途径。在不同的细胞中,p38的激活可以产生促凋亡或抗凋亡2种不同的生物学效应[12],这种现象的发生受外界环境刺激或者细胞增殖分化状态等影响。在本论文中,我们利用体外RPTC凋亡模型,研究p38 MAPK对细胞caspase活性及对caspase和PARP蛋白剪切的影响,分析认为p38 MAPK参与了顺铂诱导的肾小管细胞凋亡。顺铂可以诱导RPTC的p38磷酸化,进一步活化p38 MAPK下游的凋亡信号分子caspase-3。这些结果在不同的细胞凋亡模型中也得到验证,比如p38 MAPK也参与顺铂诱导的人类肺脏[13]和卵巢癌细胞[14]的凋亡,提示p38 MAPK在顺铂诱导的细胞损伤中主要发挥促凋亡的作用。
本研究发现,与对照组相比,顺铂处理RPTC能明显降低培养基的pH值,这种效应可以被p38 MAPK抑制剂SB203580抑制。顺铂处理引起细胞凋亡增加,而细胞凋亡发生时胞质酸化,细胞膜皱缩破裂后可能会释放酸性物质到培养基中,导致细胞外酸性环境。所以,细胞外pH值降低可能是细胞凋亡的一种反应。p38抑制剂降低了顺铂诱导的RPTC凋亡,同时降低了细胞外培养基的酸度。然而在对顺铂耐药的人类黑色素瘤细胞培养时发现培养基的pH值较低[15]。这可能与肿瘤细胞(比如HeLa细胞)中p38 MAPK激活后可同时引发促凋亡和抗凋亡2种信号途径从而降低对顺铂等药物的敏感性有关[16],因此在不同的细胞类型中p38 MAPK参与调控的细胞外酸性环境变化的机制可能不同。也有报道认为细胞外酸性环境对p38 MAPK的激活起重要作用[9]。因此,在RPTC凋亡发生时伴随着细胞外环境酸度的变化,这种变化与p38 MAPK的激活密切相关,可能以一种正反馈的方式调控细胞凋亡。
综上所述,顺铂诱导RPTC产生AKI 时,可以促进p38 MAPK磷酸化,产生酸性的外部环境,并增加凋亡相关蛋白PARP和caspase-3的剪切,而p38 MAPK抑制剂可降低细胞凋亡,减少凋亡相关蛋白的激活并减轻细胞外环境的酸度,提示p38 MAPK在顺铂的肾脏毒性上发挥重要,并可作为潜在的治疗药物性肾损伤的药物靶标。

