亚硒酸钠诱导肺癌A549细胞凋亡的作用及对凋亡相关蛋白Cytc影响*
齐云飞 魏晓菲
(1.菏泽医学专科学校,山东 菏泽 274000;2.菏泽市中医医院医学影像科,山东 菏泽 274000)
国家癌症中心登记数据显示:通过分析1988年—2005年10个肿瘤登记处的连续数据发现肺癌发病率呈现逐年上升趋势,年平均增长1.63%[1],户外空气污染、 职业暴露和居住地附近环境污染均与肺癌发病和死亡存在关联,且关联大小受到吸烟、经济状况、年龄和性别等影响[2]。肺癌发病隐匿,发现多处在中晚期,即使经过手术切除、放射和化学疗法等,5年生存率仍然较低。因此肺癌的预防显得尤为重要。流行病学研究发现硒、类胡萝卜素、维生素E 等抗氧化剂的摄入能预防肺癌的发生[3],肺癌、前列腺癌、和结肠癌的发生率可通过补硒而下降,但临床试验也具有争议的结果[4-5]。因此探讨硒与肺癌发生的机制对研究硒能否预防肿瘤有重要的理论和实践意义。前期研究证明硒治疗肿瘤的机制与硒具有抗氧化,抑制肿瘤细胞凋亡有关[6],故本研究探讨亚硒酸钠抑制肺癌A549细胞增殖、促进其凋亡的机制。因为细胞凋亡与细胞线粒体内细胞色素C(Cyt-C)释放有关,故我们推论亚硒酸诱导肺癌细胞A549凋亡与凋亡相关蛋白Cyt-C有关。
1 材料与方法
1.1材料和试剂
A549人肺癌细胞细胞株、新生牛血清、RPMI1640 培养基分别购自南京凯基生物公司、杭州四季青生物有限公司和美国Gibco公司,亚硒酸钠为美国Sigma 公司产品,小鼠抗人细胞色素C抗体购自英国Abcam公司,TUNEL细胞凋亡检测试剂盒购自Roche公司。
1.2细胞培养和分组
A549人肺癌细胞株,复苏接种于RPMI 1640 培养液中,培养液含10%新生牛血清,青霉素、链霉素各 l×105U/L,置5%CO2培养箱内37 ℃常规培养。取A549对数生长期的细胞,分为5组,分别加硒(0 μmol/L,0.5 μmol/L,2.5 μmol/L,5.0 μmol/L和8.0 μmol/L亚硒酸钠),培养24 h、48 h后检测实验结果。
1.3MTT检测亚硒酸钠对肺癌细胞株A549的增殖的影响
在104/孔的浓度将对数生长期A549细胞接种于96孔板。待24 h细胞贴壁后,分别加入含亚硒酸钠0 μmol/L,0.5 μmol/L,2.5 μmol/L,5 μmol/L和8 μmol/L的培养液,分别培养24 h、48 h,每个浓度设重复孔6个,然后MTT法检测A549细胞吸光度,在酶标仪490 nm处读取A549细胞吸光度值,实验重复3次。A549细胞增殖抑制率=(1-实验组OD值/对照组OD值)×100%。
1.4亚硒酸钠对肺癌A549细胞凋亡相关蛋白Cytc表达的影响
收集A549对数生长期的细胞,将细胞培养于盖玻片上,待细胞贴壁后,细胞密度为60%~70%左右时,实验组加提前配置的亚硒酸钠培养液,做3个平行孔,再培养24 h和48 h,收集盖玻片上A549细胞,4%多聚甲醛固定,加入1∶100浓度的小鼠抗人细胞色素C抗体,SP(streptavidin-perosidase)法进行免疫细胞化学染色。同样培养细胞后提取全细胞蛋白,用免疫印迹法检测A549细胞Cytc含量。
1.5TUNEL末端标记检测肺癌A549凋亡
在肺癌A549对数生长期收集细胞,加入含亚硒酸钠0 μmol/L,0.5 μmol/L,2.5 μmol/L,5.0 μmol/L和8.0 μmol/L的培养液24 h和48 h。4%多聚甲醛室温固定细胞30 min,按照TUNEL Roche试剂盒说明书检测有不同浓度的亚硒酸钠对A549凋亡的作用。
1.6结果分析
每种浓度、24 h和48 h 两个时间点,Cytc免疫细胞化学染色结果随机拍照5张,实验重复3次共拍照15张,同IPP6.0 图像分析软件对每张照片进行吸光度检测,计算15张图片的均值,用均数±标准差。A549细胞TUNEL末端标记染色结果用同样的方法进行拍照,计算其吸光度值,以β-actin作为内参照,统计数据分析。
1.7统计学处理
以上均数选用SPSS19.0软件进行单因素方差分析,SNK-q检验用于组间两两比较,检验水准为α=0.05,P≤0.05表示两组数据存在统计学意义。
2 结 果
2.1MTT检测亚硒酸钠对肺癌细胞株A549的增殖的影响
用不同浓度的亚硒酸钠培养液培养人肺癌A549细胞株24 h,48 h后,A549细胞的吸光度值的检测结果(见图1),可见MTT吸光度值随着亚硒酸钠浓度的增加逐渐呈现降低的趋势。0 μmol/L,2.5 μmol/L,5.0 μmol/L亚硒酸钠组在24 h和48 h两个时间点虽然随着时间的延长吸光度有所下降,但没有统计学意义;8 μmol/L亚硒酸钠组观察到培养48 h比24 h的吸光度显著下降(P<0.05),肺癌A549细胞的数量也亚硒酸钠浓度依赖性的和时间依赖性的越来越少。通过公式(1-实验组OD值/对照组OD值)×100%,计算抑制率见(图2)。A549细胞生长抑制率随着亚硒酸钠浓度的升高时间依懒性的逐渐增高。
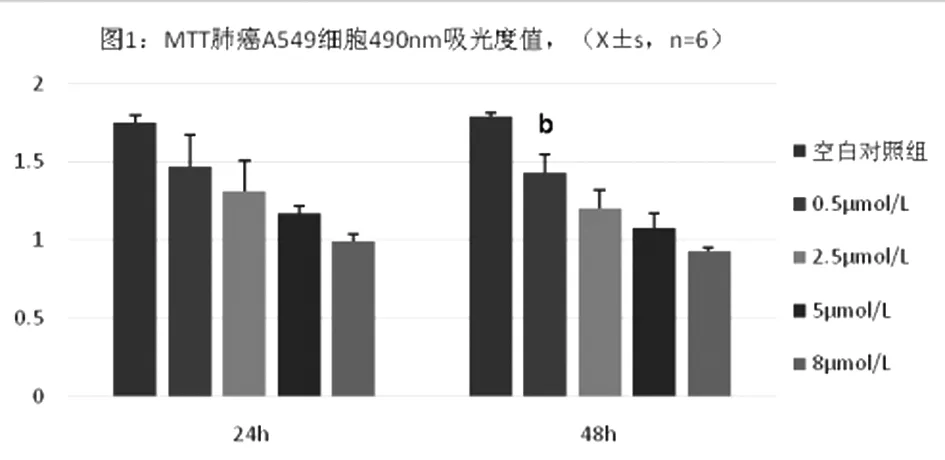
注:a空白对照组比较P<0.05,b空白对照组比较P<0.01

符号不同·,具有显著性,P<0.05
2.2亚硒酸钠对Cytc蛋白表达的影响(图3~7)
Cytc蛋白免疫细胞化学染色显示:Cytc阳性定位于细胞质,呈棕黄色颗粒(图3~图4)。IPP6.0 图像分析结果(图5)随着亚硒酸钠浓度和培养时间的增加Cytc蛋白免疫细胞化学染色的平均光密度增加,Western blot印迹法检测图像分析结果(图6~图7)也显示同样的趋势。
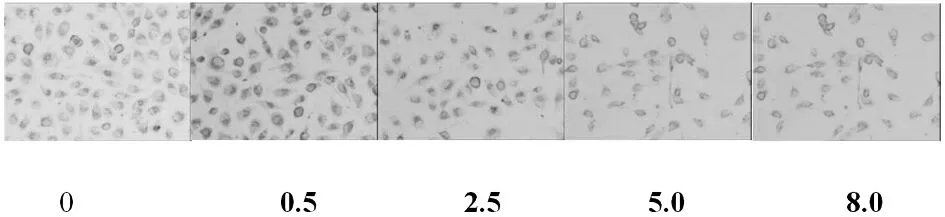
图3 加亚硒酸钠(0 μmol/L,0.5 μmol/L,2.5 μmol/L,5.0 μmol/L,8.0μmol/L)培养24h后Cytc阳性蛋白在肺癌A549 细胞内的表达(24h).免疫细胞化学染色,200×.
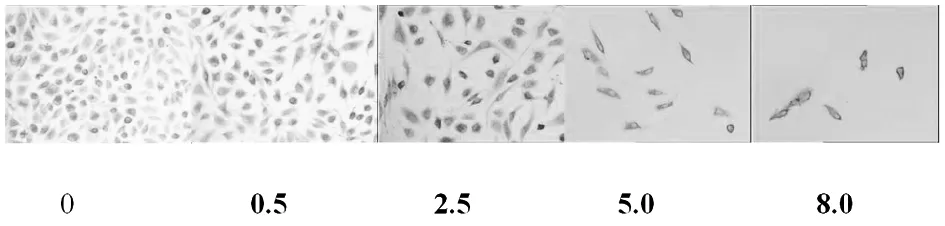
图4 加亚硒酸钠(0 μmol/L,0.5 μmol/L,2.5 μmol/L,5.0 μmol/L,8.0μmol/L)培养48h后Cytc阳性蛋白在肺癌A549 细胞内的表达(24h).免疫细胞化学染色,200×.
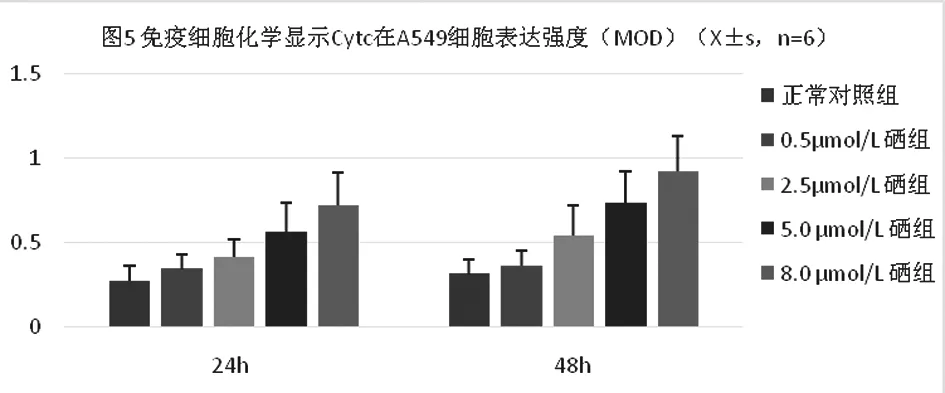
图5 a与空白对照组比较P<0.01。

图6 Western blot 显示肺癌A549细胞内Cytc 蛋白含量.
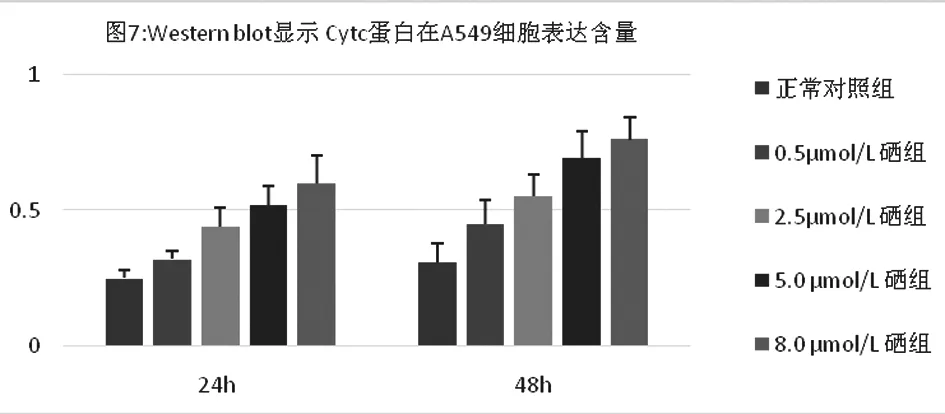
图7 a与空白对照组比较P<0.05; b 与0.5μmol/L 硒组比较P<0.05,c与2.5μmol/L 硒组比较P<0.05
2.3亚硒酸钠对肺癌A549凋亡的影响(表1,图8~图9) 人肺癌A549凋亡TUNEL染色结果显示:TUNEL染色位于A549凋亡细胞核,随着亚硒酸钠浓度的增加和时间的延长逐渐加深。图像分析结果显示(表1),随着亚硒酸钠浓度的增加A549凋亡逐渐增加(P<0.05),但亚硒酸钠作用肺癌A549 24h或48h后,其凋亡程度没有显著的区别。

图8 TUNEL染色显示加亚硒酸钠培养24h对A549细胞凋亡的影响
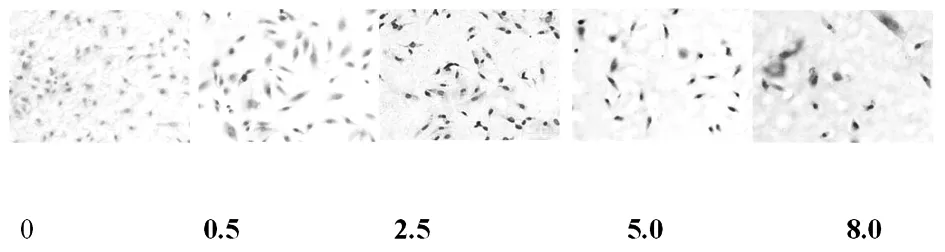
图9 TUNEL染色显示加亚硒酸钠培养48h对A549细胞凋亡的影响

表1 不同浓度的亚硒酸钠对肺癌A549细胞凋亡的诱导作用
注:a空白对照组比较P<0.05
3 讨 论
从90年代初,硒长期被认为具有抗癌,抑制DNA损伤,抑制肺癌转移和辐射诱导的致癌作用。但近年来也出现了具有争议的结果。最近Jablonska等[7]报道,硒能否降低患肺癌的几率,可能与患者的基因型有关;另有实验表明补硒能否降低肿瘤的发病率还可能与性别有关。为此我们研究了不同浓度(0.5 μmol/L,2.5 μmol/L,5.0 μmol/L,8.0 μmol/L)亚硒酸钠对A549细胞株的影响,本实验发现MTT吸光度值随着亚硒酸钠浓度的增加逐渐呈现降低的趋势。0 μmol/L,2.5 μmol/L,5.0 μmol/L亚硒酸钠组在24 h和48 h两个时间点虽然随着时间的延长吸光度有所下降,但没有统计学意义;8 μmol/L亚硒酸钠组观察到培养48h比24h的吸光度显著下降,肺癌A549细胞的数量也亚硒酸钠浓度依赖性的和时间依赖性的越来越少。说明亚硒酸钠能够抑制肺癌细胞的生长,抑制率随着亚硒酸钠浓度的升高时间依懒性的逐渐增高。
亚硒酸钠抑制A549细胞生长的机制主要与硒化合物可通过细胞毒作用和诱导细胞凋亡的方式直接作用肿瘤细胞有关[8]。硒化合物诱导肿瘤细胞凋亡的机制还不清楚[9-10]。“细胞凋亡(apoptosis)”是“程序性细胞死亡(Programmed Cell Death,PCD)”的形式之一,是细胞一种生理性、主动性的细胞“ 自杀行为”[11]。它可以清除多余、无用、畸变甚至癌变的细胞,来维持机体内环境的稳定。为此我们用TUNEL末端标记的方法,探索0 μmol/L,0.5 μmol/L,2.5 μmol/L,5 μmol/L和8μmol/L亚硒酸钠对人肺癌A549凋亡的作用,结果显示随着亚硒酸钠浓度的增加A549凋亡逐渐增加(P<0.05),亚硒酸钠能促进A549细胞株的凋亡。
线粒体途径是内源性细胞凋亡的中心环节,细胞色素 C是线粒体呼吸链中的电子传递体,在细胞凋亡启动时线粒体膜稳定性较差,细胞色素C从线粒体释放,促进细胞凋亡[12]。为此我们检测了亚硒酸钠对细胞质细胞色素C含量的影响,结果显示免疫组织化学和Western blot印迹法检测图像分析结果均显示Cytc免疫细胞化学染色的吸光度程度和蛋白表达强度均升高,说明亚硒酸钠可以作用于肺癌细胞株的线粒体膜,使肺癌A549细胞株内Cytc从线粒体释放,合成也增多,从而诱导细胞凋亡。
综上所述,亚硒酸钠浓度依赖性的抑制A549细胞增殖,诱导肺癌细胞凋亡,机制可能与亚硒酸钠诱导A549细胞线粒体膜稳定性降低,促进Cytc蛋白由线粒体释放的细胞质有关。

