风湿定胶囊对类风湿关节炎大鼠滑膜组织JAK/STAT信号通路的影响*
陈 勇 陈 涛 高永翔
(1.成都中医药大学附属医院,四川 成都 610000;2.成都中医药大学基础医学院,四川 成都610000)
类风湿性关节炎(RA)是一种以多关节炎症为显著特征的慢性自身免疫系统疾病,因具有发病率及致残率高的特点,严重危害人类健康[1]。目前针对其发病机制的研究表明,多种信号转导通路在RA发展过程中起重要作用,其中备受研究者关注当属Janus激酶/信号转导子与转录激活子(JAK/STAT)信号通路[2-3]。研究证实JAK/STAT信号通路通过多途径调控炎症反应,在RA发病及发展过程中发挥重要调控作用[4]。目前针对RA的治疗,临床首选具有多靶点特色的中药复方制剂,其中风湿定胶囊以祛寒除湿、补气养血、扶正祛邪的功效及副作用小、患者依从性强等优势,逐渐在临床中得到广泛应用,但其具体作用机理目前尚不明确。基于此,本研究通过探讨风湿定胶囊对RA大鼠滑膜组织中JAK-STAT信号通路表达的影响阐述其治疗RA的作用机制,以期为其临床推广提供一定理论依据。现报告如下。
1 材料与方法
1.1 实验动物 SPF级健康未交配性成熟Wistar大鼠 85 只,雌雄各半,体质量(180±20) g,购自广州中医药大学(国际中医药转化医学研究所),动物合格证号:SYXK(粤)2014-0144;饲养环境:标准饲料和水饲养,室温18~22℃、相对湿度40%~50%。
1.2 试药与仪器 风湿定胶囊(国药准字Z20044165,0.3 g/粒,陕西健民制药有限公司);甲氨蝶呤片(国药准字H31020644,2.5 mg/片,上海信谊药厂有限公司)。鸡Ⅱ型胶原(10 mg/支),完全弗氏佐剂(CFA,10 mg/支),均购于大连宝生物工程有限公司;总RNA提取试剂盒,逆转录试剂盒、实时荧光定量PCR试剂盒均购于上海恒远生物科技有限公司;DAB显色试剂盒,购自武汉博士德生物技术有限公司;p-JAK3、JAK3单抗,p-STAT3、STAT3单抗均购自上海康朗生物科技有限公司;Western blotting印迹全套试剂盒,购于上海英拜生物科技有限公司。实验仪器:足趾容积检测器(WA.198-462,北京卓川电子科技有限公司);荧光定量PCR仪(南京贝登医疗股份有限公司)。风湿定胶囊灌胃溶液配置:根据不同剂量将风湿定胶囊用0.9%氯化钠注射液冲成混悬液,低剂量(10 mg/mL)、中剂量(20 mg/mL)、高剂量(40 mg/mL),给药体积 2 mL/100 g,大鼠风湿定胶囊灌胃浓度按照体表面积法,根据临床成人给药剂量计算得到。CⅡ乳剂的配置:于无菌条件下,以0.1 moL/L的冰乙酸充分溶解Ⅱ型胶原后,置于4℃冰箱中静置过夜。第2天取出,取等体积弗氏完全佐剂混合,经振荡乳化得CⅡ乳剂(CⅡ含量为1 mg/mL),置于4℃冰箱中保存,备用。
1.3 模型制备 将85只大鼠饲养1周后随机选出15只为空白组,其余70只均参照文献[5]方法以CⅡ乳剂进行造模:以10%水合氯醛进行麻醉后,分别于每只大鼠背部及左后足跖多点进行皮下注射CⅡ乳剂0.5 mL,诱导大鼠发生炎症进行造模,造模第14天随机选取两只进行关节病理检查,判断是否成模。
1.4 分组及给药 选取建模成功的大鼠60只随机分为6组,分别为模型组、风湿定胶囊低剂量组[200 mg/(kg·d)]、风湿定胶囊中剂量组[400 mg/(kg·d)]、风湿定胶囊高剂量组[800 mg/(kg·d)]、阳性对照组[甲氨蝶呤 0.5 mg/(kg·d)],模型组与空白组每日分别以等量的(4 mL)0.9%氯化钠注射液灌胃。造模14 d后开始给药,连续给药4周。
1.5 观察指标 1)各组大鼠一般情况观察。分别观察各组大鼠毛发、进食、活动、精神状态及体质量变化等一般情况。大鼠足肿胀程度测定:分别以容积检测仪测定并记录各组给药后第 0、7、14、20、24、28 天大鼠右后足的肿胀体积变化情况。2)大鼠滑液及滑膜组织中p-JAK3、p-STAT3蛋白表达水平的测定。采用蛋白免疫印记(Western blotting)法检测各组大鼠滑膜组织中p-JAK3、p-STAT3的蛋白表达水平,血管总蛋白的提取:取各组大鼠关节滑膜组织于研钵中,加300 UI裂解液(按照说明书配制1 mmoL/L的PMSF),研磨处理10 min,充分振荡后静置10 min,于4℃条件下以离心(14000 r/min)8 min,取上清得总蛋白;以 BCA 法检测蛋白浓度,分别取适量总蛋白,以5倍量上扬缓冲液稀释后,置于95℃变性处理5 min,备用;Western blotting检测:将变性蛋白置于120 g/L的SDS-PAGE中进行电泳,而后加入一抗p-JAK3、p-STAT3于4℃条件下孵育过夜,再以辣根过氧化酶结合的山羊抗兔孵育后,采用BeyoECL Plus发光检测。检测完毕清除免疫印迹,再检测GAPDH,操作步骤同上。以图像分析软件对条带进行灰度分析,以二者蛋白灰度值的比值(目的蛋白/内参GAPDH)反应蛋白的相对表达水平。3)关节组织病理观察。给药后第28天以脱颈法将大鼠处死,留取关节滑膜组织:将大鼠仰位固定,沿后肢膝关节正中纵行切开,暴露出膝关节中心约3 cm×3 cm的区域,无菌剥离出关节滑膜组织,以无菌生理盐水清洗,快速放入1‰DEPC处理的EP管中,并存于-80℃冰箱中备用。采用免疫组化法将关节滑膜组织以4%甲醛固定,进行常规石蜡包埋切片,于光镜下观察关节滑膜组织的病理变化。
1.6 统计学处理 应用SPSS20.0统计软件。计量资料以(±s)表示,多组间比较采用单因素方差分析,两组间比较采用独立样本t检验,组间差异分析采用χ2检验。P<0.05为差异有统计学意义。
2 结 果
2.1 各组大鼠关节炎发病一般情况及体质量比较
见表1。空白组大鼠毛色雪白有光泽、无脱毛现象,摄食正常,能自由活动,精神状态佳,足部无肿胀;模型组大鼠于造模第7天,大鼠毛色无光泽、皮肤少有脱毛,摄食及活动减少,少有精神萎靡现象,后足部及踝关节发红并伴有轻度肿胀;造模第14天大鼠背部脱毛明显、摄食及活动明显减少、多数精神萎靡,双侧后足踝关节肿胀明显并伴随局部充血现象,提示造模成功。给药治疗过程中,阳性对照组及风湿定胶囊治疗组大鼠摄食及精神状态较模型组明显改善,且随治疗时间延长,效果越明显。阳性对照组及各治疗组大鼠体质量在各阶段体质量增加量均高于模型组,模型组大鼠体质量增长缓慢,随风湿定胶囊剂量的增加,体质量增加量逐渐增大。
表1 各组大鼠不同阶段体质量比较(g,±s)
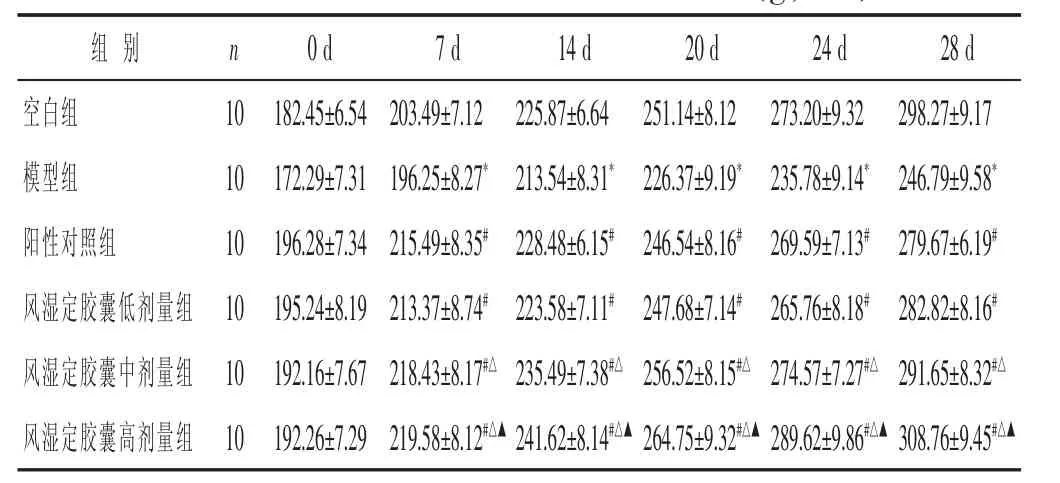
表1 各组大鼠不同阶段体质量比较(g,±s)
与空白组比较,*P<0.05;与模型组比较,#P<0.05;与阳性对照组比较,△P<0.05;与风湿定胶囊中剂量组比较,▲P<0.05。 下同
组 别 n空白组 10模型组 10阳性对照组 10 24 d 28 d 273.20±9.32 298.27±9.17 235.78±9.14* 246.79±9.58*269.59±7.13# 279.67±6.19#风湿定胶囊低剂量组 10 195.24±8.19213.37±8.74#223.58±7.11# 247.68±7.14# 265.76±8.18# 282.82±8.16#风湿定胶囊中剂量组 10 192.16±7.67 218.43±8.17#△ 235.49±7.38#△ 256.52±8.15#△ 274.57±7.27#△ 291.65±8.32#△风湿定胶囊高剂量组 10 192.26±7.29 219.58±8.12#△▲ 241.62±8.14#△▲ 264.75±9.32#△▲ 289.62±9.86#△▲ 308.76±9.45#△▲0 d 7 d 14 d 182.45±6.54203.49±7.12 225.87±6.64 172.29±7.31196.25±8.27*213.54±8.31*196.28±7.34215.49±8.35#228.48±6.15#20 d 251.14±8.12 226.37±9.19*246.54±8.16#
2.2 各组大鼠关节滑膜组织病理学比较 见图1。各组大鼠关节病理切片HE染色显示:空白组滑膜组织无炎症及血管增生,细胞细胞整齐;模型组滑膜组织有不同程度的增生且存在大量炎性细胞浸润,血管扩张;阳性对照组及风湿定胶囊治疗组中滑膜组织增生及炎症均有所改善。且风湿定胶囊中、高剂量组中滑膜组织细胞形态恢复规则,仅存在少量炎性细胞浸润,滑膜组织仅轻度增生,血管无扩张。

图1 各组大鼠关节组织病理学变化(HE染色,200倍)
2.3 各组大鼠不同阶段体质量及足肿胀体积比较
见表2。空白组及各治疗组各阶段大鼠足肿胀体积均显著低于模型组 (P<0.05);随风湿定胶囊剂量的增加,足肿胀体积逐渐减小,且差异具有统计学意义。
表2 不同阶段各组大鼠足肿胀体积比较(mL,±s)

表2 不同阶段各组大鼠足肿胀体积比较(mL,±s)
组 别 n空白组 10模型组 10阳性对照组 10 24 d 28 d 1.25±0.09 1.29±0.17 1.97±0.12* 2.05±0.15*1.81±0.13# 1.82±0.19#风湿定胶囊低剂量组 10 1.23±0.12 1.49±0.08# 1.55±0.11# 1.70±0.14# 1.79±0.18# 1.80±0.13#风湿定胶囊中剂量组 10 1.24±0.11 1.39±0.09#△ 1.46±0.06#△ 1.54±0.13#△ 1.58±0.12#△ 1.62±0.13#△风湿定胶囊高剂量组 10 1.25±0.13 1.32±0.05#△▲ 1.38±0.08#△▲ 1.43±0.08#△▲ 1.45±0.13#△▲ 1.49±0.14#△▲0 d 7 d 14 d 0.98±0.08 1.06±0.12 1.12±0.14 1.28±0.12 1.57±0.07* 1.73±0.15*1.25±0.15 1.50±0.06# 1.57±0.14#20 d 1.18±0.12 1.89±0.13*1.72±0.16#
2.4 各组大鼠滑膜组织中p-JAK3、p-STAT3蛋白表达比较 见表3和图2。各组间JAK3蛋白及STAT3蛋白表达水平差异无统计学意义(P>0.05);模型组及各治疗组大鼠关节滑膜组织中p-JAK3、p-STAT3蛋白表达水平均显著高于空白组(P<0.05);随风湿定胶囊剂量的增加,p-JAK3、p-STAT3蛋白表达水平逐渐下调,且差异具有统计学意义(P<0.05)。
表3 各组关节滑膜组织中p-JAK3、p-STAT3蛋白表达比较(±s)

表3 各组关节滑膜组织中p-JAK3、p-STAT3蛋白表达比较(±s)
组 别 n空白组 10模型组 10阳性对照组 10 JAK3蛋白 P-JAK3蛋白 STAT3蛋白 P-STAT3蛋白0.63±0.02 0.58±0.03 0.71±0.05 0.67±0.14 0.65±0.03 1.89±0.16* 0.75±0.06 2.75±0.22*0.62±0.05 1.28±0.18# 0.78±0.06 1.74±0.15#风湿定胶囊低剂量组 10 0.59±0.04 1.32±0.15# 0.76±0.04 1.69±0.17#风湿定胶囊中剂量组 10 0.64±0.03 1.16±0.19#△ 0.69±0.09 1.32±0.14#△风湿定胶囊高剂量组 10 0.62±0.02 0.86±0.08#△▲ 0.74±0.07 0.92±0.11#△▲
3 讨 论
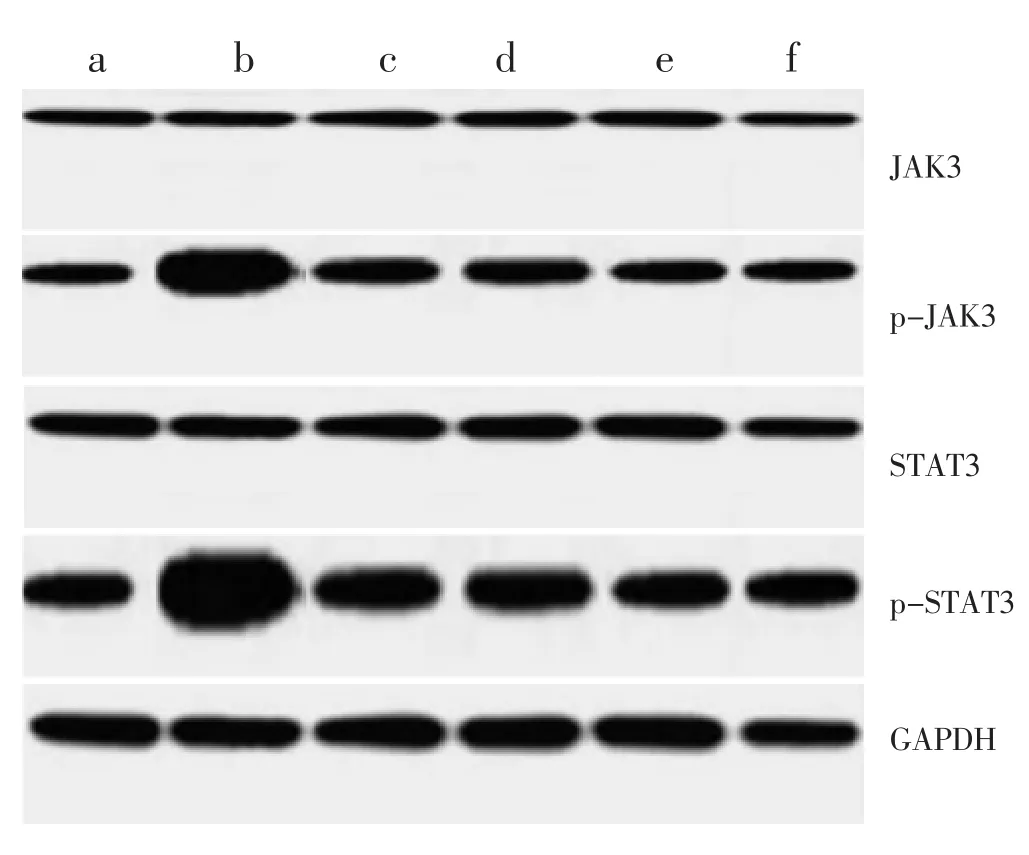
图2 各组大鼠p-JAK3、p-STAT3蛋白免疫印迹
RA是一种常见的以关节慢性炎症为主要特征的自身免疫性疾病,其发病率约为0.5%,且发病率随年龄增长而呈现逐渐增加的趋势[6]。因RA患者均存在不同程度的关节功能障碍严重影响工作能力,且因自身免疫系统失调,极易引起感染及心血管疾病,给患者身心及日常生活带来极大危害[7-8]。因目前针对RA的具体发病机理尚不明确,针对RA的治疗,临床西药多为激素类药物,长期服用引起的不良反应极大降低了患者顺应性,而导致病情无法得到及时控制[9]。而中医药则首先从其病机根源“弊病”出发,辨证治疗,以扶正祛邪为原则,整体把握其发病趋势,取得了可喜的疗效[10-11]。目前中医药针对RA的治疗常使用具有清热解毒、祛风散寒、活血化瘀等功效的中药复方,虽取得了一定疗效,但针对其具体的作用机理研究仍待进一步深入研究。
Janus激酶/信号转导子与转录激活子(JAK/STAT)信号通路是体内一种重要的多功能细胞因子转导通路,参与体内多种病理生理过程的调节,如细胞增殖分化、免疫调节、炎症反应、肿瘤的发生与发展等[12-13]。既往研究表明,JAK/STAT信号通路在癌症[14-15]、心血管系统[16]、代谢系统疾病[17]等发展过程中起重要调控作用,针对在RA发病过程中的研究较少。近年来随着临床研究者对RA的不断深入研究,针对RA中的相关JAK/STAT信号通路的调节机制研究亦逐渐增多,Malemud CJ等研究表明,部分抗抑郁药物可能通过调控脑组织中SAPK/MAPK、JAK/STAT等信号通路抑制炎症因子发挥对RA患者的治疗作用[18]。Walker JG等研究表明,随着对RA患者的治疗,RA患者关节滑膜组织中的 JAK3、STAT1、STAT4、STAT6 均逐渐降低[19]。wierkot J等[20]研究表明,RA患者关节滑液及外周血中STATs的表达水平均高于空白对照组,以上研究均提示JAK/STAT信号通路可能参与调控RA疾病的发生与发展。本研究结果表明,模型组及各治疗组大鼠关节滑膜组织中p-JAK3、p-STAT3蛋白表达水平均显著高于空白对照组(P<0.05),与上述研究结果一致。
风湿定胶囊由八角枫、白芷、徐长卿、甘草组成,具有活血通络、消肿、抗炎、镇痛等功效,为临床治疗RA的常用中成药之一,但针对其治疗机理目前尚不明确。在此背景下,本研究通过观察风湿定胶囊对RA大鼠滑膜组织病理、足肿胀体积的影响及测定关节滑膜组织中p-JAK3、p-STAT3蛋白表达水平的变化,探究其治疗RA的相关分子机制,以期为临床风湿定胶囊的推广提供一定理论依据。研究结果表明,治疗4周后,阳性对照组及风湿定胶囊治疗组中滑膜组织增生、炎症及大鼠足肿胀症状均较模型组有显著改善。且风湿定胶囊中、高剂量组中滑膜组织细胞形态恢复规则,仅存在少量炎性细胞浸润,且滑膜组织仅轻度增生,血管无扩张,接近空白组;随风湿定胶囊剂量的增加,大鼠足肿胀体积均逐渐减小,且中、高剂量组治疗效果显著优于阳性对照组 (P<0.05);随风湿定胶囊剂量的增加,关节滑膜组织中p-JAK3、p-STAT3的蛋白表达水平均逐渐下调,且中、高剂量组下调效果显著优于阳性对照组(P<0.05);提示风湿定胶囊可能通过下调p-JAK3、p-STAT3蛋白蛋白的表达调控JAK/STAT信号通路,进而改善RA的病症。
综上所述,风湿定胶囊可能通过下调p-JAK3、p-STAT3蛋白的表达,参与JAK/STAT信号通路的调控,进而发挥对RA的治疗作用。但具体的信号调控机制有待于进一步深入研究及大量临床研究进行验证。

