噪声引起小型猪耳蜗炎症复合体的激活及蛋白质组学研究
塞娜 袁硕龙 郭维维 唐朝颖 张桐 赵伟豪 陈林军 徐良慰 时晰张悦 邱仕伟 杨仕明 韩维举
中国人民解放军总医院耳鼻咽喉头颈外科,解放军总医院耳鼻咽喉研究所聋病教育部重点实验室,聋病防治北京市重点实验室,军事声损伤防护实验室(北京100853)
【关键字】噪声性耳聋;炎症复合体;蛋白质组学iTRAQ;白介素-1β;NLRP3
噪声引起的听力损伤是多种因素综合作用的结果,而损伤程度又因患者的年龄、易感性、噪声的强度、接触时间、频谱特性的不同而有所差异。噪声引起听觉系统损伤机制包括机械损伤、耳蜗微循环损伤、代谢紊乱导致毛细胞死亡等,而噪声损伤引起内耳的免疫/炎症可能是噪声损伤的重要环节,近年来蛋白质组学的发展使得我们有可能阐明耳蜗炎症复合体在耳蜗噪声损伤中的作用。同位素标记的相对和绝对定量技术(isobaric tags for relative and absolute quantitation,iTRAQ)[1,2]是美国应用生物系统公司(Applied Biosystems Incorporation,ABI)研发的一种多肽体外标记技术。该技术通过iTRAQ试剂特异性标记蛋白质的氨基酸N端及赖氨酸侧链,而后进行串联质谱分析,可同时比较多种不同样品中蛋白质的相对/绝对含量。基于其灵敏度高、重复性好、准确度高、高通量等优势[3],目前已被广泛应用于基础和临床研究的相关领域[4]。
小型猪的内耳形态结构与听功能方面与人类具有高度相似性[5-6]。本研究采用iTRAQ技术研究小型猪耳蜗蛋白质组在噪声暴露前后的差异,并进行生物学分析,以揭示免疫和炎症等因素对噪声性听力损伤的作用机制。
1 材料与方法
1.1 实验动物
标准化实验用小型猪30只,体重5kg左右,性别不限,由涿州市康宁小型猪养殖有限公司提供,集中饲养于21-24℃、相对湿度50-80%的环境中。动物均无噪声接触史,未使用过耳毒性药物,并且耳镜检查鼓膜正常。
1.2 小型猪稳态噪声性聋模型的建立
根据实验目的不同将动物随机分为正常对照组(n=10),噪声暴露后一天组(n=10)和噪声暴露后七天组(n=10)。将清醒的小型猪置于50×30×25cm的笼内,放置于密闭声场,使用120dB(A)白噪声连续暴露2天,每天3小时。
1.3 听性脑干反应测试(Auditory brainstem response,ABR)
用速眠新Ⅱ0.25ml/kg+戊巴比妥钠0.03g/kg肌肉注射复合麻醉动物。待其进入深度麻醉后,连接TDT电极。选择短声“Click”,短纯音“tone burst”:设定频率包括2kHz、4kHz、8kHz、16kHz、24kHz,声音强度设定为为20-90dB SPL,按10dB SPL递减,在接近听阈时给声递减间隔为5dB SPL。同样方法测试双侧耳。以能分辨出可重复的ABRⅤ波的最低刺激强度为阈值。具体电极连接方式及参数设置详见既往文献报道[7]。
1.4 同位素标记的相对和绝对定量(Isobaric tags for relative and absolute quantitation,iTRAQ)技术
三组各随机抽取3只动物,麻醉后迅速断头处死,取出双侧耳蜗后用PBS冲洗后迅速放入液氮中冷冻10min,之后置于-80℃冰箱保存。
iTRAQ实验流程:
耳蜗样品制备(提取蛋白)→SDS-PAGE电泳检测蛋白质量→(样品蛋白合格)胰蛋白酶Trypsin酶解→iTRAQ试剂标记分级→质谱分析→软件分析及统计学分析→生物信息学分析(GO分析、KEGGPathway)。
1.4.1 蛋白质抽提及定量
用研钵将猪耳蜗研碎,蛋白质提取及定量方法详见既往文献报道[8]。根据标准品绘制蛋白定量标准曲线,得到相关系数R2=0.9714>0.95,认为蛋白量与OD吸光值有线性相关关系。12%的SDS-PAGE电泳测定总蛋白在14-100kDa分子量范围内得到一定的分离,三组样本组内的蛋白条带具有相似的带型。
1.4.2 蛋白样品胰蛋白酶消化与iTRAQ试剂肽段标记
具体实验方法见既往文献报道[8]。iTRAQ试剂标记肽段:各组样品肽段分别取约100μl,按照AB公司 iTRAQ Reagent-8plex Multiplex Kit(AB SCIEX)试剂盒说明书进行肽段标记,不同样品用不同大小的同位素标记,标记信息见表1。正常对照组行2次生物学重复(N1,N2),噪声后一天组(NE1d-1,2,3)和七天组(NE7d-1,2,3)分别行3次生物学重复。
1.4.3 质谱分析
毛细管高效液相色谱及质谱鉴定方法详见既往文献报道[8]。每份样品经毛细管高效液相色谱分离后用Q-Exactive HF质谱仪进行质谱分析。
1.4.4 数据分析
原始质谱数据:质谱分析原始数据为RAW格式文件,用软件Sequest和Proteome Discoverer进行搜库定性及定量分析。
数据库:uniprot_Sus.scrofa_160920.fasta
搜库:搜库时将RAW文件通过Proteome Discoverer提交至Sequest服务器,选择已经建立好的数据库,然后进行数据库搜索。
1.5 Western blot检测
三组各随机抽取3只动物,抽提蛋白及蛋白质定量方法同前述。配置10ml的10%分离胶,4ml的5%浓缩胶浓度。待检测蛋白样品上样量20μg/孔,浓缩胶恒压80V,约30分钟;分离胶恒压120V,转膜2小时。用5%BSA-TBST按1:1000稀释一抗(山羊NLRP3多克隆抗体,兔Caspase-1多克隆抗体,兔IL-1β,小鼠NF-κB p65单克隆抗体,兔TNF-α多克隆抗体,小鼠β-actin单克隆抗体),4℃冰箱孵育过夜。TBST洗膜5min×3次,加入5%脱脂奶粉-TBST稀释的二抗,室温孵育40分钟,TBST洗膜,10min×3次。ECL 显影、定影后,以目的蛋白/β-actin内参蛋白灰度比较耳蜗中上述蛋白质的表达量。
1.6 荧光实时定量PCR
扩增引物:NLRP3:Forward:5'-GACCTCAGCCAAGATGCAAG-3',Reverse:5'-TCTGATGCCCAGTCCAACAT-3';Caspase-1:Forward:5'-CCTCGAACTCT CCACAGGTT-3',Reverse:5'-GAAGACGCAGGCTTAACTGG-3';IL-1β:Forward:5'-CACACATGCTGAAGGCTCTC-3',Reverse:5'-GGGTGGGCGTGTTATCTTTC-3'; TNF-α:Forward: 5'-AAGGTCAACCTCCTCTCTGC-3',Reverse:5'-CCTCCCAGGTAGATGGGTTC-3';NF-κB:Forward:5'-TGCATCCACAGCTTCCAGAAC-3',Reverse:5'-CGCACAGCATTCAGGTCGTA-3';GAPDH:Forward:5'-TGGAAAGGCCATCACCATCT-3',Reverse:5'-ATGGTCGTGAAGACACCAGT-3'。使用Trizol试剂提取耳蜗中的总RNA。通过光谱测定RNA样品的浓度和纯度。使用实时荧光定量PCR系统进行实时逆转录PCR(qRT-PCR)。GADPH 作为内参。2-△△CT方法对qRT-PCR的基因表达相对变化进行分析。CT值:每个反应管内的荧光信号到达设定的阈值时所经历的循环数。△△CT=△CT(样品A)-△CT(样品B),△Ct(样品X)=CT(样品X,目的基因)-CT(样品X,内参基因)。
1.7 统计分析
数据结果用平均值±标准差()表示。通过单因素方差分析分析比较三组之间的差异,两组数据比较使用t检验。认为P≤0.05表示差异有统计学意义。

表1 样本标记信息Table 1 Information of sample tag
2 结果
2.1 小型猪噪声性聋模型听力结果
所有实验动物噪声处理前均接受ABR测试,结果显示30只正常小型猪ABR阈值为35.4±2.6 dB SPL。对三组动物进行ABR-click、tone burst测试,正常对照组小型猪10只(20耳)、噪声后一天组小型猪10只(20耳)、噪声后七天组小型猪10只(20耳),测试结果及统计分析详见表2。用SPSS 19.0统计软件进行单因素方差分析,噪声后一天内平均听阈提高到72.1±4.1dB SPL,在4k Hz处听力损失最严重,高频听力损失较低频严重;噪声后七天平均听阈可恢复至52.8±4.7dB SPL水平,4k Hz以上听力损失恢复较低频恢复稍差。
2.2 iTRAQ实验结果
分级脱盐合并后的6个fraction经质谱分析搜库,结果以PSM FDR≤0.01,Protein FDR≤0.01筛选过滤,共鉴定到蛋白质2158种,相对分子量集中在10-110kDa,蛋白质标记效率:99.2%。
使用Proteome Discover蛋白质组学分析软件实现iTRAQ定量。根据定量结果,设定在1.2差异倍数(fold change,FC)阈值条件下,进行差异蛋白筛选,FC≥1.2为上调,FC≤0.83为下调,0.83<FC<1.2认为表达量无明显差异。结果噪声暴露后较正常组具有显著差异表达的蛋白质共227个,噪声后1天和7天组显著差异蛋白有162个。样品定量结果中大部分蛋白质FC应接近1。运用频数分布直方图对iTRAQ定量数据进行分析,两组样本定量比值FC取Log2对数,见图1。

图1 蛋白定量比值分布直方图Fig.1 Distribution of protein quantitative ratio histogram
2.3 生物信息学分析
2.3.1 Gene Ontology(GO)分析
通过搜索Gene Ontology数据库(http://www.geneontology.org)进行基因本体分析是生物信息领域中一个非常重要的方法和工具。通过建立一套具有动态形式的控制字集(controlled vocabulary),来解释基因和蛋白质在细胞内所发挥的作用,从而全面描述生物体中基因和基因产物的属性。GO注释分析图详见图2。
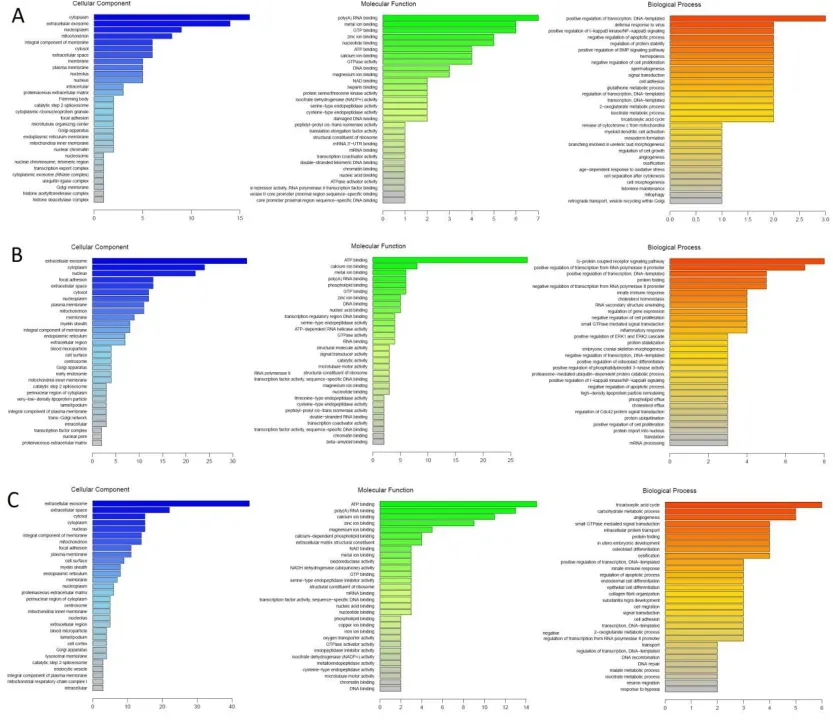
图2 差异蛋白GO注释图Fig.2 GO annotations of differential proteins

表2 三组小型猪ABR阈值结果(dB SPL)Table 2 ABR threshold for three groups of miniature pigs(dB SPL)
GO总共有三个本体(Ontology):
1)细胞组成(Cellular Component,CC):是一个广义的结构对象,这可能是一个亚细胞结构又或者是一个蛋白生产组件。本研究中,差异表达蛋白主要富集在细胞内(Cell)和细胞器上(Organelle)。
2)分子功能(Molecular Function,MF):描述生物活动,也表示一些具体的对象(分子或复合物)执行的操作。本研究中,差异表达蛋白主要富集在蛋白结合(binding)和催化活性(catalytic activity)。其中富集在蛋白结合功能的相关蛋白包括:组蛋白H3,ATP合酶,Annexin,鸟苷酸结合蛋白等;富集在催化活性功能的蛋白包括:HTRA3,LTA4H,凋亡诱导因子(AIF)等。
3)生物过程(Biological Process,BP):是一系列分子功能相互配合的事件,通常都有多个不同的步骤参与。本研究中,差异表达蛋白主要富集在细胞代谢过程(cellular metabolic process)、生物调节(biological regulation)、免疫过程(immune system process)、信号转导(signaling)、应激反应(response to stimulus)等生物学过程。其中富集在细胞代谢过程的蛋白包括:琥珀酸脱氢酶辅酶,NADH辅酶,异柠檬酸脱氢酶,ATP合酶,丙酮酸羧化酶等;富集在生物调节的蛋白包括:热休克蛋白A1B,细胞色素C,钙蛋白酶抑制素等;富集在免疫过程的蛋白包括:ASC,caspase-1,IL-1β,血管生成素,CD59等;富集在信号转导的蛋白包括:NF-κB p65,TGF-β,趋化因子CCL21等;富集在应激反应的蛋白包括:ICAM-1,补体C3,CCL14等。
2.3.2 KEGG Pathway代谢通路注释
在生物体内,不同蛋白质间相互影响、协同作用行使其生物学行为,KEGG Pathway是通过检索有关信号通路(http://www.kegg.jp/kegg/pathway.html)公共数据库,分析基因或蛋白质参与的最主要生化代谢途径和信号转导途径。差异蛋白的KEGG功能注释,见图3所示。本研究中,富集的KEGG pathway包括:阿尔兹海默病信号通路(Alzheimer's disease),MAPK信号通路(MAPK signaling pathway),吞噬体信号通路(Phagosome),氧化磷酸化通路(Oxidative phosphorylation),帕金森病信号通路(Parkinson's Disease),亨廷顿病信号通路(Huntington's disease)等。
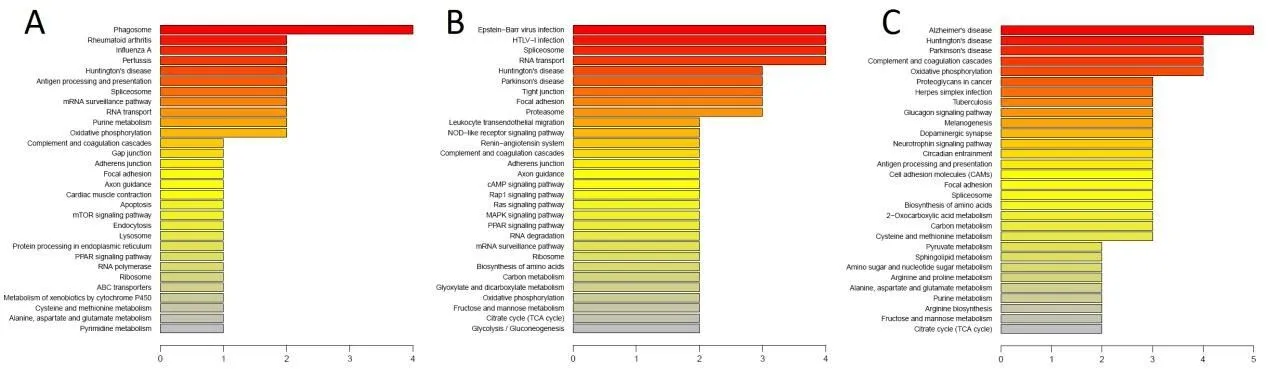
图3 差异蛋白信号通路(KEGG pathway)注释图Fig.3 Annotated map of the KEGG pathway
2.4 噪声刺激引起耳蜗炎症复合体相关蛋白的变化
Western blot检测正常对照组、噪声后一天组和噪声后七天组小型猪耳蜗蛋白质含量,发现均有NLRP3,Caspase-1,IL-1β,NF-κB 和 TNF-α的表达,在噪声暴露后一天组耳蜗中上述蛋白均发生显著上调,而在噪声暴露后七天组耳蜗中上述蛋白又有不同程度下调,但仍高于正常对照组,三组间灰度比值比较应用单因素方差分析,具体结果见图4。
荧光实时定量PCR检测对照组、噪声后一天组、噪声后七天组小型猪耳蜗的mRNA水平,NLRP3,Caspase-1,IL-1β,NF-κB 和TNF-α的mRNA水平变化趋势与蛋白质表达趋势具有一致性,三组间2-△△CT比较使用单因素方差分析,具体结果见图4。
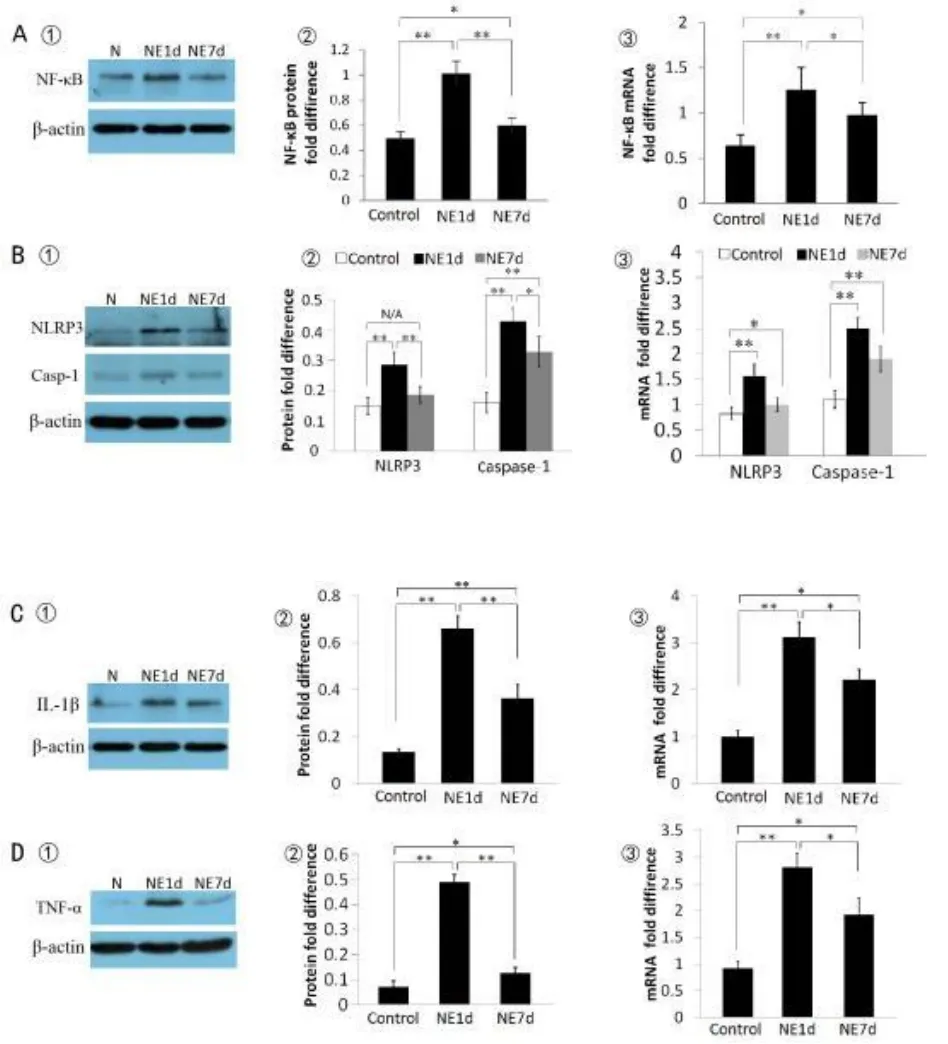
图4 噪声刺激引起耳蜗炎症复合体及相关蛋白的变化情况Fig.4 Changes of cochlea inflammasome-related proteins and mRNAlevels
3 讨论
3.1 小型猪稳态噪声性听力损伤特点
本研究利用120dB(A)白噪声对小型猪进行连续噪声暴露,首次成功构建了小型猪稳态噪声性耳聋模型。小型猪是实验动物中除灵长类外和人类进化关系最近的物种,但较灵长类来说不存在伦理问题,它与人类在基因、解剖及病理生理学方面十分相似,尤其是内耳器官的结构与人类极为接近,耳蜗鼓阶尺寸与人类基本一致[5-6]。小型猪的耳蜗电生理测试与人类非常相似,ABR可以分化出七个波,以Ⅱ波和Ⅴ波最稳定、重复率最高,且波形和潜伏期都与人类相近,而人的ABR以Ⅴ波最显著,小鼠、大鼠、豚鼠等只能分化出Ⅰ-Ⅴ波,说明猪在整个听觉传导通路上的神经核团与人类基本相似。
我们发现小型猪NIHL早期在4kHz听力损失最严重,高频听力损失重于低频,这一表现与人类NIHL基本一致。研究表明小型猪外耳道平均长度4.1cm[9],与人类外耳道3cm接近,外耳道共振频率都在3-4kHz,对噪声中该频率的声音成分增益最大,因此对耳蜗的破坏力也最大。陈志婷等[7]用145dB SPL脉冲噪声首次成功建立爆震性耳聋小型猪模型,发现50次以上的脉冲噪声暴露后即刻可造成听阈平均升高70dB SPL以上,这比本研究中稳态噪声暴露后平均听阈上升38.4dB SPL高很多,说明脉冲噪声对听觉系统的破坏更严重;他们还发现噪声暴露后一周内听力恢复最快,第2-8周的听阈基本稳定,这与本研究中稳态噪声性聋模型听阈改变趋势相一致。此外,脉冲噪声损伤后耳蜗中转和底转Corti氏器结构虽基本保持正常,但内、外毛细胞均出现不同程度的缺失[5,7],而在稳态噪声暴露后未观察到耳蜗有内毛细胞的明显缺失,外毛细胞有部分缺失,以中、底转为最重,这说明脉冲噪声在损伤急性期对耳蜗的损伤以机械性损伤为主,而120dB(A)的稳态噪声对耳蜗的损伤主要以代谢性损伤为主。
3.2 噪声刺激对小型猪内耳影响的蛋白质组学研究
强噪声刺激后内耳产生大量自由基,包括活性氧簇(reactive oxygen species,ROS)和活性氮簇(reactive nitrogen species,RNS)[10],由于内源性的抗氧化物酶不足以清除掉过量堆积的自由基,进而引起细胞脂质过氧化以及DNA、蛋白质、线粒体等结构的损伤[11,13]本研究基于iTRAQ技术对正常对照组、噪声暴露后一天组和七天组小型猪耳蜗筛选出有显著性差异的蛋白质进行GO分析,发现差异表达蛋白质主要富集在细胞代谢过程、生物调节、免疫/炎症过程、信号转导、防御应激反应等生物学过程。发现线粒体氧化呼吸链相关蛋白琥珀酸脱氢酶辅酶、NADH辅酶、ATP合酶等蛋白质在噪声后发生差异表达,KEGG Pathway分析中发现氧化磷酸化通路发生下调。众所周知,氧化呼吸链是细胞内ROS的最主要来源,而氧化磷酸化过程是ROS的重要去路,ROS以及噪声暴露后耳蜗内的缺血缺氧状态又易损伤线粒体DNA(mtDNA)导致线粒体氧化磷酸化功能障碍,如此形成恶性循环,引起耳蜗内活性氧自由基过量堆积。辅酶Q10可抑制线粒体脂质过氧化、参与ROS的清除,Fetoni等发现提高辅酶Q10的溶解性可有效抑制线粒体的过氧化,并减轻NIHL的听力损失[10,16-17]。
噪声暴露后5min即可观察到耳蜗内毛细胞损伤区域有且仅有凋亡发生,30min后可见凋亡和坏死同时存在[18],说明NIHL早期毛细胞死亡方式主要是凋亡,而后期则坏死和凋亡同时存在[19]。本研究发现凋亡诱导因子(AIF)在噪声暴露后1天内表达上调,可能是mtDNA损伤导致AIF自线粒体释放后进入细胞核,通过依赖caspase-3通路或非依赖caspase-3通路诱导细胞凋亡[20],也有报道表明在坏死和凋亡毛细胞中都有AIF的转移[19]。此外,本研究还发现噪声损伤后耳蜗内细胞色素C表达上调,进一步说明噪声暴露导致的细胞缺氧、自由基损伤等破坏了线粒功能,使细胞色素C、AFI释放,诱导细胞凋亡,最终造成细胞结构破坏。
3.3 噪声引起小型猪耳蜗炎症复合体的激活
既往由于BLB这一解剖结构的存在,使内耳长期被认为是一“免疫豁免器官”,但晚近的多项研究证实内耳自身具有很强的免疫能力。有研究对耳蜗感觉上皮进行高通量RNA测序,发现噪声暴露后大部分表达变化的基因都与免疫和炎症反应有关[21-22],说明免疫/炎症反应不仅是NIHL的重要机制,而且是噪声刺激损伤耳蜗的主要反应。本研究着重筛选分析了噪声暴露后耳蜗中免疫和炎症相关的差异表达蛋白,发现噪声暴露后NF-κB和炎症复合体相关蛋白ASC、caspase-1发生差异表达,提示噪声损伤激活了NLRP3-炎症复合体。未激活时NLRP3在细胞内的表达量很低,一般认为,NLRP3-炎症复合体的激活需要两个信号:第一信号通过 ROS、TNF-α、IL-1 等结合 Toll样受体(Toll-like receptors,TLRs)诱导NF-κB活化使得炎症小体的关键蛋白NLRP3、pro-IL-18、pro-IL-1β表达上调[23-24],而强噪声暴露通过TLRs信号转导通路激活免疫/炎症反应已得到证实[25-26],第二信号刺激NLRP3后借助ASC募集并剪切pro-caspase-1为有活性的caspase-1,促使下游的IL-1β和IL-18成熟并释放或引发细胞焦亡(pyroptosis)[23]。我们推测噪声损伤产生的第二信号包括:胞外ATP刺激诱导钾离子通道开放、引起胞内K+降低、Ca2+内流,溶酶体酶释放以及细胞内ROS升高激活NLRP3,而目前研究认为ROS升高应该是炎症复合体激活的主要原因[23]。促炎因子IL-1β可募集白细胞损伤神经元,并导致NO、TNF-α和IL-6从小胶质细胞中分泌,引起神经毒性[27]。因此,NLRP3炎症复合体及其下游因子IL-18、IL-1β可进一步促进炎症因子如TNF-α和IL-6分泌,TNF-α和IL-6再通过结合TLRs激活NF-κB信号通路引发细胞凋亡、坏死,后者又能作为第一信号激活炎症复合体,推测耳蜗内可形成上述循环,加剧最初的炎症反应。正常情况下,炎症复合体作为机体固有免疫的一部分可防御外界细菌、病毒感染,维持自身稳态,但当其活化失控,产生过度的炎症反应就会发生疾病,如NLRP3基因突变会导致Muckle-Wells综合征、家族性地中海热等。研究发现有进行性感音神经性听力障碍的Muckle-Wells综合征患者,经过IL-1β抑制剂治疗后大部分听力都得到改善或稳定[28]。
目前认为,NLRP3-炎症复合体与阿尔兹海默病(Alzheimer's disease,AD)、动脉粥样硬化、糖尿病、帕金森病(Parkinson's Disease,PD)等退行性疾病密切相关[29-30],发现外源性的炎症细胞因子可以改变血-脑屏障的通透性从而进入大脑[31],也可以由病原相关分子模式(PAMPs)和损伤相关分子模式(DAMPs)刺激直接在大脑中产生,应用IL-1阻滞剂后可促进神经功能的愈合。本研究发现噪声暴露后差异表达蛋白KEGG pathway在AD、PD及亨廷顿病等信号通路有富集,提示NIHL可能与这些中枢神经系统的退行性疾病在发生机制上有所重叠,氧化应激损伤在退行性疾病的作用已较为明确,而炎症复合体激活可能是介导这些疾病发生、发展的重要机制。老年性聋的耳蜗内微血管发生退行性改变、微循环紊乱引起内耳缺血缺氧,线粒体功能障碍释放ROS,引起听力损伤[30],并且已有研究证实老年性小鼠通过ROS通路激活耳蜗内NLRP3介导的炎症复合体[32],提示NIHL和年龄相关的退行性疾病也可能是依此途径激活炎症复合体进而推动疾病的进展。

