多肽对凡纳滨对虾生长、消化酶和免疫酶活力的影响
廖栩峥,陈金荣,刘永胜,秦海鹏,王 博,胡世康,陈燮燕,曲 朋,孙成波
(1.广东海洋大学水产学院,广东湛江 524088;2.烟台市水产研究所,山东烟台 264003;3.山东深海生物股份有限公司,山东烟台 265500)
抗菌肽最早是与1972年由科学家FERNANDEZ,et al[1]的研究中得知植物中含有具抑制细菌活性的硫素,同年瑞典科学家BOMAN,et al[2]在果蝇体内发现了抗菌肽及其作用,之后在1989年HULTTMARK,et al[3]从惜古比天蚕蛹中分离出第一种抗菌肽,并且命名为天蚕素。从此之后,人们陆续可以从植物、两栖动物、哺乳动物、昆虫等各种生物中提取得到不同的抗菌肽。截止目前,经过报道的抗菌肽种类已高达2 901种。生物活性多肽是目前普遍存在于动植物、细菌体内的一类小分子多肽,小分子多肽具有合成成本低、提供能量速度快、消化吸收利用率高、可提高新陈代谢和具有高效抗病能力等优点[4-7],多肽菌素S100专用型源自动物肠道分离的一株有益菌,经体外培养、发酵调控产生的一组活性物质。
凡纳滨对虾Litopenaeus vannamei具有生长速率快、耐高温及养殖区域广等优点,是世界三大经济养殖对虾之一[8],但是近年来随着对虾养殖业的快速发展,其病害为题日益严重。为预防和治疗对虾的疾病造成的影响,部分对虾养殖户滥用化学消毒及和抗生素,导致病株的抗药性加强并且对养殖水体造成破坏,同时也给食品安全带来巨大的安全隐患。抗菌肽的发现可以提高凡纳滨对虾的生长速率,加强对虾的体质,是水产动物防御系统的主要成分之一,对此可以提高水产动物的抗病能力。多肽菌素在水产中的研究现在主要集中在分离纯化以及抗菌活性方面[9-11],在小分子多肽对虾蟹类养殖生产性能方面研究较少[12-13],本实验主要研究在普通饲料中按比例添加两种多肽菌素,研究对凡纳滨对虾生长、消化酶和免疫酶的影响,为多肽菌素在凡纳滨对虾生产中的推广提供依据。
1 材料与方法
1.1 试验材料
试验地点在广东海洋大学东海岛海洋生物研究基地进行。试验挑选体长为2.35±0.40 cm,体质量为0.16±0.07 g的凡纳滨对虾作为试验用虾,池塘面积为800 m2,分别放养于12个网箱中,网箱规格为3 m×3 m×1.5 m,每一个网箱放养3 000尾。多肽实验产品由山东深海生物科技股份有限公司提供的多肽菌素S100专用型(主要成分:Υ-多肽菌素,靶心裂解素,益生菌,裂解酶)。
1.2 试验分组
多肽采用菌素S100专用型分别按照0.2%、0.5%、1.0%的添加量混合添加基础饲料,组别名称为S100专用型0.2%、S100专用型0.5%、S100专用型1.0%,同时设计空白对照组,每组3个重复。
1.3 饲养管理
试验时间为123 d,投喂时间为07:00、11:00、18:00、23:00,每天观察对虾的摄食情况和生长情况。试验期间养殖水体盐度为 20.92~25.61,连续充氧,pH 6.61~8.31,温度为 23.0~34.2 ℃[2]。
1.4 测定指标
1.4.1 生长指标
试验期间,每隔10 d分别从每一个网箱中随机取30尾对虾,测量其体长(眼睛前端到虾尾带肌肉部位的末端)、分子电子天平测量体质量。
1.4.2 消化酶和免疫酶测定
试验结束后每一个网箱取15尾对虾剥离肝胰脏,分别称重,按比例加入相应缓冲液制成10%匀浆液,3 000~5 000 r/min,4℃低温离心15~20 min,取上清液分装与1.5 mL Eppendorf管中,并立即保存到-80℃冰箱中,备用进行消化酶、免疫酶的测定。脂肪酶(LPS)、淀粉酶(AMS)、溶菌酶(LZM)和超氧化物歧化酶(SOD)活性,采用南京建成生产的试剂盒测定。
1.4.3 数据统计与分析
生长指标主要计算公式:特定生长率(Specific growth rate,SGR)=100%×[ln(终末体质量)-ln(初始体质量)]/试验时间
试验数据运用平均值±标准差表示。采用SPSS17.0软件对数据进行单因素方差分析,结合Duncan’s法进行多重比较,P<0.05时处理组间差异有统计学意义。
2 结果与分析
2.1 对虾生长指标变化规律
0.2 %添加组的日平均增长是最快,对照组的日平均增长最慢;试验后平均体长最大的组别是0.2%添加组(10.61±0.538 cm),试验后平均体长最小的组别是对照组(9.98±0.574 cm);0.2%添加组和1.0%添加组与对照组对比存在显著性差异(P<0.05),具体见表1。
0.2 %添加组的特定生长率是最大,对照组的特定生长率是最慢;试验后平均体质量最大的组别是0.2%添加组(14.270±2.248 g),实验后平均体质量最小的组别是对照组(12.200±1.877 g);0.2%添加组与对照组对比有显著性差异(P<0.05),具体见表2。
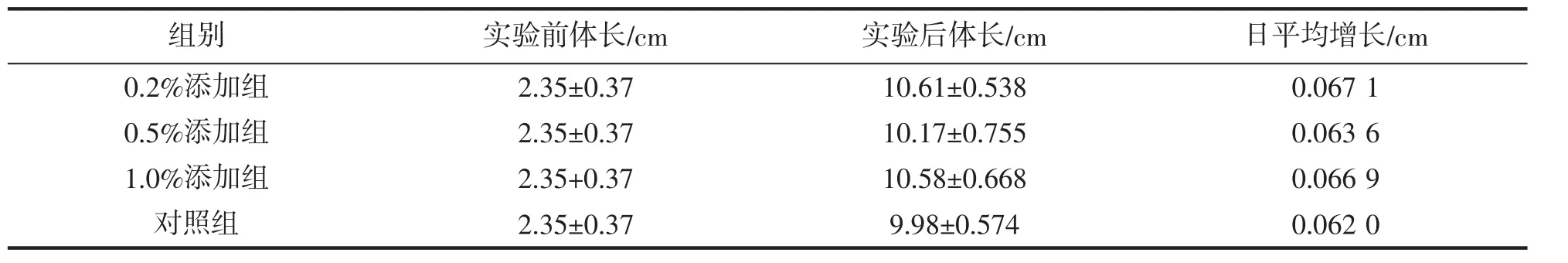
表1 凡纳滨对虾体长变化Tab.1 Changes in body length of L.vannamei

表2 凡纳滨对虾体质量变化Tab.2 Changes in body mass of L.vannamei
2.2 淀粉酶(AMS)活性
0.5 %添加组的淀粉酶活力最高为3.04 U/mgprot,1.0%添加组的淀粉酶活力最低为0.91 U/mgprot,0.2%添加组、0.5%添加组和1.0%添加组3个试验组之间存在显著性差异(P<0.05);S100专用型3个浓度梯度的淀粉酶活力与对照组都存在显著性差异(P<0.05),具体如图1所示。
2.3 脂肪酶(LPS)活性
0.5 %添加组的脂肪酶活力最高为665.43 U/gprot,0.2%添加组的脂肪酶活力最低为101.75 U/gprot;0.5%添加组的脂肪酶活力与其他2个浓度梯度存在显著性差异(P<0.05),试验组3个浓度梯度的脂肪酶活力与对照组之间存在显著性差异(P<0.05),具体如图2所示。
2.4 超氧化物歧化酶(SOD)活性
0.5 %添加组的超氧化物歧化酶活力最高为60.80 U/mgprot,对照组的超氧化物歧化酶活力最低为5.70 U/mgprot;0.2%添加组、0.5%添加组和1.0%添加组3个试验组之间存在显著性差异(P<0.05),对照组的SOD与0.5%添加组和1.0%添加组的SOD差异明显(P<0.05),具体如图3所示。
2.5 溶菌酶(LZM)活性
0.5 %添加组的溶菌酶活力最高为44.35 μg/mgprot,对照组的溶菌酶活力最低为0.30 μg/mgprot;0.5%添加组的溶菌酶活力与对照组对比差异显著(P<0.05)(图 4)。
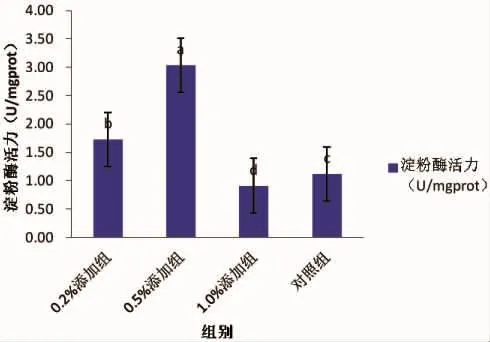
图1 淀粉酶活力Fig.1 Amylase activity
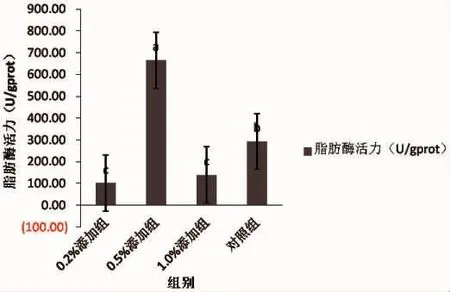
图2 脂肪酶活力Fig.2 Lipase activity
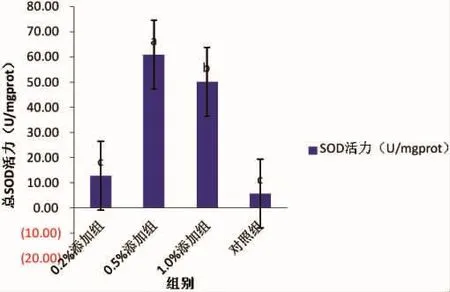
图3 超氧化物歧化酶活力Fig.3 Superoxide dismutase activity
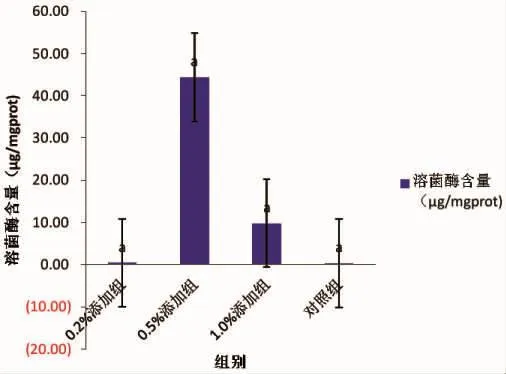
图4 溶菌酶活力Fig.4 Lysozyme activity
3 讨论
3.1 饲料中添加多肽[3]菌素对凡纳滨对虾生长性能的影响
生物活性多肽可以促进水生动物的生长,从而改善其生产性能,抗菌肽作为一种饲料添加剂已经在畜牧业中得到广泛的应用,张海文等[14]在研究中发现抗菌肽可以提高仔猪的生长性能和提高仔猪的肉质品质,还有研究表明,抗菌肽可以促进肉鸡生长和提高产肉率[15]。在多肽菌素对对虾养殖方面,王广军等[16]在饲料中添加1.0 g/kg抗菌肽,在日生长速度、相对增重率、饲料系数和成活率等方面均显著高于对照组;黄自然等[17]在池塘养殖凡纳滨对虾的试验中发现,饲料中添加4 mL/kg的抗菌肽与添加1.0 mg/kg的金霉素比较,抗菌肽的收获率和收获量均显著提高。多肽菌素的主要成分是多肽,其他成分只是起辅助作用,从生长实验的结果来看,多肽菌素在饲料中添加对凡纳滨对虾的终末体质量和特定生长率都优于对照组。以特定生长率来看,最适合添加的多肽菌素和其添加的比例是0.2%添加组[4]。同时又研究表明多肽可以提高凡纳滨对虾的成活率,DESTOUMIEUX,et al[18]研究发现抗菌肽的抗菌活性可以在对虾的蜕皮周期中提供防御保护,因此在饲料中添加抗菌肽可以提高成活率。
3.2 多肽对凡纳滨对虾消化酶和免疫酶的影响
本试验结果表面,0.5%添加组对凡纳滨对虾的脂肪酶(LPS)和淀粉酶(AMS)活性最高,与对照组对比其效果明显(P<0.05)[19]。对于抗菌肽的研究,人们在凡纳滨对虾的养殖中最关注的还是其能够提高凡纳滨对虾的免疫性功能。在感染期间,非特异性免疫系统比特异性免疫系统更为重要。一些非特异性免疫酶的活力值可以反映凡纳滨对虾免疫性高低的指标。抗菌肽可以有效提高水产动物对病原菌的抵抗能力[20],有研究表明,在饲料中添加抗菌肽可以使湘云鲫中LZM活性提高[21];在饲料中添加0.4%抗菌肽可以提高河蟹免疫和抗氧化能力起到明显的作用,可以显著提高肝脏和肌肉中超氧化物歧化酶(SOD)的活力水平[22];溶菌酶(LZM)和超氧化物歧化酶(SOD)是非特异性免疫系统中的重要组成部分[23],在甲壳动物的免疫中起着重要的作用[24]。对虾的抗菌肽主要是在血液中的血细胞中表达,这也是免疫反应的主要部位,抗菌肽表达的血细胞可以快速迁移到被病原感染的部位起到对抗的作用[25]。在本实验中0.5%的添加组,对虾肝脏内的LZM和SOD活性[5]最高,对照组的活性最低,并且存在显著性差异(P<0.05),说明选择合适的多肽菌素添加量添加进人工配合饲料中可以有效提高凡纳滨对虾的免疫能力。

