山楂叶总黄酮对非酒精性脂肪性肝病大鼠肝脏FXR/SREBP-1c表达的影响*
陆永娟 陈芝芸 何蓓晖# 严茂祥
1 浙江省嘉善县第一人民医院 浙江 嘉善 314100 2 浙江中医药大学附属第一医院 浙江 杭州 310006
非酒精性脂肪性肝病(NAFLD)是无过量饮酒史、以肝实质细胞脂肪变性和脂肪贮积为特征的临床病理综合征,是临床常见的慢性肝病之一[1]。NAFLD的发病机制尚未完全阐明,肝脏脂质沉积是其发病的基础。近来研究发现,胆汁淤积、胰岛素抵抗、游离脂肪酸增多、氧化应激与脂质过氧化等代谢异常可以导致NAFLD的发生、发展,法尼酯衍生物受体(FXR)可以调节胆汁酸、糖、脂的代谢,可能参与NAFLD的发生发展。山楂叶总黄酮(TFHL)具有抗脂质过氧化、抑制或清除氧自由基、调节血脂、改善肝微循环及抗炎等作用。项目组前期研究发现,TFHL能明显改善高脂诱导的非酒精性脂肪性肝炎(NASH)大鼠肝脏脂质代谢紊乱,抗氧化应激,抑制炎性细胞因子的分泌等作用[2-3]。为进一步探讨TFHL的作用机制,本研究观察其对NAFLD模型大鼠肝组织FXR/固醇调节元件结合蛋白(SREBP-1c)通路的影响。
1 材料与方法
1.1 动物:雄性SD大鼠40只,体重170±10g,SPF级,上海斯莱克实验动物有限公司,实验动物许可证号:SCXK(沪)2012-0002。适应性喂养1周后进行实验。
1.2 主要药品与试剂:TFHL(Lot:#20111211),总黄酮含量>95%,由山西康立生药业有限公司提供;总RNA提取试剂盒(Cat:KD10111101-G)由爱思进生物技术(杭州)有限公司提供;cDNA合成试剂盒(Cat:BK1401)和荧光定量PCR试剂盒(Cat:BKA3206)由宝生物工程(大连)有限公司提供;引物由宝生物工程(大连)有限公司设计并合成,FXR上游引物:5’-AAGTGACCTCCCGACCA AGA-3’,下游引物:5’-TGGCATTCTCTGTTTGCTGT-3’,扩增片段107b;小异二聚体伴侣分子(SHP)上游引物:5’-TGCCTGGAGTCTTTCTGGAG-3’,下游引物:5’-ATGTTCTTGAGGGTGGAAGC-3’,扩 增 片 段227bp;SREBP-1c上游引物:5’-GCTTCTCTGGGCTCC TCTCT-3’,下游引物:5’-GCACTGGCTCCTCTTTGA TT-3’,扩增片段154bp;脂肪合成酶(FAS)上游引物:5’-AGTGGGAAGACCCTGACTCC-3’,下游引物:5’-ATAGACGCCCTGGAAATGAG-3’,扩增片段 152bp;β-actin上游引物:5’-TGTTGCCCTAGACTTCTT CGAGCA-3’,下游引物:5’-CCATACCCAGGAAGGAAG GCT-3’,扩增片段112bp。蛋白抽提试剂盒(Cat:P1250)由北京普利莱基因技术有限公司提供;PotentECLKit(Cat:P1425)由联科生物技术有限公司提供;FXR兔抗多克隆抗体H-130(sc-13063)和SREBP-1c兔抗多克隆抗体K-10(sc-367)由美国SantaCruz公司提供;FAS兔抗多克隆抗体c20G5(#3180S)由美国CellSignaling公司提供。
1.3 主要实验设备:AB17900PCR扩增仪(美国ABI公司),多功能酶标仪(美国Thermo公司),LEECARM2025病理切片机(德国Leica公司),日立7020全自动生化分析仪(日本高新技术株式会社),OSE-Y10G电动组织研磨器(天根生化科技有限公司),Mini-PROTEANTetra(美国BioRad公司),FCE型ProteinSimple化学发光成像系统(上海百赛生物技术有限公司)。
1.4 实验方法:大鼠随机分为正常组、模型组、TFHL高、中、低剂量组共5组,每组8只。正常组予标准饲料喂养,其他4组每天予高脂饲料(在82.5%标准饲料基础上添加10%猪油、2%胆固醇、0.5%胆酸钠和5%蛋黄粉)连续喂养12周,同时从造模第5周起TFHL高、中、低剂量组每日分别灌服160mg/kg、80mg/kg、40mg/kg的TFHL,正常组和模型组以等量的蒸馏水灌胃,均连续灌胃8周。实验第12周末,空腹麻醉下腹腔静脉采血,检测甘油三酯(TG)、胆固醇(CHOL)、丙氨酸氨基转移酶(ALT)、门冬氨酸氨基转移酶(AST)水平;并收集肝脏标本,肝右叶部分组织在10%中性甲醛中固定用于病理观察。部分以生理盐水制成10%肝组织匀浆,再以异丙醇提取、氧化铝吸附后,分别采用磷脂-乙酰丙酮显色法测定TG含量,高铁-硫酸显色法测定CHOL含量。部分肝组织提取总RNA后再合成cDNA,Realtime-PCR检测肝组织中FXR、SHP、SREBP-1c、FAS的mRNA表达,以β-actin为内参,相对表达量(2-△△Ct)来表示目的基因mRNA的表达水平。部分肝组织提取蛋白后用WesternBlot检测肝组织中FXR、SREBP-1c、FAS的蛋白表达。化学发光成像系统曝光得到蛋白条带图,用Quantityone软件分析灰度值,用目的蛋白/GAPDH代表目的蛋白的相对表达量代表目的蛋白的表达水平。
1.5 统计学处理:采用SPSS17.0软件,计量资料均以均数±标准差(±s)表示。多组样本间的比较釆用单因素方差分析(one-wayANOVA),各组之间两两比较,若方差齐性时采用LSD检验,若方差不齐性时采用Dunnett’s T3检验。P<0.05被认为差异具有统计学意义。
2 结果
2.1 TFHL对NAFLD大鼠肝组织CHOL、TG水平的影响:
NAFLD模型组大鼠肝脏TG、CHOL水平较正常组显著增高(P<0.05,P<0.01);TFHL各剂量组大鼠肝脏TG含量较模型组明显减少(P<0.05),TFHL高、中剂量组大鼠肝脏CHOL含量较模型组明显减少(P<0.01,P<0.05)。
2.2 各组大鼠血清中ALT、AST、CHOL和TG水平比较:详见表1。
表1 山楂叶总黄酮对NAFLD大鼠血清ALT、AST、CHOL和TG水平的影响(±s,U/L)
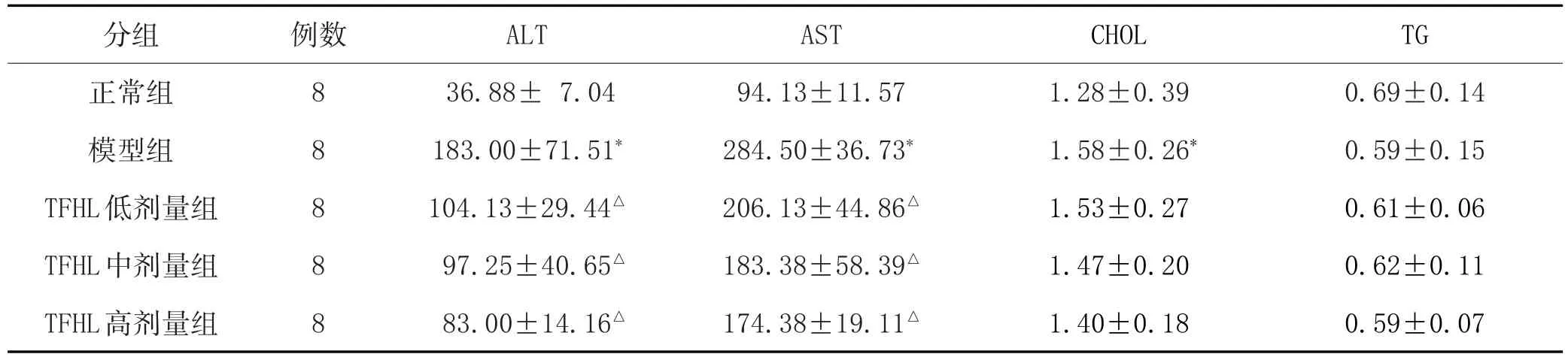
表1 山楂叶总黄酮对NAFLD大鼠血清ALT、AST、CHOL和TG水平的影响(±s,U/L)
注:与正常组比较,*P<0.01;与模型组比较,△P<0.01。
0.69±0.14 0.59±0.15 0.61±0.06 0.62±0.11 0.59±0.07正常组模型组TFHL低剂量组TFHL中剂量组TFHL高剂量组8 8 8 8 8 36.88±7.04 183.00±71.51*104.13±29.44△97.25±40.65△83.00±14.16△94.13±11.57 284.50±36.73*206.13±44.86△183.38±58.39△174.38±19.11△1.28±0.39 1.58±0.26*1.53±0.27 1.47±0.20 1.40±0.18
2.3 各组肝组织病理变化:光镜下观察,正常组肝小叶完整,肝细胞排列整齐,未见肝实质细胞病变,中央静脉和汇管区结构正常。模型组肝小叶轮廓不清,肝细胞肿大,胞浆疏松,富含脂肪粒,出现重度脂肪变、炎细胞浸润、小叶内散在坏死灶和部分肝细胞气球样变等NAFLD的病理改变;经TFHL治疗后肝细胞肿大减轻,肝细胞脂肪沉积减少,小叶内坏死灶和气球样变减轻。见图1、图2。
2.4 TFHL对 NAFLD大鼠肝组织 FXR、SREBP-1c、FAS、SHPmRNA表达的影响:NAFLD模型组大鼠肝组织FXR、SHPmRNA水平较正常组显著下降(P<0.01);TFHL高、中、低剂量组大鼠肝组织FXR、SHPmRNA水平较模型组明显增加(P<0.05);各剂量组大鼠肝组织FXR、SHPmRNA都低于正常组水平。模型组大鼠肝组织SREBP-1c、FAS mRNA水平较正常组显著增加(P<0.01);TFHL高、中、低剂量组大鼠肝组织SREBP-1cmRNA水平较模型组明显下降(P<0.05)。TFHL高、中剂量组大鼠肝组织FAS mRNA水平较模型组明显下降(P<0.05),但各剂量组大鼠肝组织SREBP-1c、FASmRNA都高于正常组水平。见图3。
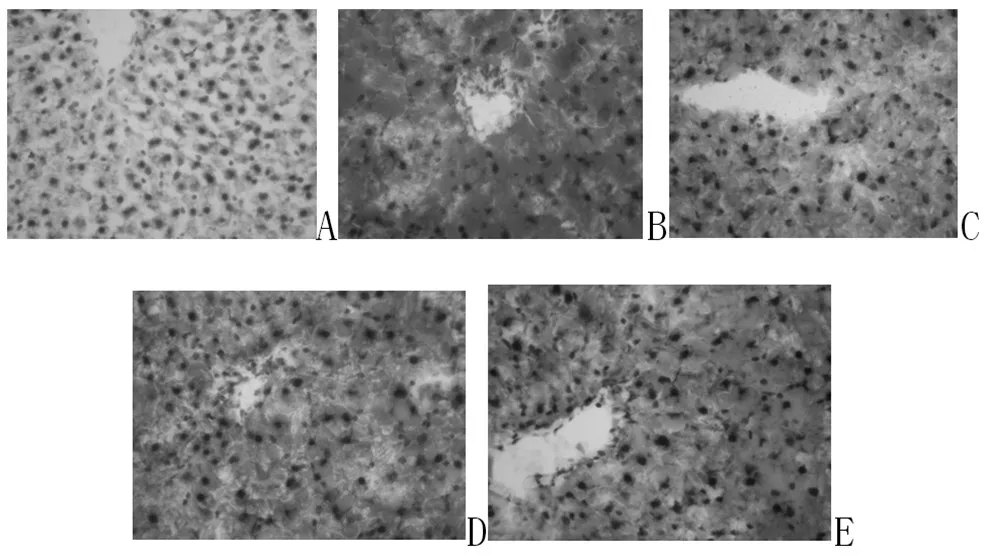
图1 各组大鼠肝组织脂肪沉积的变化(油红O×400)
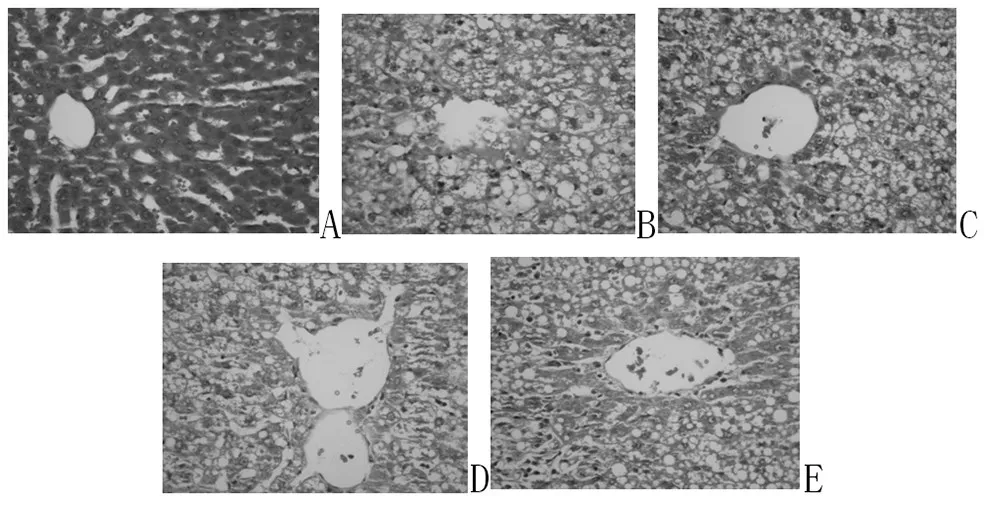
图2 各组大鼠肝脏组织病理的变化(HE×400)

图3 TFHL对NAFLD大鼠肝组织FXR、SHP、SREBP-1、FAS基因mRNA表达的影响(n=8)
2.5 TFHL对NAFLD大鼠肝组织FXR、SREBP-1c、FAS蛋白表达的影响:NAFLD模型组大鼠肝组织FXR蛋白含量较正常组显著减少(P<0.01);TFHL高、中、低剂量组大鼠肝组织FXR蛋白含量较模型组明显增加(P<0.01),但都低于正常组水平。模型组大鼠肝组织SREBP-1c蛋白含量较正常组显著增加(P<0.01);TFHL高、中、低剂量组大鼠肝组织SREBP-1c蛋白含量较模型组明显减少(P<0.05),但都高于正常组水平。模型组大鼠肝组织FAS蛋白含量较正常组有增加趋势;TFHL高、中、低剂量组大鼠肝组织FAS蛋白含量较模型组有减少趋势,但均无统计学差异(P>0.05)。见图4。
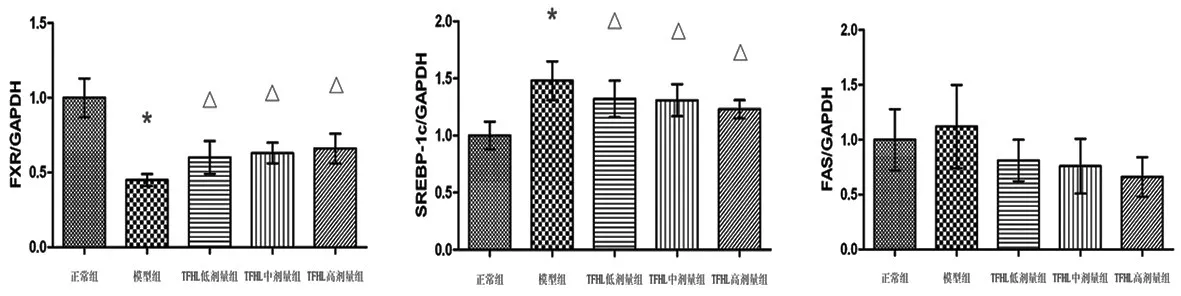
图4 TFHL对NAFLD大鼠肝组织FXR、SREBP-1c、FAS蛋白水平表达的影响(n=8)
3 讨论
随着人民生活水平的提高,NAFLD的发病率也在逐渐升高。NAFLD与糖尿病、心脑血管疾病密切相关,被认为是代谢综合征在肝脏的表现[4-5]。而FXR可以调节胆汁酸、糖、脂的代谢。FXR是配体激活的转录因子,通过调节靶基因的表达调控胆汁酸、脂质和糖的代谢[6]。在肝脏,FXR通过诱导SHP的表达,下调胆汁酸合成途径中的关键酶胆固醇-7α-羟化酶(CYP7A1),从而控制胆固醇转变为胆汁酸[7-8]。同时,FXR通过SHP下调SREBP-1c的表达,SREBP-1c可调节相关成脂基因的水平,包括脂肪合成酶(FAS)、乙酰辅酶A羧基酶等,从而实现FXR对肝脏甘油三酯水平的调控[9]。FXR还能调节磷脂转移蛋白的表达,加速磷脂和胆固醇从富含TG的脂蛋白向高密度脂蛋白(HDL)转运;上调肝细胞膜上的清道夫受体B,从而增加HDL介导的胆固醇逆转运。因此,激活FXR就能发挥抑制胆汁酸的合成、降低甘油三酯等多种药理活性[10]。对于NAFLD的治疗,近年来的临床报道显示中医药的疗效值得肯定,如桂祖全等[11]采用健脾化痰活血法为主治疗非酒精性脂肪性肝病肝郁脾虚证68例,总有效率90.16%,临床疗效良好。TFHL在临床上主要用于降血脂、降血糖、改善脂肪肝、抗心绞痛、抗肿瘤等多种疾病的防治方面。有研究表明,TFHL作为药用植物山楂叶的提取物,可以调节NAFLD/NASH大鼠脂质代谢紊乱,调控Nrf2及相关因子的表达,缓解NAFLD/NASH大鼠的氧化应激,减少脂质过氧化,增强机体抗氧化能力,减少细胞因子对肝细胞的损伤等[12]。
本实验模型组肝组织出现典型的NAFLD病理表现,血清和肝组织TG、CHOL含量增加,血清ALT、AST等水平增高,同时大鼠肝组织FXR、SHP表达显著下降,而SREBP-1c、FAS表达则明显增加,表明长期高脂饮食可导致大鼠肝组织FXR的表达下降,SHP水平受到抑制,进一步促进SREBP-1c、FAS的表达,影响肝脏脂质代谢的平衡,TG、CHOL等在肝脏沉积,肝酶水平升高,提示肝脏FXR表达降低可能是脂肪肝形成的重要机制,FXR-SHPSREBP-1c-FAS通路参与高脂诱导的NAFLD的发生发展。应用TFHL干预后,大鼠肝组织FXR、SHP表达明显增加,而SREBP-1c、FAS表达显著减少,同时TG、CHOL含量和血清ALT、AST水平显著下降,表明TFHL可能通过增加FXR的表达,诱导SHP,抑制SREBP-1c、FAS的过表达,从而改善肝脏脂质代谢和肝功能紊乱,防止NAFLD的进展。研究提示,TFHL可能是通过调控FXR与SREBP-1c通路,改善肝脏脂质代谢紊乱发挥防治NAFLD的作用。

