可得然胶生产菌种的筛选及发酵条件优化
王萧玉竹 , 董晋军 , 许国超 , 韩瑞枝 , 倪 晔 *
(1.江南大学 工业生物技术教育部重点实验室,江苏 无锡 214122;2.江南大学 生物工程学院,江苏 无锡214122)
可得然胶是一种由D-葡萄糖以β-1,3糖苷键连接组成的无支链的胞外多聚糖[1]。产可得然胶的菌株主要是粪产碱杆菌(Alcaligenes faecalis),也有少量三叶草根瘤菌属(Rhizobium trifolii)[2]、放射土壤杆菌(Agrobacterium radiobacter)[3]等其他菌种生产可得然胶的报道。可得然胶不溶于水、乙醇,易溶于碱液,二甲基亚砜,具有独特的热凝性质,当被加热至55℃时,可形成低固型凝胶,继续加热至80℃以上,可以形成有较高强度和弹性的高固型凝胶[4-5]。由于这一特殊性质,使得可得然胶在食品方面有着极其广泛的应用,可以作为食品增稠剂、结构改良剂应用于果冻、面条、可食用纤维以及新型减肥保健食品[6]。近年来,随着对可得然胶性质的深入挖掘,可得然胶在医药方面的作用也日益凸显。研究发现,可得然胶可以作为药物传递的载体,其硫化、胺化衍生物具有免疫学功效,可用于肿瘤治疗等[7-8]。可得然胶是继黄原胶、结冷胶之后第3个被美国FDA批准的由微生物发酵生产的可食用多糖,我国卫生部也于2006年正式批准该凝胶在部分食品中应用。作者从土壤中筛选到一株可以生产可得然胶的根瘤菌(Rhizobiumsp.CGMCC 12099),并对该菌产可得然胶的发酵培养基进行优化以提高其凝胶产量。
1 材料与方法
1.1 材料
1.1.1 菌株 菌株:江苏省无锡市龙寺生态园土壤中筛选获得,经鉴定为根瘤菌属(Rhizobiumsp.),中国普通微生物菌种保藏管理中心保藏号为CGMCC 12099。
1.1.2 培养基 苯胺蓝筛选培养基(g/L):蔗糖20,酵母粉5,蛋白胨5,琼脂粉20,苯胺蓝0.05,pH 7.0,121 ℃灭菌 20 min;种子培养基(g/L):葡萄糖20,酵母粉 5,蛋白胨 5,pH 7.0,121 ℃灭菌 20 min;发酵培养基 (g/L): 葡萄糖 20,(NH4)2HPO41.5,KH2PO41.0,MgSO40.25,FeSO4·7H2O 0.05,MnSO40.02,CoCl2·6H2O 0.01,ZnCl20.01,pH 7.0,121 ℃灭菌20 min。
1.2 菌株的筛选
1.2.1 初筛 筛选所用的土壤样品分别采集于江苏省无锡市滨湖区大浮镇龙寺生态园的草丛、湖边潮湿土壤、树林茂密的山地土壤。将采集到的不同土壤样品分别加入到生理盐水中,梯度稀释后涂布于苯胺蓝筛选平板,30℃静置培养2 d,待菌落长出,挑选平板上呈深蓝色的菌株再次在苯胺蓝平板上划线纯化,挑选始终保持深蓝色的单菌落接入30 mL种子培养基中,30℃,120 r/min,培养10 h。
1.2.2 复筛 将3 mL初筛后的种子菌液接入30 mL发酵培养基中,30℃,120 r/min培养60 h,对凝胶产品进行提取及鉴定。
1.2.3 菌种鉴定 提取菌株的基因组,采用细菌16S rRNA通用引物进行PCR扩增,扩增产物经测序分析(由上海生工生物技术服务公司完成),得到的测序结果在 NCBI(http://www.ncbi.nlm.nih.gov)数据库中进行BLAST比对,比较分析与其他菌株的同源性,并结合菌株的形态学特征,对菌株进行分类鉴定[9]。
1.3 产物提取及鉴定
1.3.1 产物提取 取5 mL发酵液于6 000 r/min离心10 min,弃上清液,向沉淀中加入10 mL 0.5 mol/L的氢氧化钠溶液并振荡混匀1 h,使得凝胶产品完全溶解在氢氧化钠溶液中,再次6 000 r/min离心10 min。将上清液用2 mol/L盐酸中和至pH 6.5~7.0,析出的凝胶和离心后的细胞沉淀分别用去离子水洗涤3次,80℃烘干至恒重。
1.3.2 热凝性鉴定及胶強测定 取冻干的凝胶产品0.2 g溶于10 mL去离子水中,充分匀浆后放入18 mm×180 mm的玻璃试管中,沸水浴10 min,然后在冷水中冷却30 min,观察凝胶是否具有热凝性。凝胶强度测定参考食品安全国家标准[10]。
1.3.3 凝胶产物组分鉴定及红外图谱鉴定 将0.1 g凝胶产物的冻干粉与10 mL 1 mol/L的硫酸溶液混合,首先在120℃下水解1 h,后将水解液离心取上清,进行第二部水解,条件同第一次。将两步水解后的凝胶水解液用过量硫酸钡中和,再离心取上清液。凝胶水解液的组成成分通过液相色谱检测,所用仪器是 Agilent 1260 Infinity HPLC system(CA,USA),流动相为水相,流量0.5 mL/min,柱温65℃,进样量10 μL。红外光谱由傅立叶红外光谱仪FT/IR-IS10 Nicolet (Thermo,MA,USA) 进行检测,采用溴化钾压片法[11],所用的商品可得然胶购买自Sigma公司。
1.3.4 凝胶产物相对分子质量鉴定 凝胶产物的相对分子质量(Mw)检测采用高效凝胶色谱层析技术,所用的仪器为高效液相仪(Waters 501,Miliford,MA), 分离凝胶柱 (Superose 12,10 mm ×300 mm,Pharmacia Inc.)。可得然胶样品溶于0.5 mol/L氢氧化钠水溶液中,流动相为0.5 mol/L氢氧化钠,流量为1 mL/min,进样量为20 μL。实验中所用的所有葡聚糖标准品均购自Sigma公司。
1.4 分析方法
1.4.1 葡萄糖检测 发酵液中的葡萄糖残糖检测采用DNS法[12]。
1.4.2 铵根离子检测 发酵液中的铵根离子检测采用次氯酸-水杨酸钠法[13]。
1.4.3 凝胶产量及细胞量 凝胶产量及细胞量检测通过计算单位体积发酵液中凝胶的干质量和细胞干质量,方法同1.3.1。
1.4.4 糖转化率计算 单位体积发酵液产胶量(g/L)与消耗的葡萄糖质量浓度(g/L)之比即为糖转化率。
1.5 产可得然胶的摇瓶培养基优化
将保存于甘油管中的菌株在平板上划线活化,然后将单菌落接种于30 mL种子培养基,于30℃,120 r/min培养18 h,然后以体积分数10%的接种量接种于60 mL发酵培养基,相同条件下培养60 h。所有培养基优化都是基于材料方法中的发酵培养基成分。
2 结果与分析
2.1 菌株筛选及鉴定
可得然胶是一种仅由β-1,3糖苷键连接而成的葡聚糖,而β-1,3糖苷键可以和苯胺蓝试剂特异性结合而显蓝色[3],因此苯胺蓝筛选方法被广泛用于可得然胶生产菌株的筛选中[14-15]。通过苯胺蓝法对土样进行筛选,从平板上挑选显深蓝色的菌株,然后进行摇瓶复筛,根据已报道的可得然胶提取方法进行产物提取和初步鉴定,最终从87株候选菌株中筛选到一株可以产可得然胶的菌株,该菌株在苯胺蓝平板上显蓝色(图1),在固体种子培养基平板上30℃培养72 h后,菌落呈浅黄色,表面凸起且湿润。细胞的革兰氏染色为阴性,在光学显微镜下观察呈短杆状,无芽孢,无鞭毛,图2为该菌株经过结晶紫染色的细胞在光学显微镜下的显微形态图。
采用通用引物扩增筛选菌株的16S rDNA片段,经测序其长度为1 382 bp,在NCBI数据库中比对显示,该菌株与Rhizobium radiobacter的同源性最高,达到99%。选取与目的菌种同源性较高的5株菌,用MEGS 5.0软件建立系统菌株进化树,结果如图3所示,鉴定菌株与根瘤菌属均有最高的同源性,并且与Rhizobium radiobacter进化亲缘关系最近,结果与16S rRNA的序列比对结果一致,进一步说明该菌株属于根瘤菌属。依据菌株菌落形态和16S rDNA序列鉴定,该菌株被鉴定为根瘤菌属(Rhizobiumsp.),并保藏于中国普通微生物菌种保藏管理中心(保藏号:CGMCC 12099)。

图1 菌株CGMCC 12099在苯胺蓝平板上的菌落形态Fig.1 Colonies of Rhizobium sp.CGMCC 12099 on aniline blue plate
图2 菌株CGMCC 12099光学显微镜形态图Fig.2 Observation of stain Rhizobium sp.CGMCC 12099 with optical microscope

图3 筛选菌株(Rhizobium sp.CGMCC 12099)的系统进化树分析Fig.3 Phylogenetic tree of Rhizobium sp.CGMCC 12099
2.2 培养基优化
2.2.1 葡萄糖质量浓度对凝胶的影响 葡萄糖是合成可得然胶的重要前体物质,对培养基中葡萄糖的浓度进行优化,结果如图4所示。随着培养基中葡萄糖质量浓度的增加,可得然胶的产量先增加后下降。在葡萄糖质量浓度为40 g/L时,可得然胶产量最高达到13.8 g/L。在三角瓶中对不同初始葡萄糖质量浓度下的可得然胶发酵结果进行分析可知(见图5),在葡萄糖初质量浓度为40 g/L培养基中,菌体经过8 h左右进入稳定期,而在糖质量浓度为100 g/L的培养基中,菌体在20 h左右才达到生长稳定期,且最终菌浓(1.12 g/L)仅为在40 g/L糖质量浓度下的63.5%。在40 g/L初始葡萄糖质量浓度的培养基中,葡萄糖平均消耗速率为0.73 g/L/h,是高初始糖质量浓度(100 g/L)的1.87倍,说明较高的初糖质量浓度对菌体的生长有一定抑制作用。由图5可知凝胶的快速合成在菌体生长进入稳定期之后,由于初糖质量浓度较高对菌体生长的抑制作用,使得菌体进入稳定期时间延长,进而导致凝胶开始合成时间延后,在100 g/L的初始葡萄糖质量浓度下凝胶合成较40 g/L的初始葡萄糖质量浓度下延后10 h左右。从图中还可以发现,稳定时期的菌体浓度对产胶量有较大影响,100 g/L的初始葡萄糖质量浓度远低于40 g/L的初始葡萄糖质量浓度下发酵产生的凝胶量,最终凝胶产量仅为40 g/L糖质量浓度下的57.9%。综上,高初始葡萄糖质量浓度不利于Rhizobiumsp.CGMCC 12099的生长和可得然胶的摇瓶发酵。发酵培养基中葡萄糖质量浓度应控制在40 g/L左右。
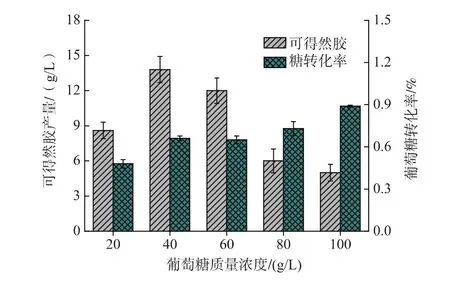
图4 发酵培养基中的葡萄糖质量浓度对可得然胶产量和糖转化率的影响Fig.4 Effect of initial glucose on curdlan production and glucose conversion rate by Rhizobium sp.CGMCC 12099
2.2.2 氮源的确定及浓度影响 考察了以牛肉浸膏,酵母粉,(NH4)2HPO4,NH4Cl作为唯一氮源时的凝胶合成情况,如图6(a)所示。结果表明,无机氮源较有机氮源更有利于凝胶的合成,以(NH4)2HPO4为氮源时凝胶产量较NH4Cl高,说明磷元素对凝胶的合成也有一定的促进作用。可得然胶合成需要的前体物质尿苷二磷酸葡萄糖(UDP-葡萄糖)是由尿苷三磷酸(UTP)与葡萄糖合成的[16],磷元素对UTP的再生起到了重要作用。因此,(NH4)2HPO4的加入不仅为菌体生长提供氮源,还促进了可得然胶的合成,继而对(NH4)2HPO4的添加量进行优化。可得然胶是典型的次级代谢产物,在氮源限制性条件下开始合成,此后菌体量保持稳定[17],如图 6(b)所示,可得然胶的合成量随着培养基中 (NH4)2HPO4质量浓度的增加呈现先增后减的变化。当(NH4)2HPO4质量浓度为1.5 g/L时,凝胶产量为14.2 g/L达到最高,此时糖转化率(66.7%)也达到最高。
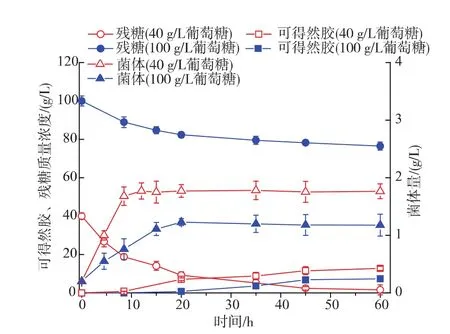
图5 不同初始葡萄糖质量浓度下可得然胶摇瓶发酵时间进程曲线Fig.5 Time course of curdlan fermentation by Rhizobium sp.CGMCC 12099 under different initial glucose concentrations
2.2.3 无机盐对凝胶产量的影响 无机盐是菌体细胞生长代谢不可或缺的成分,考察了MgSO4和KH2PO4两种无机盐的影响,结果如图7所示。MgSO4和KH2PO4在培养基中质量浓度对凝胶产量有较明显地影响,镁盐质量浓度在1 g/L时为最佳。KH2PO4不仅为菌体生长代谢提供钾元素和磷元素,磷酸二氢根还能在发酵液pH的缓冲和调节方面发挥一定的作用,单因素优化结果显示KH2PO4的最佳质量浓度为1.5 g/L。
2.2.4 正交实验优化结果 根据上述单因素实验,设计4因素3水平的正交试验。因素水平见表1,4因素分别为葡萄糖 (A),(NH4)2HPO4(B),KH2PO4(C),MgSO4(D)。 正交优化结果见表 2-3。
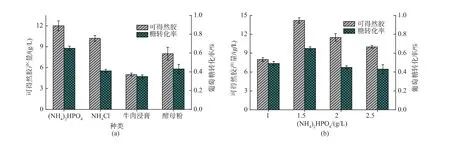
图6 发酵培养基中不同氮源种类和添加量对可得然胶产量和糖转化率的影响Fig.6 Effect of different nitrogen sources and amount of (NH4)2HPO4on curdlan production and glucose conversion rate by Rhizobium sp.CGMCC 12099

图7 MgSO4和KH2PO4质量浓度对凝胶合成的影响Fig.7 Effects of MgSO4and KH2PO4on curdlan production and glucose conversion rate by Rhizobium sp.CGMCC 12099
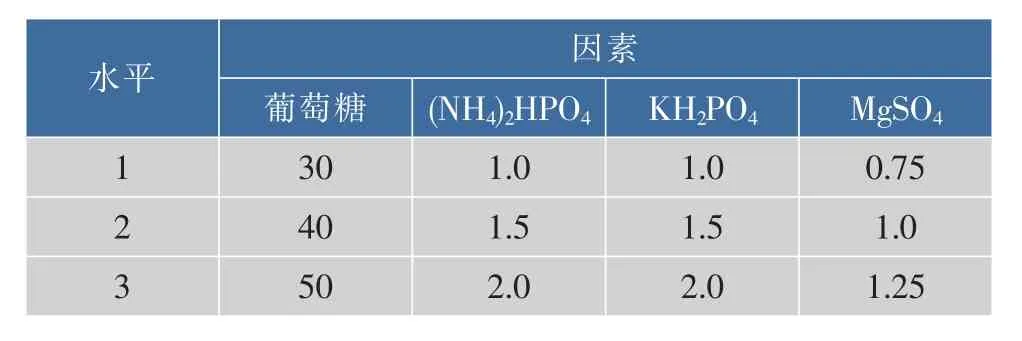
表1 L9(34)正交实验因素水平设计Table 1 Experimental variables and levels for orthogonal optimization experiment design
正交实验结果极差分析和方差分析显示,影响凝胶产量的主次顺序:葡萄糖 >(NH4)2HPO4>KH2PO4>MgSO4,最优组合为:葡萄糖 50 g/L,(NH4)2HPO42 g/L,KH2PO41.5 g/L,MgSO41.25 g/L。对得到的最优培养基方案进行摇瓶验证,通过对可得然胶发酵过程中菌体质量浓度、可得然胶质量浓度和葡萄糖转化率的监测,得到了可得然胶的发酵进程曲线,如图8所示。经过3次重复试验,可得然胶的平均产量为23.1 g/L,较优化前提高了29.2%,糖转化率为62.6%,较优化前提高了5.4%,说明正交优化得出的工艺条件有效可行。
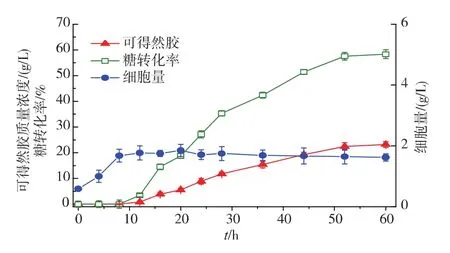
图8 最优培养基条件下可得然胶摇瓶发酵进程曲线Fig.8 Time course of curdlan fermentation by Rhizobium sp.CGMCC 12099 in flasks
2.3 凝胶产物性质分析
根据可得然胶的理化特性,作者对凝胶产物的热凝性、凝胶强度、分子组成和红外光谱进行检测。将20 g/L的凝胶产品悬浊液加热后,产品形成了有弹性的胶状固体,经过胶强检测,该产品的凝胶强度为229 g/cm2。凝胶产品水解液经过液相分析显示,该多聚糖仅由葡萄糖组成。利用凝胶色谱层析测得凝胶产品的平均相对分子质量为1.4×105,与文献中报道的可得然胶相对分子质量5.3×104~2.0×106相符合[18]。通过对比红外光谱图可以发现,凝胶产品的红外光谱图与可得然胶商品的光谱图一致。如图9所示,图中890 cm-1处有峰而在840 cm-1无峰,说明凝胶产物中仅有β-1,3糖苷键而没有α型糖苷键[19];3 410 cm-1和2 924 cm-1处的峰分别显示样品中的O—H基团和C—H基团;在1 075 cm-1处的峰是C—O基团的特征峰,与文献中报道的红外检测图谱一致[20]。
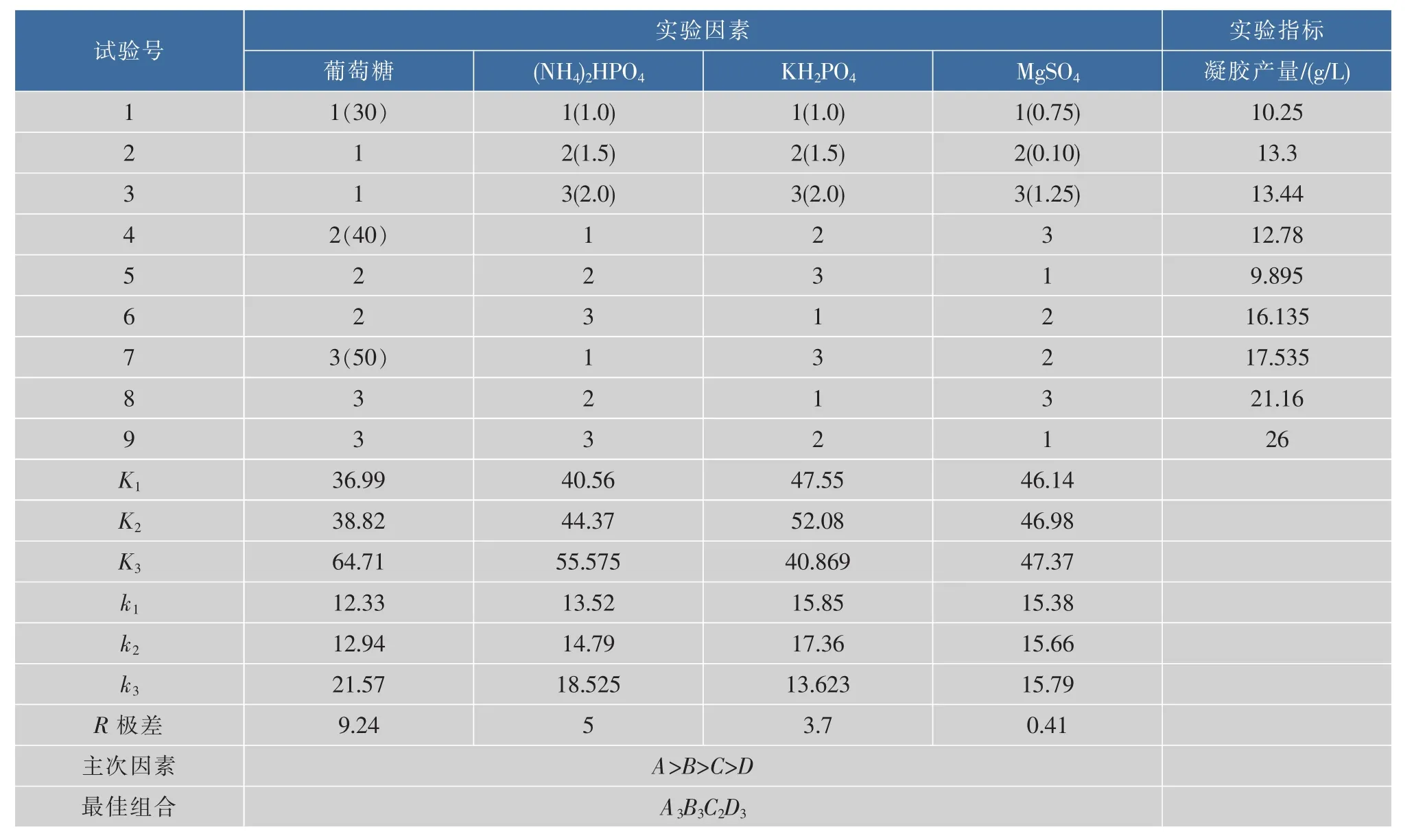
表2 正交实验方案及结果分析Table 2 Design and results of orthogonal optimization experiment
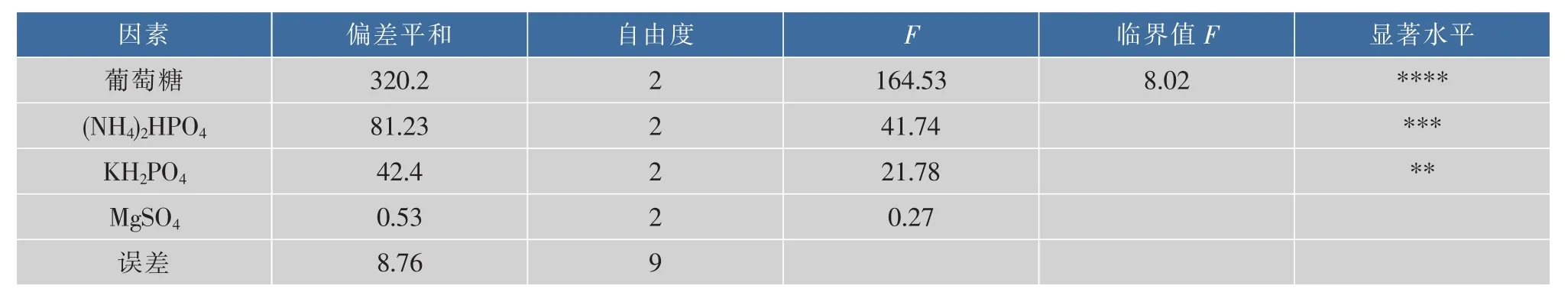
表3 可得然胶产量方差分析Table 3 Variance analysis for curdlan production
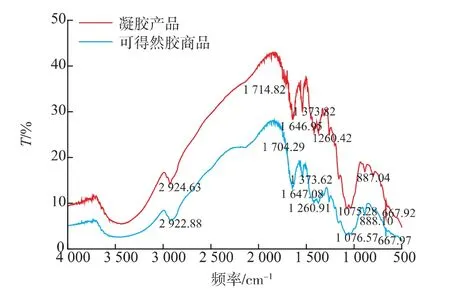
图9 凝胶产品与可得然胶商品的红外光谱图Fig.9 FT/IR spectra of the polysaccharide obtained in this study and the commercial curdlan sample
3 结 语
采用苯胺蓝显色平板筛选方法,从土壤中筛选到一株产可得然胶的根瘤菌(Rhizobiumsp.CGMCC 12099),并对该凝胶产品的理化性质进行了分析和鉴定。基于单因素实验结果,采用正交实验的方法,对该菌株生产可得然胶的发酵培养基进行优化,确定产可得然胶的最优发酵培养基组成:葡萄糖50 g/L,(NH4)2HPO42 g/L,KH2PO41.5 g/L,MgSO41.25 g/L,FeSO4·7H2O 0.05 g/L,MnSO40.02 g/L,CoCl2·6H2O 0.01 g/L,ZnCl20.01 g/L。对所得到的优化方案进行摇瓶发酵验证结果显示,优化后的可得然胶产量达到23.1 g/L,较优化前提高29.2%,糖转化率为62.6%,较优化前提高了5.4%。

