香水莲花提取物的美白功效研究
孙玉洁, 李春松, 芦 芳, 吴晓琴, 沈建福*
(1.浙江大学 生物系统工程与食品科学学院,浙江 杭州310058;2.金华市食品药品检验检测研究院 食品药品检验评审科,浙江 金华 321015;3.浙江芸麒龙翔生物技术有限公司,浙江 杭州310000)
目前市场有多种皮肤美白剂,如纯化学物氢醌,天然植物提取物熊果苷、甘草提取物等。纯化学物的美白效果较好,但往往会带来一些副作用,而天然植物提取物由于安全性高,越来越得到研发者和消费者的青睐。皮肤的美白主要有2种方式,一是抑制黑色素合成酶的活性,如抑制酪氨酸酶,多巴色素互变酶等,以减少黑色素的生成;二是促进黑色素排出,如促进黑色素的吸收代谢等[1]。天然植物提取物的美白作用通常是通过抑制酪氨酸酶活性或阻断酪氨酸生成黑素的氧化反应,从而减少黑素的合成而达到美白皮肤的效果。
香水莲花 (Nymphaea hybrid)是睡莲科睡莲属热带大型睡莲,既是一种大型观赏性花卉,又可安全食用,源于香水莲花的各种产品也被不断开发利用。作者通过测定比较提取物对酪氨酸酶活性的影响,筛选获得效果较好的提取物,再应用B16黑素瘤细胞模型,进一步研究香水莲花提取物对细胞黑素合成的影响及其对细胞内酪氨酸酶的作用,初步探讨其美白作用,以期为纯天然美白化妆品的开发提供理论参考。
1 实验材料
1.1 材料与试剂
黄色、蓝色香水莲花:由浙江一心园农业发展有限公司提供,2014年9月采摘,剥去萼片,从贴近花托基部切除花梗。其中一部分4℃冷藏,另一部分烘干,装袋备用;香水莲花子房提取物:由浙江一心园农业发展有限公司提供;酪氨酸酶、L-酪氨酸、熊果苷、二甲基亚砜(DMSO):上海阿拉丁试剂有限公司;B16小鼠黑素瘤细胞株:上海市中科院细胞库产品;RPMI 1640培养液:美国Gibco公司产品;HyClone胎牛血清:赛默飞世尔生物化学制品 (北京)有限公司产品;青-链霉素溶液、磷酸缓冲液(PBS)、0.25%胰蛋白酶:杭州科易生物技术有限公司产品;四甲基偶氮唑蓝 (MTT)、曲通 (Triton-X100):北京雷根生物技术有限公司产品;左旋多巴(L-DOPA):北京索莱宝科技有限公司产品。
1.2 主要仪器
TU-1810紫外可见分光光度计:北京普析通用仪器有限责任公司产品;CP-ST50A型二氧化碳培养箱:长沙长锦科技有限公司产品;SW-CJ-ZF洁净工作台:上海博迅实业有限公司医疗设备厂产品;CKX41倒置显微镜:日本奥林巴斯光学工业株式会社产品;MDF-U53V医用低温箱:日本松下电器产业株式会社产品;Eon酶标仪:美国伯腾仪器有限公司产品;LDZX-50KBS立式髙压灭菌锅:上海申安医疗器械厂产品;25 cm2细胞培养瓶:美国Sigma-Aldrich公司产品;96孔细胞培养板、6孔细胞培养板:美国康宁公司产品。
2 实验方法
2.1 香水莲花样品的制备
分别取晒干后的黄色、蓝色香水莲花整花,去除虫害、霉变部分后粉碎,过50目筛。按照1 g∶10 mL料液质量体积比,分别用蒸馏水、体积分数20%、40%、60%、80%、100%的乙醇溶液(V/V)在 50℃温度下超声浸提30 min,所得溶液4 000 r/min离心15 min,取上清液过滤,再经减压旋蒸除去乙醇,冻干48 h,得到香莲整花提取物粉末。测定时将其与子房提取物经过超声重溶配制成所需浓度的溶液待用。
2.2 香水莲花提取物的活性成分测定
2.2.1 总酚质量分数的测定 没食子酸标准曲线测定:采用Folin-Ciocalteu法[2]。精密吸取没食子酸标准溶液 (0.1 mg/mL) 0.1、0.2、0.3、0.4、0.5、0.6 mL于10 mL具塞试管中,加入1.0 mL Folin-Ciocalteu试剂和2mL15%Na2CO3溶液,用蒸馏水定容至10mL,充分混匀后于75℃水浴30 min,以试剂空白为参照,在760 nm波长下测定吸光度。以吸光度为纵坐标(y,A760),没食子酸质量为横坐标(x,mg)绘制标准曲线,得到回归方程y=14.7x-0.000 5(R2=0.999 8)。
香水莲花提取物总酚质量分数测定:将各提取物配成1.0 mg/mL的待测液,取0.2 mL待测液,按上述步骤测定,根据标准曲线计算提取物干基总酚质量分数。
2.2.2 黄酮质量分数的测定 芦丁标准曲线测定:参考任红荣等[3]的方法。精密称取105℃常压干燥至恒重的芦丁标准品0.100 2 g,用体积分数50%乙醇定容至50 mL作为母液。正确吸取芦丁母液1.5、2.5、4.0、5.0、8.0、10.0 mL 置于 25 mL 容量瓶中,以体积分数50%乙醇定容。吸取2 mL芦丁标准液,加入2 mL质量分数1%三氯化铝,振荡摇匀后室温放置15 min,以溶剂加质量分数1%三氯化铝溶液作为空白对照在425 nm处测定吸光值。以吸光值为纵坐标(y,A425nm),芦丁质量为横坐标(x,μg)绘制标准曲线,得回归方程y=0.011 2x+0.009 9(R2=0.999 5)。
将各提取物配成1.0 mg/mL的母液,再将整花提取物母液用体积分数50%乙醇稀释一倍作为待测液,子房提取物母液作为待测液,按照上述标准曲线方法测定,根据标准曲线计算提取物干基黄酮质量分数。
2.3 香水莲花提取物的美白功效测定
2.3.1 抑制酪氨酸酶活性测定 采用体外法测定,参考任红荣等[4]的方法。
总反应体系为5 mL,具体设计见表1。其中,用分光光度计测量吸光值时,受试组、空白组、熊果苷对照组分别以阴性对照组1#、2#和3#管调零。
实验时,向试管中依次加入磷酸盐缓冲液、不同浓度梯度的样品液和酶液,37℃水浴10 min后加入底物L-酪氨酸,立即计时。反应20 min时测定475 nm波长下的吸光值。测定时以相应的阴性对照为参比,用下列公式计算样品液和阳性对照对酪氨酸酶的抑制率,依据浓度-酶抑制率曲线计算半抑制浓度(IC50),IC50值低则表明其对酪氨酸酶活性的抑制效果好。
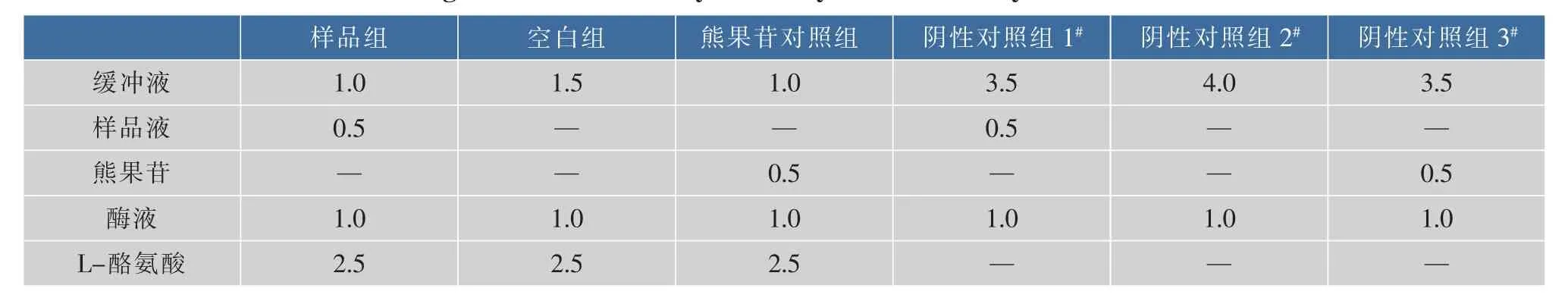
表1 测定酪氨酸酶活性的5 mL试验体系设计Table 1 Design of the 5 mL test system of tyrosinase activity determination mL
2.3.2 细胞形态观察 B16小鼠黑素瘤细胞株购于上海市中科院细胞库。每次实验取自同一传代细胞,DMSO质量分数小于0.5%。
参考Chang[5]等的方法,取指数生长期的B16黑色素瘤细胞,经0.25%胰蛋白酶消化分散,调整细胞密度为5×104个/mL,每孔100 μL接种于96孔板,再补充RPMI 1640新鲜培养液100 μL,培养12 h待细胞完全贴壁后更换新培养基,每孔加入200 μL不同浓度的受试物溶液,每个浓度设置6个复孔,对照组加入新鲜培养液代替美白剂溶液,每天换液,培养48 h后置于显微镜下观察对照组和实验组的细胞大小、形态、生长密度、树突形态以及融合状态等,并拍照记录。
2.3.3 MTT比色法检测细胞增殖率 参考Mei[6]等和陈贞纯等[7]的方法。细胞悬浮液前处理同上,细胞接种12 h后用添加受试美白剂的新鲜培养液换液(各设4个剂量组,香水莲花乙醇体积分数60%提取物和熊果苷的质量浓度梯度为 12.5、25、50、100 μg/mL),每孔加入 200 μL,每个质量浓度设置 6 个复孔,对照组加入新鲜培养液代替美白剂溶液,培养48 h。在测定时间前4 h取出,每孔加入5 mg/mL MTT溶液20 μL,在培养箱中继续孵育4 h,然后弃去培养基和MTT,向各孔中加入150 μL的DMSO,以溶解残留的MTT-甲臜结晶,震荡混匀后用酶标仪测定570 nm下的吸光值。细胞增殖率按以下公式计算:细胞增殖率(%)=(A实验孔-A空白孔)/(A对照孔-A空白孔)×100%。
2.3.4 黑素质量分数测定 选择对数生长期细胞制成单细胞悬液,以 5×104个/mL接种于6孔培养板,每孔2 mL。贴壁后每孔分别加不同质量浓度含受试美白剂的培养基 (质量浓度梯度为12.5、25、50、100 μg/mL),以不含受试美白剂的空白培养基作为对照。将细胞在37℃、体积分数5%CO2饱和湿度条件下培养48 h,倾去培养液,用PBS缓冲液洗1次,质量分数0.25%胰酶消化,再用PBS缓冲液吹打沉淀细胞,备用。参照Ando等[8]报道的方法测定黑素质量分数。取备用细胞悬液加PBS缓冲液,各吸取1 mL细胞悬液分别置于离心管中,低速离心10 min后弃去上清液,先加入200 μL蒸馏水使细胞重新悬浮,然后加入 1 mLV(乙醇)∶V(乙醚液)=1∶1,在室温下放置 15 min,3000 r/min 离心 5 min 并弃去上清液,加入1 mL含体积分数10%二甲基亚砜的1 mol/L NaOH溶液,然后置于80℃水浴30 min,最后转移到96孔板中,用分光光度计在470 nm波长处测定吸光度,单个细胞内相对黑素质量分数=(A实验组/A对照组)/细胞增殖率 ×100%。
2.3.5 酪氨酸酶活性抑制率测定 参考张春香[9]等和Qiu等[10]的方法。细胞前处理同上,调整细胞数为5×104个/ml,96 孔板每孔加细胞悬液 100 μL, 再补充培养液 100 μL,铺板 12 h后,弃上清,加入200 μL含不同质量浓度美白剂的培养液(质量浓度梯度为 12.5、25、50、100 μg/mL),在 37 ℃,体积分数5%CO2饱和湿性条件下培养,每一质量浓度设6个复孔,以不添加美白剂培养的细胞作为空白对照,培养48 h,每天换液。
采用多巴氧化法对酪氨酸酶活性进行测定。将孔板中上清液弃去,用PBS缓冲液漂洗后每孔加入1%Triton-X100 40 μL, 迅速放入-80℃冰箱内,30 min后取出于37℃融化,破裂细胞,加入1%LDOPA溶液10 μL/孔,以L-DOPA为本底进行校正,以不加美白剂培养的细胞作为对照,37℃反应30 min,置酶标仪测定450 nm处A450值。
2.4 统计学分析
采用Excel 2013和SPSS 21软件处理实验数据,计算结果以均值±标准差(Mean±SD)表示,采用邓肯多重比较法进行显著性差异检验。
3 实验结果
3.1 总酚质量分数测定结果
香水莲花提取物中总酚质量分数如图1所示,不同体积分数乙醇提取的黄色与蓝色整花提取物中,总酚质量分数趋势一致。且蓝色整花醇提物的总酚质量分数普遍高于相同浓度黄色整花醇提物,由图可知蓝色整花体积分数60%醇提物中酚类物质质量分数最高,占提取物干基质量的 (31.62±0.14)%,显著高于黄色整花的总酚质量分数(30.29±0.19)%(P<0.01),子房提取物总酚质量分数最低,为(5.19%±0.18)%。
3.2 黄酮质量分数测定结果
如图2所示,香水莲花提取物中黄酮质量分数随提取溶剂乙醇体积分数升高而增加,且黄色整花提取物所含黄酮高于蓝色整花,用60%乙醇提取时,这两种整花提取物所含黄酮分别占干基质量的(5.37±0.05)%和(3.72±0.06)%,而在 100%乙醇提取时分别上升至 (10.42±0.05)%、(6.35%±0.03)%,增加了将近一倍。子房提取物的黄酮质量分数最低,为(1.90±0.04)%。由此可见,香水莲花中低极性的黄酮质量分数比高极性的多。

图1 香水莲花提取物总酚质量分数Fig.1 Polyphenols content of Nymphaea odorata Aiton extracts
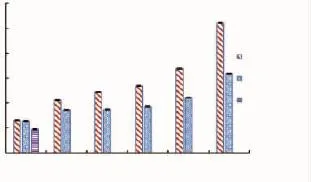
图2 香水莲花提取物黄酮质量分数Fig.2 Flavones content of Nymphaea odorata Aiton extracts
3.3 抑制酪氨酸酶活性测定结果
酪氨酸酶是酪氨酸转变为黑色素的主要限制酶,可催化含酚基化合物(如酪氨酸、酚类化合物等)氧化成多巴醌,经一系列中间反应后形成黑色素[11],反应过强可引起黑素过多症,如雀斑、黄褐斑等[12]。如图3所示,不同体积分数乙醇溶剂提取的黄色整花提取物对酪氨酸酶活性的抑制效果与蓝色整花提取物一致,子房提取物较低,熊果苷较高。该结果与提取物中总酚质量分数趋势一致,推测提取物中含有能抑制酪氨酸酶活性的酚类物质。
由表2可知,相同质量浓度下,蓝色整花提取物对酪氨酸酶活性抑制率的IC50值普遍低于黄色整花提取物,因此蓝色整花提取物的抑制酪氨酸酶活性效果好。用体积分数60%乙醇提取的黄色、蓝色整花提取物均具有良好的抑制酶活性效果,其中体积分数60%蓝色整花醇提物在所有香水莲花样品中抑制酪氨酸酶活性效果最好,IC50值仅为(0.59±0.01)mg/mL,抑制效果与熊果苷无显著差异。

图3 香水莲花提取物对酪氨酸酶活性的抑制作用Fig.3 Inhibition oftyrosinaseactivity by Nymphaea odorata Aiton extracts

表2 香水莲花提取物对酪氨酸酶活性抑制率IC50值Table 2 Inhibition rate of IC50values (mg/mL) on tyrosinase activity by Nymphaea odorata Aiton extracts mg/mL
3.4 细胞形态观察结果
传代的B16小鼠黑素瘤细胞主要为两极贴壁生长的上皮型细胞,偶见三极生长。添加香水莲花提取物后进行细胞培养,结果显示:整花体积分数60%醇提物可干扰细胞增殖,使细胞生长受到抑制,而熊果苷和子房提取物对细胞生长无明显影响。
从图4可见,对照组细胞生长良好,形态正常,添加100 μg/mL质量浓度的熊果苷和子房提取物的细胞生长状况与对照组相近,而在香水莲花提取物作用下,细胞分布稀疏,尤其是添加了蓝色整花体积分数60%醇提物培养的细胞,细胞树状突起减少、缩短,许多细胞呈圆形或不规形状孤立存在,细胞之间很难相互融合形成网状互联结构,导致细胞旁分泌和细胞间隙通讯减弱,难以实现细胞正常生理功能。

图4 100 μg/mL香水莲花提取物对细胞生长的影响Fig.4 Effect of Nymphaea odorata Aiton extracts(100 μg/mL)on cell growth
3.5 细胞增殖率测定结果
由图5所示,香水莲花60%醇提物在低质量浓度时,对细胞生长无明显影响;当质量浓度达到50 μg/mL时,黄色和蓝色整花体积分数60%醇提物对B16小鼠黑素瘤细胞增殖开始有显著抑制作用,增殖率分别为(90.17±3.23)%和(83.59±2.04)%;在100 μg/mL浓度下,添加黄色、蓝色整花60%醇提物的细胞增殖率分别下降到 (84.44±1.77)%、(48.24±3.14)%,显著低于熊果苷,可见醇提物中活性成分能够减缓瘤细胞增殖。许多文献报道,天然植物提取物如芦荟苦素[13]和甘草提取物[14]能够有效抑制黑素瘤细胞增殖,起到美白作用。添加了熊果苷培养的细胞增殖率为(98.89%±2.55)%,说明熊果苷对细胞增殖无显著影响。子房提取物具有少许促进细胞生长的作用,可能是因为子房提取物中含有糖类等营养成分,被细胞吸收利用从而促进增殖。
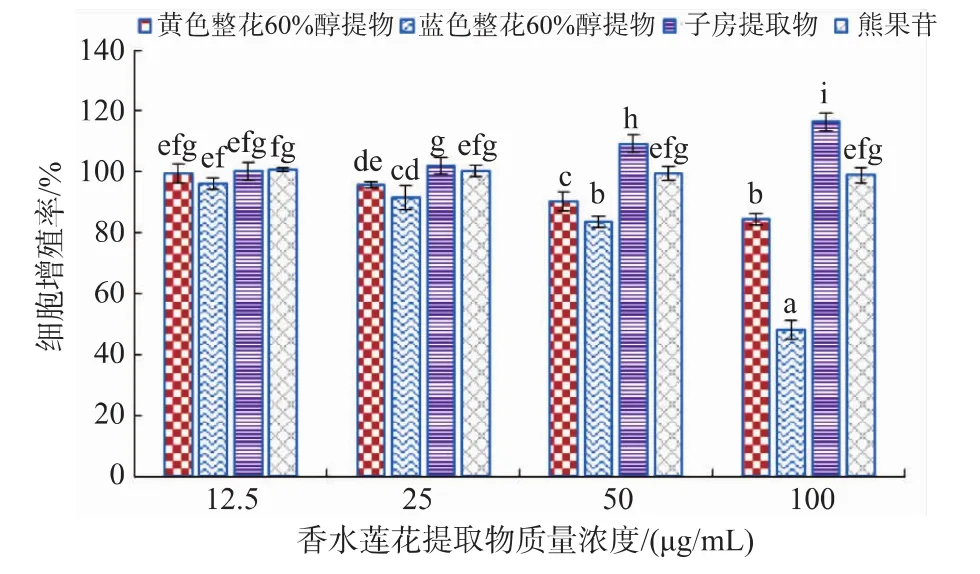
图5 香水莲花提取物对细胞增殖率的影响Fig.5 Effect on cell proliferation rate by Nymphaea odorata Aiton extracts
3.6 黑素质量分数测定结果
黑素存在于表皮的基底层,它是决定皮肤颜色的主要因素。皮肤中黑色素质量分数越少,则肤色越浅。由图6可知,香水莲花提取物均有抑制细胞合成黑色素的作用,以空白对照的单个细胞内黑素质量分数为100%,则添加提取物后黑素质量分数明显降低,并呈现剂量-效应关系。在100 μg/mL时,添加黄色整花体积分数60%醇提物培养的细胞中黑素相对质量分数减少了30.31%,蓝色整花体积分数60%醇提物减少33.02%,抑制黑素合成效果均良好,但由于其为混合初提物,而熊果苷为纯物质,其抑制效果没有熊果苷好。子房提取物对黑素生成的抑制也有一定效果,100 μg/mL质量浓度时使单个细胞内相对黑素质量分数减少20.90%,但不如整花提取物。

图6 香水莲花提取物对相对黑素质量分数的影响Fig.6 Effect on relative content of melanin by Nymphaea odorata Aiton extracts
3.7 酪氨酸酶活性抑制率测定结果
黑色素合成过程中的关键酶主要有3种:酪氨酸酶、多巴色素互变酶和5,6-二羟吲哚-2-羧酸氧化酶,一般可通过抑制酪氨酸酶的活性从而减少黑色素的合成量。如图7所示,随着浓度升高,提取物和阳性对照熊果苷对酪氨酸酶活抑制率均逐步上升,在100 μg/mL质量浓度时,蓝色整花体积分数60%醇提物与熊果苷对酪氨酸酶活性的相对抑制率相当,达到(59.47±3.40)%,显著高于黄色整花 60%醇提物,子房提取物对酶活的抑制效果并不明显。该结果与B16小鼠黑素瘤细胞内黑素相对含量的结果相一致,也与体外酪氨酸酶活性抑制率具有一致性,因此,实验表明香水莲花提取物有较好的降低细胞内酪氨酸酶活性的作用,从而有效减少细胞内黑色素的合成量。
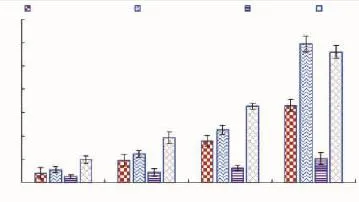
图7 香水莲花提取物对酪氨酸酶活性相对抑制率的影响Fig.7 Effect on relative inhibition rate of tyrosinase activity by Nymphaea odorata Aiton extracts
4 结 语
丰富多彩的物种资源为美白研究提供了大量的试验材料,从天然产物中提取活性成分成为筛选研究的热点[15]。作者通过体外法测定酪氨酸酶活性和细胞模型法测定黑素含量等指标研究了香水莲花提取物的美白效果。
酪氨酸酶是一种含铜的金属氧化还原酶,广泛分布于动植物、微生物及人体中,具有单酚酶和二酚酶活性[16],酪氨酸酶位于黑色素体膜上,其活性中心的双核铜离子在酶催化中起重要作用,是黑色素生成的关键酶[17],其活性越强,则黑色素合成数量越多,肤色越深。
体外以酪氨酸为底物测定酪氨酸单酚酶活性的结果表明,不同体积分数乙醇提取的黄色和蓝色整花提取物对酪氨酸酶活性的抑制效果强弱具有一致性,均为体积分数60%醇提物效果最好,表明整花提取物具有较好的抑制酪氨酸酶单酚酶活性的作用。同浓度时蓝色整花提取物抑制效果较黄色整花提取物和子房提取物好,可能是由于蓝色整花提取物中酚类含量较高。蓝色整花体积分数60%醇提物对酪氨酸酶活性的抑制率与熊果苷相当,表明其具有很好的美白功效。有许多研究表明,多种花类提取物均具有很好的酪氨酸酶活性作用,如兰花提取物[18]、薰衣草精油[19]、槟榔花沸水提取物[20]、仙蜜果花醇提物[21]等,可作为有效的酪氨酸酶抑制剂。
利用离体细胞培养来筛选美白剂的细胞生物学方法,较人体实验更快速、简便,已成为美白功效评价的重要手段。天然植物成分往往具有抗氧化能力,能把黑素合成的中间体还原为无色的多巴色素,淡化皮肤颜色;有些还能使黑素细胞增殖减缓,从而抑制黑色素的产生[22];有机酸类物质能加快基底层细胞分裂,逐渐向上推移到表皮层,最后角化脱落[23],从而促使黑色素排出。B16细胞模型实验结果显示,体积分数60%醇提物具有抑制细胞增殖的作用,且在100 μg/mL浓度时抑制效果显著,细胞数目明显减少,形态改变,子房提取物和熊果苷对细胞形态无影响。有文献报道,以多巴为底物,熊果苷对酪氨酸酶有竞争性抑制作用[24]。实验结果表明,以L-多巴为底物测定细胞内酪氨酸二酚酶活性,蓝色整花体积分数60%醇提物的抑制效果与熊果苷相当,且其细胞增殖率较熊果苷低,细胞中黑素相对质量分数也为蓝色整花体积分数60%醇提物低于黄色,均比子房提取物效果好,添加熊果苷的黑素质量分数最低,可知香水莲花提取物能通过抑制酪氨酸酶活性及减少细胞增殖从而降低黑素生成量,表明香水莲花提取物在美白方面具有较好的应用前景。

