不同新辅助化疗方案治疗三阴性乳腺癌的临床效果比较
童文先,何安兵,刘爱华,彭秀兰,王虎,田倩,李晓光,徐慧琳
武汉市第五医院肿瘤科,武汉4300500
三阴性乳腺癌(triple negative breast cancer,TNBC)为一类特殊的乳腺癌,其雌激素受体(estrogen receptor,ER)、孕激素受体(progesterone receptor,PR)和人表皮生长因子受体2(human epidermal growth factor receptor 2,HER2)均呈阴性表达[1]。资料显示,TNBC恶性程度高,侵袭性强,易复发和转移,预后较差[2]。目前,由于尚无有效抗HER2及靶向内分泌治疗的方法,故临床治疗TNBC的手段较为有限[3]。新辅助化疗是TNBC的重要治疗方法,但临床并无标准治疗方案[4]。本研究将不同新辅助化疗方案应用于TNBC的临床治疗,以比较其临床应用价值,结果较为满意,现报道如下。
1 对象与方法
1.1 研究对象
选择2013年1月至2016年12月于武汉市第五医院进行新辅助化疗的TNBC患者96例。纳入标准:经穿刺活检及免疫组化检查诊断为Ⅱ~Ⅲ期的TNBC患者,预期生存期﹥90天,可耐受化疗,血常规检查正常,知情同意的患者。排除标准:远处转移患者,炎性乳腺癌患者,有既往化疗史患者,肝肾功能不全患者,哺乳期、妊娠期患者。所有患者均为女性;年龄29~60岁,平均(42.48±4.33)岁;体重指数(body mass index,BMI)21.54~31.86 kg/m2,平均(26.28±2.71)kg/m2;病程 0.5~4.0年 ,平均(2.11±0.23)年;病灶最大径为3.50~9.00 cm,平均(5.98±0.62)cm;病灶分型:浸润性导管癌52例(54.17%),浸润性小叶癌28例(29.17%),髓样癌16例(16.67%);TNM分期:Ⅱ期55例(57.29%),Ⅲ期41例(42.71%);经期:绝经后60例(62.50%),绝经前36例(37.50%)。将96例TNBC患者按照随机数字表法分为研究1组(n=48)与研究2组(n=48),两组患者临床特征比较,差异无统计学意义(P﹥0.05),详见表1。本研究经武汉市第五医院伦理委员会批准并备案。
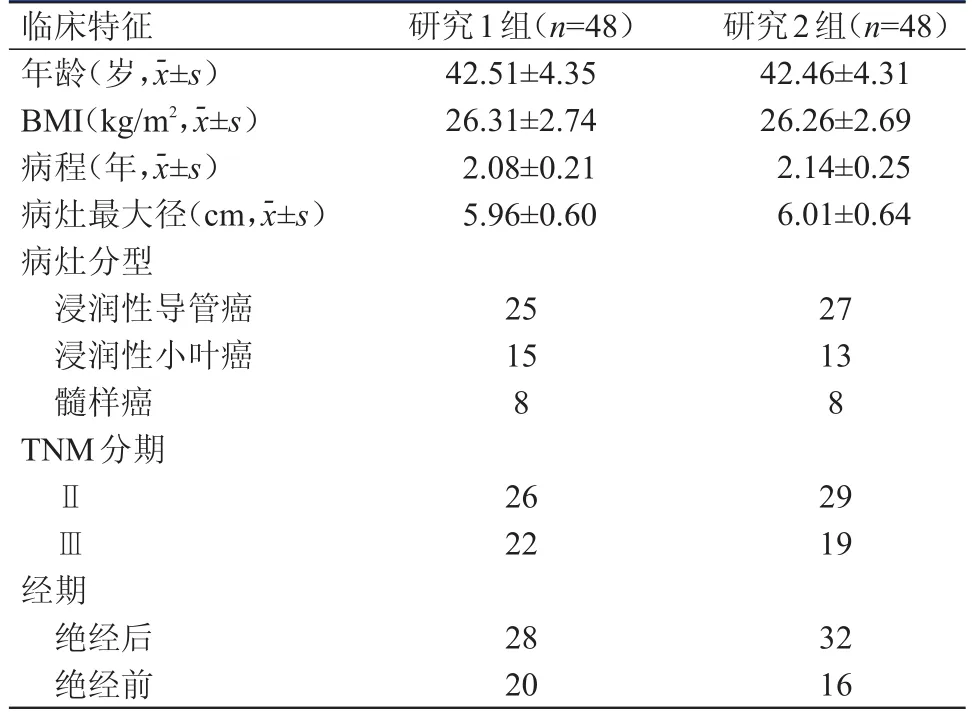
表1 两组患者的临床特征
1.2 化疗方法
研究1组给予多西紫杉醇+表柔比星方案化疗。仅第1天给予多西紫杉醇75 mg/m2,静脉滴注3 h;表柔比星60 mg/m2,静脉滴注。21天为一个疗程,连续行3个疗程化疗。
研究2组给予环磷酰胺+表柔比星+氟尿嘧啶方案化疗。仅第1天给予环磷酰胺75 mg/m2,表柔比星80 mg/m2,氟尿嘧啶500 mg/m2,静脉滴注。21天为一个疗程,连续行3个疗程化疗。
1.3 观察指标
观察两组化疗前后白细胞介素-6(interleukin-6,IL-6)、白细胞介素-8(interleukin-8,IL-8)、白细胞介素-1β(interleukin-1β,IL-1β)、肿瘤坏死因子-α(tumor necrosis factor-α,TNF-α)炎性因子水平,CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+T 淋巴细胞因子水平以及不良反应发生情况。以化学发光酶分析法检测IL-6、IL-8、IL-1β、TNF-α水平,以流式细胞仪检测T淋巴细胞因子水平,以NCIC CTG 2.0不良反应标准[5]评价不良反应。
1.4 疗效评价标准
依据RECIST 1.1标准(2009年)[6]评价疗效。完全缓解(complete response,CR):TNBC各相关生化指标均恢复正常,病灶消失;部分缓解(partial response,PR):TNBC相关生化指标均显著改善,病灶长径之和减少30%以上;稳定(stable disease,SD):TNBC相关生化指标均部分改善,病灶长径之和减少 20%~30%;进展(progression disease,PD):TNBC相关生化指标无改善或进展,出现新病灶,病灶长径之和减少小于20%或病灶长径之和增大。客观有效率(objective response rate,ORR)=(CR+PR)例数/总例数×100%。
1.5 统计学分析
采用SPSS 19.0统计软件进行数据分析,计量资料以均数±标准差(±s)表示,组内比较采用配对t检验,组间比较采用独立样本t检验;计数资料以率(%)表示,组间比较采用χ2检验;等级资料比较采用秩和检验。以P﹤0.05为差异有统计学意义。
2 结果
2.1 化疗前后炎性因子水平的比较
化疗前,两组患者IL-6、IL-8、IL-1β、TNF-α水平比较,差异均无统计学意义(P﹥0.05);化疗后,两组患者IL-6、IL-8、IL-1β、TNF-α水平均较化疗前降低,且研究1组IL-6、IL-8、IL-1β、TNF-α水平均低于研究2组,差异均有统计学意义(P﹤0.05)。(表2)
2.2 化疗前后 T淋巴细胞因子水平的比较
化疗前,两组患者 CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+水平比较,差异均无统计学意义(P﹥0.05);化疗后,两组患者CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+水平均较化疗前升高,且研究1组 CD3+CD4+、CD3+CD56+、CD3+CD4+/CD3+CD8+水平均高于研究2组,差异均有统计学意义(P﹤0.05)。(表3)
2.3 临床疗效比较
研究1组ORR为64.58%(31/48),高于研究2组的43.75%(21/48),差异有统计学意义(χ2=4.196,P﹤0.05)。(表4)
表2 化疗前后两组患者炎性因子水平的比较(±s)
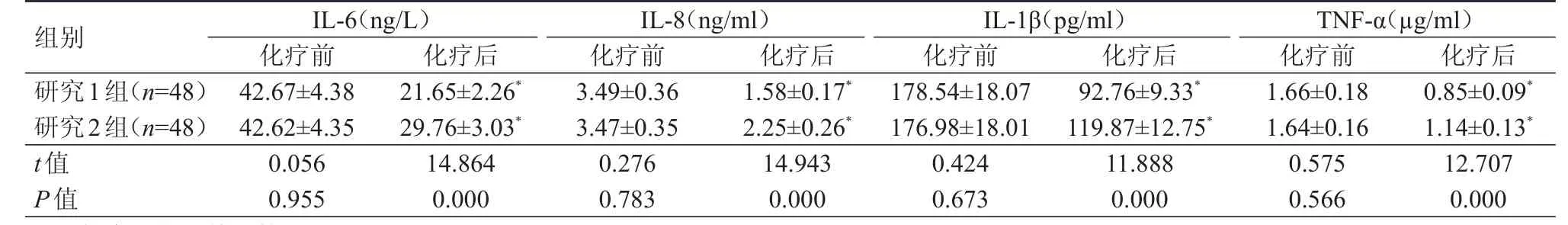
表2 化疗前后两组患者炎性因子水平的比较(±s)
注:*与本组化疗前比较,P<0.05
组别IL-6(ng/L)化疗前 化疗后IL-8(ng/ml)化疗前 化疗后IL-1β(pg/ml)化疗前 化疗后TNF-α(µg/ml)化疗前 化疗后研究1组(n=48)研究2组(n=48)t值P值42.67±4.38 42.62±4.35 0.056 0.955 21.65±2.26*29.76±3.03*14.864 0.000 3.49±0.36 3.47±0.35 0.276 0.783 1.58±0.17*2.25±0.26*14.943 0.000 178.54±18.07 176.98±18.01 0.424 0.673 92.76±9.33*119.87±12.75*11.888 0.000 1.66±0.18 1.64±0.16 0.575 0.566 0.85±0.09*1.14±0.13*12.707 0.000
表3 化疗前后两组患者 T淋巴细胞因子水平的比较(±s)
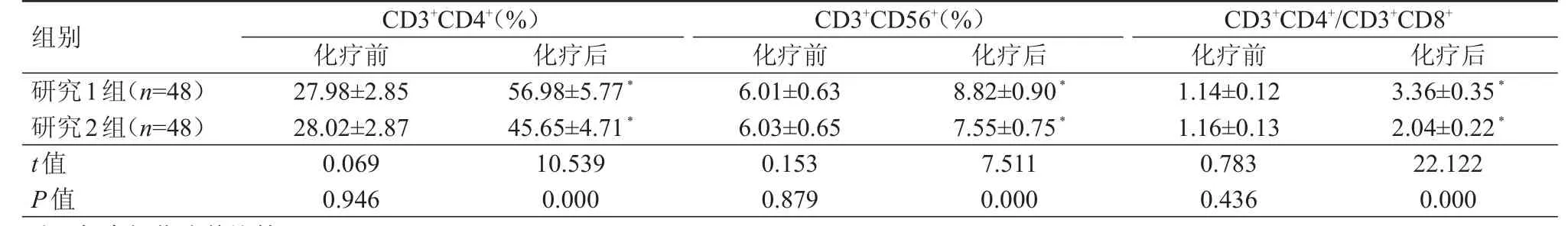
表3 化疗前后两组患者 T淋巴细胞因子水平的比较(±s)
注:*与本组化疗前比较,P<0.05
组别CD3+CD4+(%)化疗前 化疗后CD3+CD56+(%)化疗前 化疗后CD3+CD4+/CD3+CD8+化疗前 化疗后研究1组(n=48)研究2组(n=48)t值P值27.98±2.85 28.02±2.87 0.069 0.946 56.98±5.77*45.65±4.71*10.539 0.000 6.01±0.63 6.03±0.65 0.153 0.879 8.82±0.90*7.55±0.75*7.511 0.000 1.14±0.12 1.16±0.13 0.783 0.436 3.36±0.35*2.04±0.22*22.122 0.000

表4 两组患者的临床疗效[ n(%)]
2.4 不良反应发生情况的比较
研究1组血液学不良反应、胃肠道不良反应、骨髓抑制发生率与研究2组比较,差异均无统计学意义(P﹥0.05)。(表5)
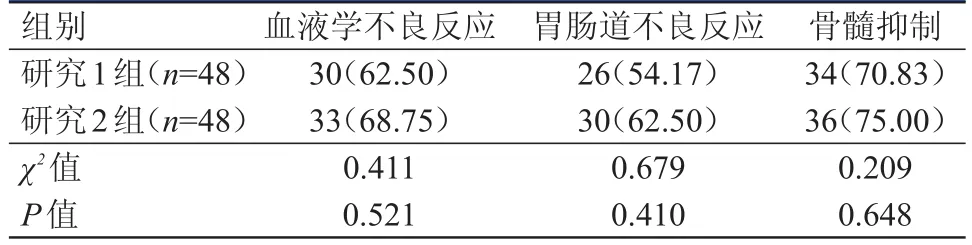
表5 两组患者不良反应发生情况的比较[ n(%)]
3 讨论
新辅助化疗应用于TNBC的目的是降低分期,减小病灶体积,提高手术根治率,降低术后转移和复发率,促进患者转归,或使部分无法行手术治疗的患者获得手术治疗的机会[7]。此外,通过术前新辅助化疗还可评价化疗药物对病灶的控制效果,为术后化疗方案的选择提供思路[8]。临床研究证明,TNBC对化疗药物较为敏感,但目前尚无针对性的化疗方案,临床治疗多选择乳腺癌常规化疗方案[9]。在所有治疗乳腺癌的化疗药物中,蒽环类药物临床效果最佳,故新辅助化疗多选择蒽环类药物与其他化疗药物相联合的化疗方案[10]。多西紫杉醇属于紫杉类药物,为当前TNBC化疗方案中活性较强的药物。研究证明,多西紫杉醇可有效结合游离微管蛋白,促进生成稳定微管,并抑制其发生解聚,促进微管固定及生成正常功能丧失的维管束,从而达到干预肿瘤细胞有丝分裂,杀灭肿瘤细胞的目的[11]。表柔比星属于蒽环类药物,可通过影响DNA聚合酶α、β亚基抑制核酸的合成,直接嵌入肿瘤DNA双链的碱基对间,干预DNA正常的复制、转录及翻译,影响细胞分裂周期,导致肿瘤细胞死亡[12]。在本研究中,研究1组ORR高于研究2组,且两组患者不良反应发生情况比较,差异无统计学意义,提示多西紫杉醇联合表柔比星化疗方案治疗TNBC较研究2组化疗方案更具优势。
研究证明,在乳腺癌的发生发展中,炎性因子发挥着重要作用[13]。资料显示,IL-6可通过干预肿瘤干细胞、细胞周期相关基因、肿瘤血管生成促进肿瘤进展[14]。IL-8是促血管生成因子,可刺激肿瘤血管生成,促进肿瘤细胞增生及迁移[15]。IL-1β能够直接影响乳腺癌血管的生成及乳腺癌细胞的侵袭与凋亡。IL-1β可通过影响IL-1受体促使生成IL-8,刺激乳腺癌血管生成,并提高其侵袭能力[16]。TNF-α可提高诱导血管内皮细胞与血管内皮生长因子特异性结合及促进生成IL-8提高乳腺癌新生血管生成能力[17]。研究证明,肿瘤细胞具有较强的自我保护能力,其不但能够合成分泌免疫抑制因子使其不受免疫效应细胞攻击,而且免疫抑制因子还可抑制机体抗肿瘤免疫,为肿瘤细胞的生存创造有利的环境[18]。此外,肿瘤细胞还可通过竞争性掠夺机体营养导致免疫疲弱,降低机体免疫能力[19]。在本研究中,化疗后研究1组患者炎性因子水平低于研究2组,T淋巴细胞因子水平高于研究2组,提示多西紫杉醇联合表柔比星化疗方案可有效杀灭TNBC细胞,解除机体免疫抑制,抑制炎性因子,提高机体免疫机能。
综上所述,多西紫杉醇联合表柔比星化疗方案治疗TNBC可有效杀灭肿瘤细胞,改善机体免疫功能,疗效好,且不增加不良反应发生率,值得临床应用。

