利用黑曲霉B1401发酵废弃茶末浸提液产单宁酶的工艺优化
胡 娜,吴鑫颖,*,邱树毅,*,王 艳,唐佳代
(1.贵州大学贵州省发酵工程与生物制药重点实验室,贵州贵阳 550025;2.贵州大学酿酒与食品工程学院,贵州贵阳 550025)
单宁酶(EC3.1.1.20)是一种细胞膜结合酶,能够水解单宁中的酯键和缩酚羧键,生成葡萄糖、没食子酸[1],该酶应用广泛,主要应用于精细化工、皮革、饲料、制药、食品饮料等领域[2]。能够产生单宁酶的微生物来源十分丰富,主要是真菌类的曲霉属、青霉属和根霉属等,尤其是曲霉属中的黑曲霉、米曲霉和黄曲霉[3]。其中由于黑曲霉具有生长迅速、发酵周期短等优点,而使得目前研究较多较深入的是黑曲霉[4]。
贵州是茶生产与消费大省,茶树的发源地之一。在茶叶生产过程中,会产生大量的废弃茶末,既污染环境,又造成生物资源的巨大浪费。茶末浸提液主要化学成分是茶多酚、氨基酸、黄酮化合物、酯型儿茶素、蛋白质、茶多糖、果胶质和咖啡碱等[5],于是考虑将茶末浸提液作为培养基供微生物利用。本实验创新性地利用废弃茶末浸提液作为发酵培养基,对黑曲霉B1401产单宁酶的发酵条件进行优化,以提高单宁酶酶活,为废弃茶末的利用提供新思路和理论依据。
1 材料与方法
1.1 材料与仪器
黑曲霉B1401 贵州大学贵州省发酵工程与生物制药重点实验室保藏;废弃茶末 贵州省遵义市湄潭县某茶厂;氢氧化钠、蔗糖、尿素、可溶性淀粉、硫酸镁、磷酸氢二钾、硝酸钠、硫酸铵、单宁酸、没食子酸、氯化钠、柠檬酸、柠檬酸钠、绕丹宁、没食子酸丙酯、钼酸钠、碳酸钠等 均为分析纯,成都金山化学试剂有限公司;斜面培养基 1%单宁酸,2%蔗糖,0.3% NaNO3,0.1% K2HPO4·3H2O,0.05% MgSO4·7H2O,0.05% KCl,0.001% FeSO4,4%琼脂,pH4.5左右,用于菌种保藏;液体培养基 1%(NH4)2SO4,0.1%MgSO4·7H2O,0.1%NaNO3,0.1%K2HPO4·3H2O,pH5.0,用于黑曲霉产单宁酶的液态发酵培养。
721s可见分光光度计 上海精密科学仪器有限公司;MJX-250B-Z霉菌培养箱、BXM-30R立式压力蒸汽灭菌器 上海博讯实业有限公司医疗设备厂;JJ-CJ-1FD洁净工作台 苏州市金净净化设备科技有限公司;DK-98-11电热恒温水浴锅 天津市泰斯特仪器有限公司;PHS-3C pH计 上海虹谊仪器仪表有限公司等;BCD-215DK冰箱 青岛海尔股份有限公司;ECLIPSE-E200显微镜 Nikon公司;SHZ-Ⅲ循环水式真空泵 上海亚荣生化仪器厂;MutlifugeX1R高速冷冻离心机 德国Themo Scietific Heraeus;ZWY-111B恒温培养振荡器 上海智城分析仪器制造有限公司;HC-280T2高速多功能粉碎机 永康市绿可食品机械有限公司。
1.2 实验方法
1.2.1 孢子悬浮液的制备 黑曲霉B1401菌株转接入菌种斜面保藏培养基中,30 ℃培养96 h,获得出发菌株。在试管斜面中加入10 mL的无菌生理盐水,在无菌操作台中酒精灯旁,用接种环刮下孢子,振荡培养1 h,使孢子充分分散,制成孢子菌悬液,经血球计数板镜检,使菌种数达到108/mL的水平。
1.2.2 茶末浸提液的制备 准确称取3.000 g粉碎的茶末(用粉碎机将废弃茶末粉碎至40~60目)于100 mL烧杯中,加入90 mL预热至95 ℃的蒸馏水,摇动使茶叶完全湿润,立即移入95 ℃的水浴锅中,浸提20 min(中途搅拌2~3次),浸提完成后用快速定性滤纸过滤得到浸提液[6]。
1.2.3 茶末浸提液中茶多酚、单宁酸含量的测定 茶多酚含量的测定参照国标GB/T 8313-2008方法二——茶叶中茶多酚和儿茶素类含量的检测方法[9]。单宁酸含量的测定参考NY/T1600-2008分光光度法[10]。对茶末浸提液的茶多酚、单宁酸含量进行测定,测得其茶多酚含量为12%,单宁酸含量为8%。
1.2.4 茶末浸提液的发酵 由预实验得,3%茶多酚+6%单宁酸复配下产酶效果好。于是将制得的茶末浸提液稀释4倍后备用,此时浸提液中单宁酸含量2%、茶多酚含量3%。向90 mL/250 mL茶末浸提液培养基中添加4%的单宁酸,接种量1%,摇匀后用纱布封口置于140 r·min-1、30 ℃的摇床中培养72 h。
1.2.5 单因素设计
1.2.5.1 培养基条件优化 a.诱导物对菌株产单宁酶的影响:在90 mL/250 mL液态培养基中添加6%单宁酸、3%茶多酚、6%单宁酸+3%茶多酚,接种1%,30 ℃、140 r·min-1摇床中培养,分别在培养时间为24、48、60、72、84、96、108 h时,收集菌体,测定胞内酶酶活,考察不同诱导物对单宁酶酶活的影响。
b.碳源复配对单宁酶酶活的影响:将茶末浸提液培养基中的总碳源固定在1%,其中慢速利用碳源淀粉与快速利用碳源蔗糖比分别配成0.1∶0.9、0.3∶0.7、0.5∶0.5、0.7∶0.3、0.9∶0.1,其余组分不变,接种1%,30 ℃、140 r·min-1摇床中培养72 h。收集菌体测定胞内酶酶活,考察碳源复配比对单宁酶酶活的影响。
c.氮源复配对单宁酶酶活的影响:将茶末浸提液发酵培养基中的总氮源固定在1%,其中慢速利用氮源尿素与快速利用氮源硝酸钠比分别配成0.1∶0.9、0.3∶0.7、0.5∶0.5、0.7∶0.3、0.9∶0.1,其余组分不变,接种1%,30 ℃、140r·min-1摇床中培养72 h。收集菌体测定胞内酶酶活,考察氮源复配比对单宁酶酶活的影响。
d.无机盐离子对单宁酶酶活的影响:在茶末浸提液发酵培养基中添加0.05%的K2HPO4、NaCl、CaCl2、MgSO4、CuSO4、MnSO4、ZnSO4,其余成分不变,接种1%,30 ℃、140 r·min-1摇床中培养72 h。收集菌体测定胞内酶酶活,考察无机盐离子对单宁酶酶活的影响。
e.表面活性剂对单宁酶酶活的影响:在茶末浸提液发酵培养基中添加0.02%的EDTA、吐温-80、SDS、Triton X-100,其余成分不变,接种1%,30 ℃、140 r·min-1摇床中培养72 h。收集菌体测定胞内酶酶活,考察表面活性剂对单宁酶酶活的影响。
1.2.5.2 培养条件优化 a.培养时间对单宁酶酶活的影响:在90 mL/250 mL的茶末浸提液培养基中,接种1%,30 ℃、140 r·min-1摇床中培养,收集菌体测定胞内酶酶活,考察培养时间对单宁酶酶活及菌体干重的影响。
b.装液量对单宁酶酶活的影响:在250 mL三角瓶中添加50、70、90、100、110 mL的茶末浸提液,接种1%,30 ℃、140 r·min-1摇床中培养72 h,收集菌体测定胞内酶酶活,考察装液量对单宁酶酶活的影响。
c.转速对单宁酶酶活的影响:在装有90 mL/250 mL的茶末浸提液发酵培养基中接种1%,转速控制在120、140、160、180、200 r·min-1,30 ℃培养72 h。收集菌体测定胞内酶酶活,考察转速对单宁酶酶活的影响。
d.培养温度对单宁酶酶活的影响:在装有90 mL/250 mL的茶末浸提液发酵培养基中接种1%,温度分别控制在28、30、32、34、36 ℃,140 r·min-1摇床中培养72 h。收集菌体测定胞内酶酶活,考察温度对单宁酶酶活的影响。
e.接种量对单宁酶酶活的影响:在装有90 mL/250 mL的茶末浸提液发酵培养基中接种,接种量分别为0.5%、1%、1.5%、2%、2.5%,30 ℃、140 r·min-1摇床中培养72 h。收集菌体测定胞内酶酶活,考察接种量对单宁酶酶活的影响。
1.2.6 Plackett-Burman实验设计 根据单因素的结果,在以上9个因素中,无机盐离子、表面活性剂对单宁酶酶活的影响很小,碳源、氮源、培养时间、装液量、转速、培养温度、接种量这7个因素对单宁酶酶活有较大影响,所以对以上7个因子选取2个水平进行PB实验设计,高水平为低水平的1.5倍,因素水平表见表1。

表1 PB实验因素水平表
1.2.7 响应面实验设计 采用Box-Behnken,以单宁酶酶活为指标,对碳源比、装液量、转速进行优化。实验因素与水平见表2。

表2 响应面实验因素水平表
1.2.8 粗酶液的提取 过滤发酵培养液,收集发酵菌丝。黑曲霉液态发酵产的单宁酶为胞内酶。于是将菌丝分为两部分,一部分在103±2 ℃烘干至恒重,用于测定菌体干重,另一部分用于测定酶活,首先将收集到的菌丝体-20 ℃冷冻3 h左右,再将菌丝、石英砂、柠檬酸缓冲液按质量比1∶1∶5在冰浴的条件下研磨、破碎细胞,在4 ℃低温8000 r·min-1离心机下离心30 min,最后收集离心上清液定容到25 mL作为待测胞内酶粗酶液。
1.2.9 酶活的测定 酶活的定义:在40 ℃,pH=5.0条件下,每分钟内水解底物没食子酸丙酯产生1 μmoL没食子酸所需的酶量定义为一个酶活力单位。
酶活的测定方法:按照保玉心[7]的方法并做相关改进,并根据以下公式进行计算。
X=ΔA520×585.68×5×100×0.001/10 min/g=29.28×ΔA520/g
式中:X-酶活力,U/gds;ΔA520=(Atest-Ablank)-(Acontrol-Ablank);585.68-没食子酸标准曲线回归方程的斜率;5-最后稀释的倍数;100-0.25 mL酶液转换成50 mL总酶液的倍数;0.001-μmol/L变换μmol/mL的倍数;10 min-单宁酶催化底物反应的时间;g-菌体在(103±2) ℃条件下烘干至恒重的质量。
1.2.10 验证实验 对响应面法得到的最优组合条件进行验证,设置5组平行验证实验,验证模型的有效性。
1.3 数据处理
所有实验数据均重复3次,Origin 8.6软件作图,运用Design-expert(version 8.0.6.1)分析软件进行数据分析处理。
2 结果与讨论
2.1 单因素实验结果
2.1.1 培养基条件优化
2.1.1.1 诱导物对单宁酶酶活的影响 不同诱导物复配比对单宁酶酶活的影响见图1,在以上3种条件中,单宁酸与茶多酚复配结果最好;单宁酸次之,茶多酚最差;同时发现在单宁酸与茶多酚复配条件下,单宁酶酶活在发酵第72 h达到了最大值,早于单宁酸与茶多酚条件下的最佳产酶时间。之后三者都呈现出随着发酵时间的延长,单宁酶酶活逐渐下降的趋势。所以,最终确定最佳诱导物为6%单宁酸与3%茶多酚复配,后续实验优化都是在这个最佳诱导物基础上进行的。

图1 诱导物对单宁酶酶活的影响
2.1.1.2 碳源复配对单宁酶酶活的影响 碳源对单宁酶酶活的影响见图2,产酶随慢速利用碳源淀粉与快速利用碳源蔗糖的比例的增大先增加后减少,当慢速利用碳源淀粉与快速利用碳源蔗糖的比例为0.7%∶0.3%(w/v)时,酶活力达到最大值。碳源分为慢速利用碳源和快速利用碳源,两者的合适比例可保证菌种的适度生长,避免过高的葡萄糖浓度抑制单宁酶合成的现象,有助于提高单宁酶产量[10]。所以,最终选择产酶最适的慢速利用碳源淀粉与快速利用碳源蔗糖的比例为0.7%∶0.3%(w/v)。

图2 不同碳源比例对单宁酶酶活的影响
2.1.1.3 氮源复配对单宁酶酶活的影响 氮源对单宁酶酶活的影响见图3,产酶随尿素与硝酸钠比例的增大先增加后减少,当尿素与硝酸钠的比例为0.3%∶0.7%(w/v)时,酶活力达到最大值。无机氮源成分单一,质量稳定,可被快速利用,同时有机氮源除含有丰富的蛋白质、肽类、游离的氨基酸以外,还含有少量的糖类、脂肪和生长因子等,微生物在含有机氮源的培养基中常表现出生长旺盛、菌体浓度增长迅速等特点。因而在工业化生产中,通常使用有机氮与无机氮的混合氮源。此外,该结果与文献[11]中报道的尿素、硝酸钠作为氮源菌株生长及产酶情况均较理想一致。所以,最终选择产酶最适的尿素与硝酸钠的比例为0.3%∶0.7%(w/v)。

图3 不同氮源比例对单宁酶酶活的影响
2.1.1.4 无机盐离子对单宁酶酶活的影响 无机盐离子对单宁酶酶活的影响见图4,添加的无机盐离子均对单宁酶酶活产生不同程度的抑制作用,其中K2HPO4、MgSO4抑制作用较弱,MnSO4抑制效果最强。Hossam S.Hamdy等[12]研究发现Ca2+、K+、Mg2+、Mn2+等离子对单宁酶酶活有激活作用,而Ba2+、Co2+、Cu2+、Fe3+、Zn2+有抑制作用。朱继新等[13]研究发现Zn2+在低浓度下对单宁酶酶活有促进作用,而Fe3+、Fe2+、Cu2+有抑制作用。李秧针等[14]研究发现Fe3+、Cu2+、Fe2+、Ba2+、Mn2+、Ca2+、Al3+等对单宁酶酶活有抑制作用。李红歌等[15]研究发现K+、Ag+、Zn2+等金属离子可促进酶促反应的进行,Na+、Mg2+、Ca2+、Fe3+、Hg2+、Co2+、Mn2+、Cu2+、Ba2+、Fe2+均能在不同程度上抑制酶活力。根据以上结果,所以最终选择不在培养基中添加额外的金属离子。
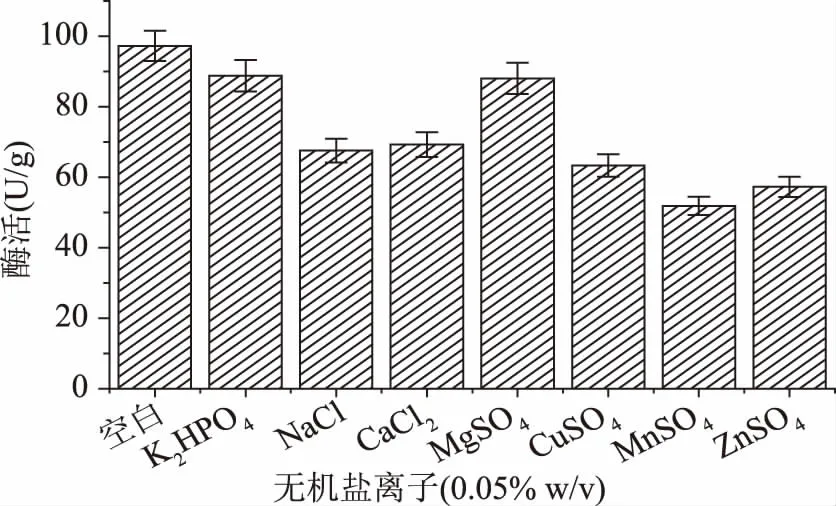
图4 不同无机盐离子对单宁酶酶活的影响
2.1.1.5 表面活性剂对单宁酶酶活的影响 表面活性剂对单宁酶酶活的影响见图5,添加的表面活性剂均对单宁酶酶活产生不同程度的抑制作用,其中EDTA抑制作用最强。该实验结果与Battestin和Macedo[16]等报道的Tween80、Triton X-100、EDTA均能抑制单宁酶酶活一致。表面活性剂之所以能够抑制单宁酶的活性,这是因为这些组分附于单宁酶的疏水表面,占据了酶的活性中心,使酶与底物的结合作用减少,从而抑制酶活力。目前文献报道的关于表面活性剂及螯合剂对单宁酶酶活的影响不尽一致。李秧针等[14]报道吐温80、EDTA对黑曲霉B0201发酵产单宁酶影响不明显。倪田表等[17]报道单宁酶酶活被表面活性剂十二烷基磺酸钠、吐温-80 完全抑制,而在聚乙二醇辛基苯基醚中酶活保持稳定。根据以上结果,所以最终选择不在培养基中添加额外的表面活性剂及螯合剂。

图5 不同表面活性剂对单宁酶酶活的影响
2.1.2 培养条件优化
2.1.2.1 培养时间对单宁酶酶活及菌体干重的影响 培养时间对单宁酶酶活及菌体干重的影响见图6,单宁酶酶活力随时间的增加而增加,在72 h时达到最大值,然后随时间的延长不断减少。发酵前期,菌丝未完全生长,产酶量较小,酶活力较低;黑曲霉以单宁为碳源,单宁诱导黑曲霉产单宁酶,分解单宁,因此单宁酶的产量增加,当培养至72 h时,酶活达到最大值。菌体量和酶活未同时达到最大值,可能是因为后期单宁酸及茶多酚等诱导物减少,酶产量下降但是营养物质足够,菌体继续生长。后期菌体出现衰老,可能是因为发酵后期培养基营养物质不足导致的[18-19]。所以,最终选择的产酶最适培养时间为72 h。

图6 培养时间对单宁酶酶活的影响
2.1.2.2 装液量对单宁酶酶活的影响 装液量对单宁酶酶活的影响见图7,随着装液量的增加,单宁酶酶活力先上升后下降。当装液量为90 mL/250 mL时,单宁酶酶活达到最大值。这是因为在恒定的三角瓶中装载量过少,溶解氧低,使培养基粘度增大,搅拌难度增加;装液量过大,就会减少锥瓶中换气的空间,造成发酵液中溶氧量不足。所以,最终选择的产酶最适装液量为90 mL/250 mL。

图7 装液量对单宁酶酶活的影响
2.1.2.3 转速对单宁酶酶活的影响 转速对单宁酶酶活的影响见图8,随着摇床转速的增大,单宁酶酶活力先增加后降低。当摇床转速为140 r·min-1时,单宁酶活力达到最大值。一方面,转速的大小决定了培养液中菌丝球所受机械力的大小。另一方面,转速与培养体系的溶氧状况有关,适宜的溶氧浓度有利于菌株生长代谢。转速过低时,不利于产菌体和培养基的充分混合及溶氧;转速过大时,培养液在三角瓶中易形成“打旋”现象,反而不利于物质的充分混合,不利于产酶。所以,最终选择产酶最适转速为140 r·min-1。

图8 转速对单宁酶酶活的影响
2.1.2.4 培养温度对单宁酶酶活的影响 培养温度对单宁酶酶活的影响见图9,单宁酶酶活力随着温度的升高先增加后减少,在30 ℃时达到最大值。温度的变化对菌体生产单宁酶有一定的影响:当温度较低的时候,黑曲霉生长速度比较慢,发酵产酶受抑制;当温度升高,反应速率加快,生长代谢加快,微生物代谢物产量提高。但是温度过高时,也会抑制霉菌的生长甚至杀死微生物。所以,最终选择产酶最适的培养温度为30 ℃。
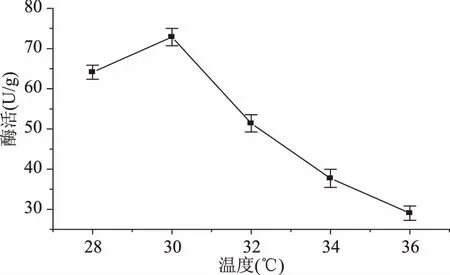
图9 培养温度对单宁酶酶活的影响
2.1.2.5 接种量对单宁酶酶活的影响 接种量对单宁酶酶活的影响见图10,单宁酶酶活力随接种量的增大先增加后减少,接种量在1%时,酶活力达到最大值。这说明在相同的培养基中,同等发酵条件下,如果孢子数过少,其产酶效果不好;但如果接种量过大,培养基中的营养物质供应不足,将会导致细胞衰亡,产酶量也受抑制[20]。所以,最终选择产酶最适的接种量为1%。

图10 接种量对单宁酶酶活的影响
2.2 PB实验结果与分析
PB实验结果见表3、各因素影响情况见表4及PB实验设计主效应分析结果见表5。

表3 PB实验结果
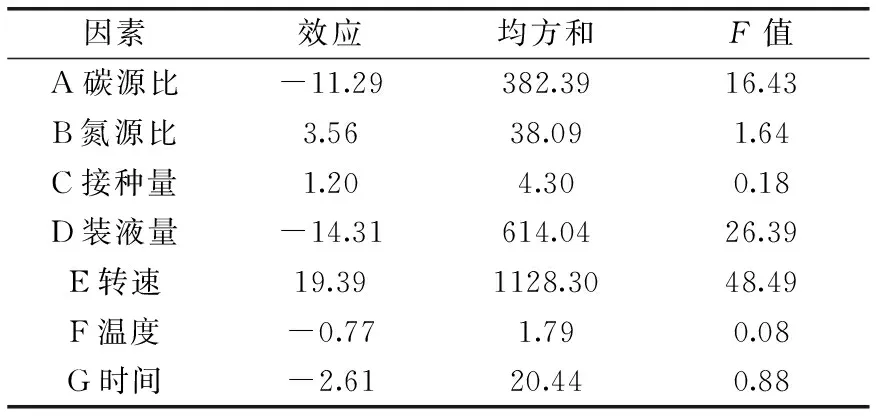
表4 各因素对发酵培养基产单宁酶影响
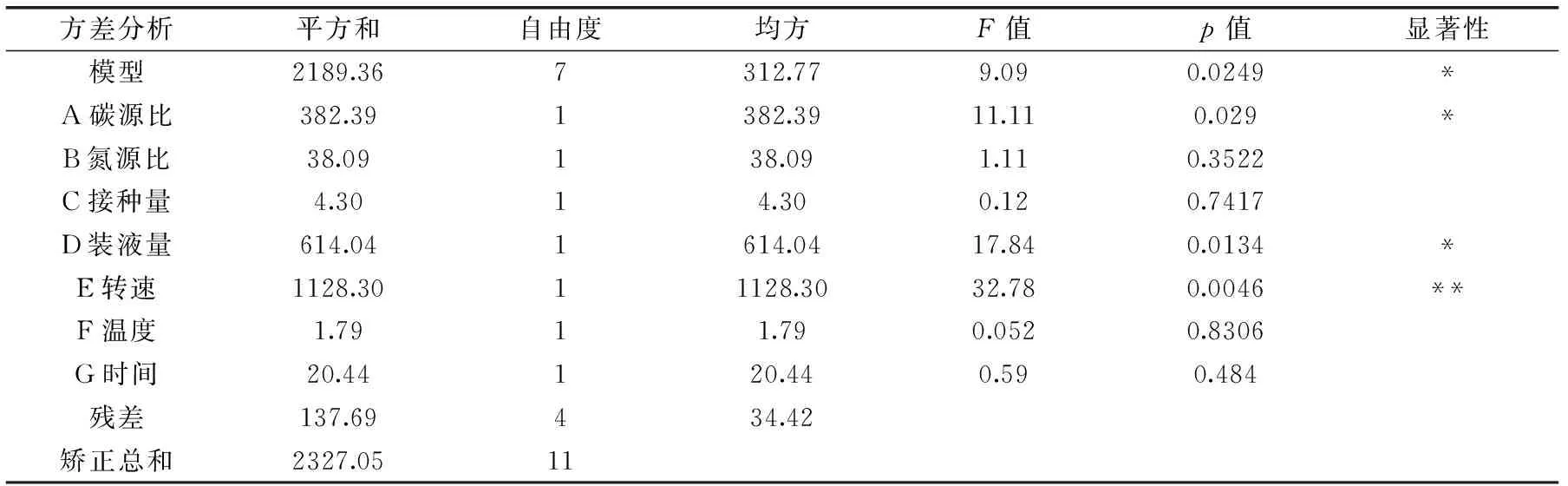
表5 PB实验设计主效应分析结果
由表4可知,在PB设计的二水平范围内,碳源比、装液量、温度及时间对单宁酶酶活为负效应,而氮源比、接种量及温度对单宁酶酶活为正效应。即在本实验范围内,随着氮源比、接种量及转速的增加,单宁酶酶活呈上升趋势,相反随着碳源比、装液量、温度及时间的降低,单宁酶酶活呈上升趋势。由表4可知,这7个因素对单宁酶酶活提高的影响顺序依次为:转速>装液量>碳源比>氮源比>时间>接种量>温度。因此,选择转速、装液量和碳源比这三个显著因素进行下一步优化。
2.3 响应面实验结果与分析

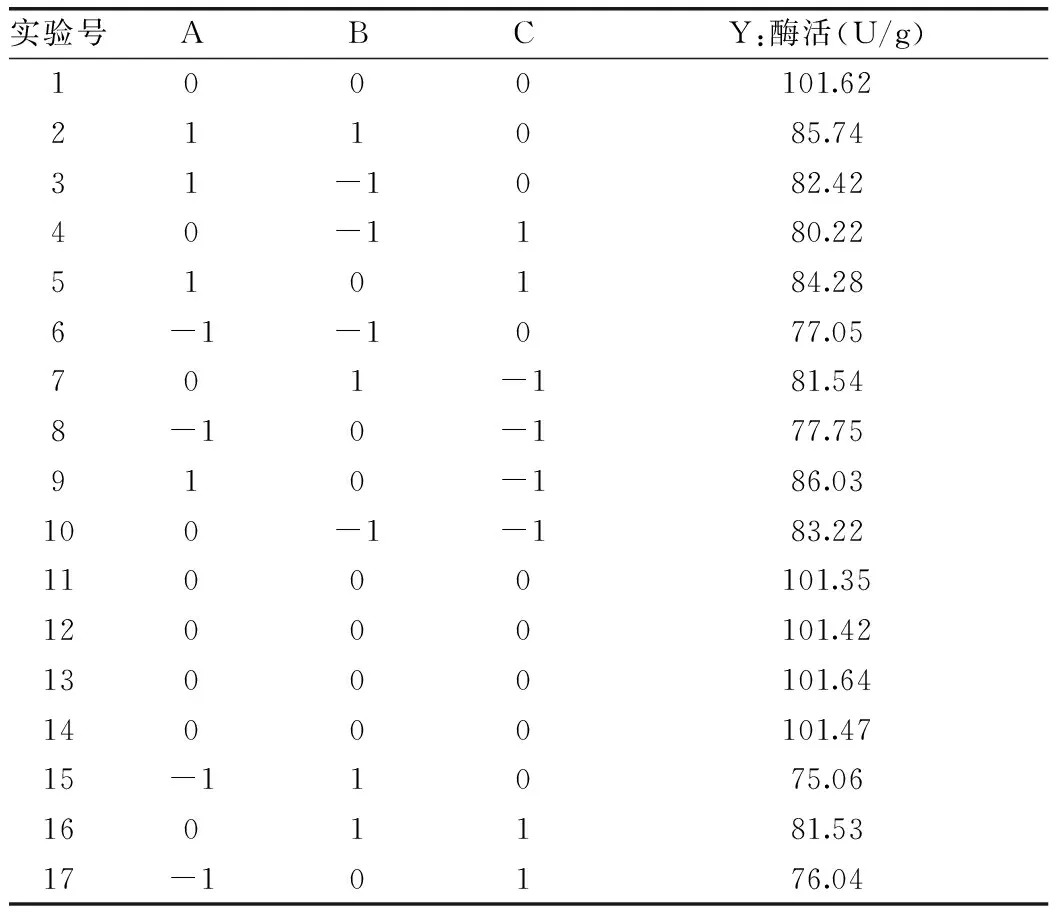
表6 响应面实验设计与结果

表7 响应面实验方差分析
根据拟合函数,每两个因素对单宁酶酶活绘制响应面和等高线。如图11~图13立体分析图所示,响应曲面图可以形象地描述各因素之间的交互作用,等高线的形状可以反映因素间交互作用的强弱,椭圆形表示交互作用强,圆形表示交互作用弱[22]。碳源比和装液量、装液量和转速交互作用显著,而碳源比和转速交互作用不显著。每两个因素之间的影响基本呈抛物线型关系,且均有一个极值点,变化趋势都是先增大后减少。

图11 响应面法(碳源比、转速)立体分析图和相应等高线

图12 响应面法(装液量、转速)立体分析图和相应等高线

图13 响应面法(碳源比、装液量)立体分析图和相应等高线
2.4 验证实验结果
由软件分析得出:当碳源比(A)为2.94,即可溶性淀粉∶蔗糖=0.746%∶0.254%、装液量(B)为90.25 mL/250 mL、转速(C)为139.57 r·min-1时,响应值达到最大值,酶活力为105.14 U/g。
为了验证模型的准确性,在预测最佳培养基配方条件下进行发酵实验。由于预测的值中存在小数,考虑到实际情况,从而将装液量调整为90 mL/250 mL、转速调整为140 r·min-1,进行5次平行实验,实验结果单宁酶活力为(104.82±1.44) U/g。
由上可知,实际测得值104.82 U/g与预测值105.14 U/g十分接近,表明响应面法对茶末浸提液液态发酵产单宁酶的优化是可行的且具有实际应用价值。
3 结论与展望
本实验探索了废茶末浸提液液态摇瓶发酵制备单宁酶的工艺,为废茶末的综合利用提供了新的途径。不仅实现了废物利用,变废为宝,而且利用茶汤中的茶多酚作为诱导物产单宁酶,使得单宁酶酶活远高于国内外目前利用废弃物产酶的酶活值。对产酶诱导物进行了探索,同时在此基础上运用单因素实验、PB实验、BB响应面实验对培养基成分及培养条件进行了优化,得到了最优的培养基配方与发酵条件。最佳诱导物为6%单宁酸+3%茶多酚,最佳碳源为复配碳源即0.746%可溶性淀粉:0.254%蔗糖,氮源为复配氮源即0.3%尿素:0.7%硝酸钠,接种量为1%,装液量为90 mL/250 mL,转速为140 r·min-1,发酵温度为30 ℃、发酵时间为72 h,此条件下单宁酶酶活可达104.82 U/g。
——“单宁”

