室温下注射用头孢西丁稳定性研究*
王洪锐,徐玉红,何 英
(1.广东省深圳市宝安区福永人民医院,广东 深圳 518103; 2.中山大学附属第八医院,广东 深圳 518033)
药品效期是指药品在规定贮藏条件下,能维持其质量标准的最大期限。每种药品都标示有经药品监管部门批准的贮藏条件及有效期,严格遵守药品规定的贮藏条件,并在效期内使用,是保证药品安全性和有效性的重要前提。而实际情况是,市场上流通使用的药品,说明书【贮藏】项标示为冷处及阴凉处贮藏的药物越来越多,而在药品供应、使用的终端环节,如急救车、医院药房备药环节,患者出院带药环节及临床配液给药环节,很难保证药品在贮存、使用全过程中完全符合贮藏条件[1-5]。头孢西丁为半合成的第2代头孢菌素类抗菌药物,对革兰阳性菌、革兰阴性菌及厌氧菌均有杀灭作用,且具有高度抗β-内酰胺酶性质,临床应用广泛。注射用头孢西丁需遮光、密闭、在阴凉干燥处保存(不超过20℃),但医院药房、配液室等终端贮存、使用环节多不能满足此贮存条件,常需要26℃空调室温环境下短暂贮存药品。本研究中采用药物稳定性长期及加速试验方法,观察室温贮藏条件下注射用头孢西丁的稳定性,为在温度变异条件下药品的短期贮存管理提供依据。现报道如下。
1 仪器与试药
1.1 仪器
Agilent 1100型高效液相色谱仪,包括G1311A四元泵、G1322A真空脱气机、G1315B-DAD检测器、D1316A柱温箱,rheodyne-7725i手动进样器、Chem-Station工作站(美国安捷伦公司);UV-2201型紫外分光光度计(日本岛津公司);AG285型电子天平(梅特勒托利多仪器有限公司);pHS-3C数字pH计(上海精科雷磁仪器厂);DGX-90703B-1型电热鼓风干燥箱(10~250℃,温度波动范围为±1℃,上海福玛实验设备有限公司)。
1.2 试药
头孢西丁对照品(中国食品药品检定研究院,批号为130572-201102,质量分数为95.3%,供含量测定用);注射用头孢西丁(海南某制药有限公司,批号分别为 140301,140602,141001,规格为每支 2.0 g);甲醇、乙腈均为色谱纯(德国Merck公司);其他试剂均为分析纯,水为高纯水。所有试剂及缓冲液使用前均经0.45μm微孔滤膜滤过。
2 方法与结果
2.1 含量及有关物质测定[6]
色谱柱:ZorbaxEclipseXDB-C18柱(250mm×4.6mm,5μm);流动相:水 -乙腈 -冰醋酸(81∶19 ∶1);检测波长:270nm;流速:1.0mL /min;柱温:25℃;进样量:10μL。系统适用性试验符合药典要求。有关杂质含量测定采用梯度洗脱法进行。
2.2 长期稳定性试验
取足够数量3个批号的注射用头孢西丁(试验开始日期距离标示生产日期不超过6个月),以市售原包装形式分别贮存在18,26,30℃3个温度条件下放置6个月,首次测定分析后每隔1个月取样测定分析。比较含量、杂质、酸度、澄清度和颜色变化情况,以评估注射用头孢西丁在规定贮藏条件下和非规定贮藏条件下的质量稳定性。结果显示,在18℃和26℃贮存6个月后,其质量可维持稳定;在30℃贮存6个月后,批号为141001的药品标示含量不达标,颜色及杂质总量接近高限。结果见表1至表3。
2.3 杀菌效力试验
选取质控菌株金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922及1株临床分离经生化鉴定为肺炎克雷伯菌且对头孢西丁敏感的菌株为试验对象,采用常量肉汤稀释法比较不同温度条件下贮存0,3,6个月后3批注射用头孢西丁最小抑菌/杀菌浓度(MIC/MBC)的变化情况。
结果各批号注射用头孢西丁在18℃和26℃贮存6个月后,对金黄色葡萄球菌ATCC29213、大肠埃希菌ATCC25922及临床分离的肺炎克雷伯菌的 MIC/MBC未发生变化;30℃贮存6个月后,批号为140602及141001的药品在3个月或6个月时对上述菌株 MIC发生变化,但按美国临床和实验室标准化协会(clinicaland laboratory standard institute,CLSI)标准规定[7],仍在规定范围内。

表1 注射用头孢西丁18℃长期稳定性试验结果
2.4 等温加速试验
采用经典恒温法对注射用头孢西丁在25℃的有效期进行推算。分别将若干支注射用头孢西丁置40,50,60,70℃ 4个温度条件下,分别在设定试验时间(t)取样进行含量测定,并计算其标示量(A)。结果见表4。得到的数据分别按0级、1级和2级化学反应动力学方程进行拟合,以获得其最佳热降解动力学方程。结果表明,在设定温度范围内,注射用头孢西丁热降解可用一级反应动力学方程ln C=ln C0-Kt描述。不同温度时间条件下的线性回归方程及相关系数见表5,各方程斜率相反数即对应各温度下的速率常数。根据阿仑尼乌斯(Arrhenius)公式,以速率常数(K)的自然对数(ln K)对热力学温度(T)的倒数作图并进行线性回归,得方程lnK= -9 269.6/T+19.444(R2=0.980 7)。将温度 20℃和25℃分别代入方程,即可推算出注射用头孢西丁在20℃及 25℃的速率常数分别为 K20=5.07×10-6/h,K25=8.62×10-6/h,按浓度下降至初始浓度的 10%为有效期计算,20℃有效期为29个月,与药品说明书标识效期接近;25℃有效期为17个月,缩短约40%。假定初始标示含量为100.00%,在25℃贮存约6个月后,经推算,其标示含量约为初始标示含量的96.00%。
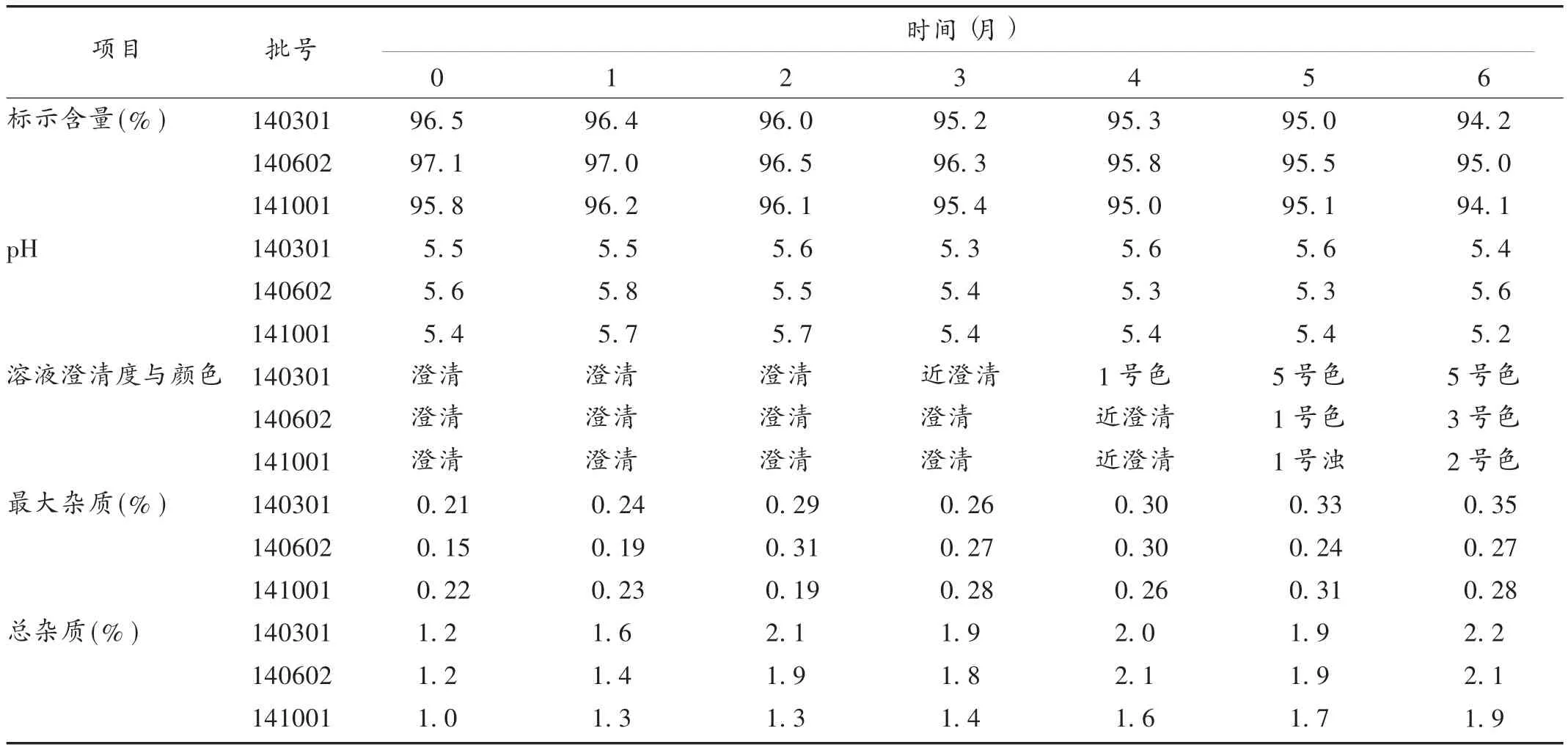
表2 注射用头孢西丁26℃长期稳定性试验结果

表3 注射用头孢西丁30℃长期稳定性试验结果
3 讨论
目前,药品稳定性研究文献中,国内报道基本集中在药品研发、临床配液使用或与其他药品相互配伍稳定性方面,关于市售完整包装药品在温度波动情况下的稳定性研究基本没有[8-10]。本研究中对需在阴凉处贮存的注射用头孢西丁在非规定贮存温度下的稳定性进行了初步研究。6个月长期稳定性试验结果表明,注射用头孢西丁在26℃和30℃ 2个非规定贮存温度条件下分别贮存6个月和3个月后,其含量、有关物质、酸度及检查项(溶液澄清度与颜色)仍符合法定质量标准要求,杀菌效力也未发生明显变化,表明在此模拟贮存条件下和时限内,头孢西丁质量仍相对稳定可靠。

表4 注射用头孢西丁不同温度、不同时间含量测定结果(标示含量)

表5 不同温度时间条件下ln A-t回归方程及相关系数
药物有效期预测方法的理论基础是化学动力学,为预测注射用头孢西丁在常温条件下的稳定性及有效期,本研究中采用经典恒温法对其降解规律及有效期进行了研究和预测。结果表明,在试验温度范围内,注射用头孢西丁热降解动力学模式最符合一级动力学反应特征。随着温度逐渐升高,注射用头孢西丁的热降解速率常数逐渐增大,符合温度每升高10℃,反应速率常数增加2~4倍规律特征。研究结果证实,温度对于注射用头孢西丁的稳定性有较大影响,在20℃贮存,预测效期为29个月,与说明书标识有效期接近;25℃贮存时,预测效期为17个月,相比20℃缩短约40%。据此推测,假定标示含量为100.00%的注射用头孢西丁从贮存温度条件符合规定的医院药库领出后,在25℃贮存6个月,药品标示含量约为原始标示量的96.00%,含量项仍符合法定质量标准要求,与长期留样试验结果相符。如果按其药品质量标准标示含量为90.00%~110.00%计算,药品可在25℃贮存6个月的前提是初始标示量不得低于94.00%,且初始标示含量越低,25℃对应的贮存时间越短。在30℃温度条件下,其推算有效期只有10个月。结果表明,温度变化越剧烈,相应的使用效期缩短越明显。
本研究为注射用头孢西丁在医院药房、配液室等终端短暂超规定温度存放提供了一定的参考依据,但也存在一定的局限。如研究只对某一厂家生产的注射用头孢西丁在高于规定贮存温度条件下的稳定性进行了研究,鉴于不同生产厂家生产的同一种药品,工艺质量上可能存在差异,故研究结果不能武断推及其他生产厂家的注射用头孢西丁;即使同一厂家也可能存在工艺质量稳定性差异。对于易致过敏性的药物,温度变异下杂质变化对其致敏性的影响也需要重视。虽然本研究为注射用头孢西丁可能发生的非规定温度条件下的贮存提供了依据,但从监管、法律角度而言,尚无实际意义,在实际药品贮存中应尽可能遵守药品说明书。
药品的稳定性取决于温度、湿度等多种因素,对于完整包装的市售药品,温度因素最关键,温度升高常导致药品降解加速、临床疗效下降,甚至毒性增加。鉴于在药品流通运输、贮存及使用过程中,特别是对于需阴凉处保存的药品,不可避免地会出现超出温度上限的情况,非规定贮存温度条件下短期贮存药品在世界范围内均不可避免[1-5]。因此,对非规定贮存温度条件下药品质量维持程度,如药品的最高耐受温度、在某一温度范围内其可耐受的时间极限等进行研究有现实意义[11]。

