复方二氯乙酸二异丙胺对食管癌的抗肿瘤活性及药理学机制研究
宋竹梅,宋红梅,桂金川,吴海波
(四川省达州市中心医院,四川 达州 635000)
食管癌是排名全球前10的恶性肿瘤,我国食管癌每年新发及死亡人数约占全球的50%,是继胃癌、直肠癌后极易发病的恶性肿瘤[1]。食管癌发病诱因多,如年龄、职业、饮食习惯及家族遗传史等,其中吸烟和饮酒是重要的危险因素,且我国发病患者以鳞癌为主。虽然放射治疗(简称放疗)技术更加精确,不良反应也已相应降低,但大多数患者在治疗时已处于中晚期,接受手术及放疗、化学治疗(简称化疗)后效果不佳,预后很差,5年生存率不到20%[2]。有研究表明,机体糖酵解与食管癌的发生、发展密切相关,并与食管癌放疗抵抗作用关系紧密[3]。另有研究表明,二氯乙酸二异丙胺(diisopropylamine dichloroacetate,DADA)在生理学角度可调节细胞代谢,逆转糖酵解作用[4]。本研究中探讨了DADA对食管癌的抗肿瘤活性及其药理学机制。现报道如下。
1 材料与方法
1.1 仪器与材料
细胞培养皿:6,24,96孔细胞培养板及离心管(美国Corning公司);低温冰箱(日本三洋公司);电子天平(上海精天电子仪器公司);低温离心机(德国西门子公司);垂直电泳仪(美国Bio-Rad公司);Western电转仪(日本岛津公司)等。
食管鳞癌细胞株Eca-109,TE-13(细胞株编号为TCHu 69,中国科学院);二氯乙酸(dichloroacetic acid,DCA,行知生物科技有限公司);二氯乙酸二异丙胺(武汉禾元生物科技有限公司)。细胞培养基及Annexin VFITC/PI细胞凋亡检测试剂盒(南京凯基生物科技有限公司);CCK-8 溶液(南京凯基科技有限公司);Matrigel(美国Millipore公司);Transwell小室(美国Corning公司)。
1.2 方法[5]
抗肿瘤活性分析:96孔板中每孔加入100μL转染24 h后的对数期细胞,在5%CO2及37℃条件下单层铺满孔底,每孔加入10μL CCK-8溶液,其中将加入细胞培养液及CCK-8溶液未加细胞的孔作为空白对照,在450 nm波长检测24 h时的吸光度。使用8μm膜小室及BDSioCoatTMMatrgelTMInvasion Chamber检测DADA对食管癌细胞株的侵袭转移作用。使用染色流式细胞技术及蛋白质印迹法(Western blot)检测Caspase-3的活性形式来分析DADA对食管癌细胞株的凋亡作用。
药理学机制分析:采用克隆形成试验及多靶单击模型探讨DADA对食管癌细胞株放疗的敏感性影响;制作大鼠皮下荷瘤模型,进一步验证体内DADA联合放疗对放疗敏感性的影响;运用Western blot、流式细胞仪检测DADA联合放疗后食管癌细胞株内γ-H2AX的表达、细胞周期及细胞凋亡情况;运用活性氧(reactive oxygen species,ROS)试剂盒检测DADA联合放疗后食管鳞癌细胞内ROS水平。
1.3 统计学处理
2 结果
2.1 DADA食管癌抗肿瘤活性分析
CCK-8细胞毒性试验:结果显示,24 h时,DADA作用于 Eca-109和 TE-13细胞株的半抑制浓度(IC50)分别为 18 mmol/L 和 22 mmol/L,DCA 作用于Eca-109和TE-13细胞株的 IC50分别为32 mmol/L和 33 mmol/L,表明 DADA 对 Eca-109和 TE-13细胞株的抗肿瘤活性强于DCA。
食管癌细胞株侵袭转移作用:将 IC50时的DADA剂量作用于Eca-109和TE-13细胞株,检测24 h后的细胞功能。与对照组相比,不管Matrigel还是Transwell小室试验,DADA处理后的Eca-109和TE-13细胞株通过小室膜的细胞数大量减少(t1=5.329、P1=0.034,t2=5.352、P2=0.031),表明经过 DADA 处理过的食管癌细胞株迁移能力显著减弱。细胞迁移图像见图1。
食管癌细胞株凋亡试验:试验结果显示,经DADA处理过的食管鳞癌 Eca-109和 TE-13细胞株内Cleaved Caspase-3 蛋白含量显著增加(χ21=6.823、P1=0.024,χ22=6.897、P2=0.021),表明经 DADA 处理过的食管鳞癌细胞株的凋亡细胞数明显增加。详见表1。
2.2 DADA药理学机制分析
对食管癌细胞株放疗敏感性的影响:研究结果显示,对于食管鳞癌Eca-109和TE-13细胞株,DADA联合放疗较单纯放疗敏感度分别增加1.38倍和1.05倍。详见表2。Western blot检测γ-H2AX蛋白结果显示,对于Eca-109和TE-13细胞株,DADA联合放疗与单用DADA、单用放疗相比,γ-H2AX蛋白水平均显著升高(χ21=4.163、P1=0.036,χ22=4.731、P2=0.034,χ23=4.526、P3=0.035,χ24=4.953、P4=0.031)。流式细胞仪检测结果显示,DADA联合放疗与单用DADA、单用放疗相比,G2/M周期的细胞数量显著升高(t1=3.711、P1=0.041,t2=3.825、P2=0.043)。表明 DADA 联合放疗可以增加DNA双链的断裂,使大量细胞阻滞在G2/M周期,从侧面表明DADA可以通过多渠道增加放疗敏感性。详见表2。

图1 食管癌细胞株迁移图像
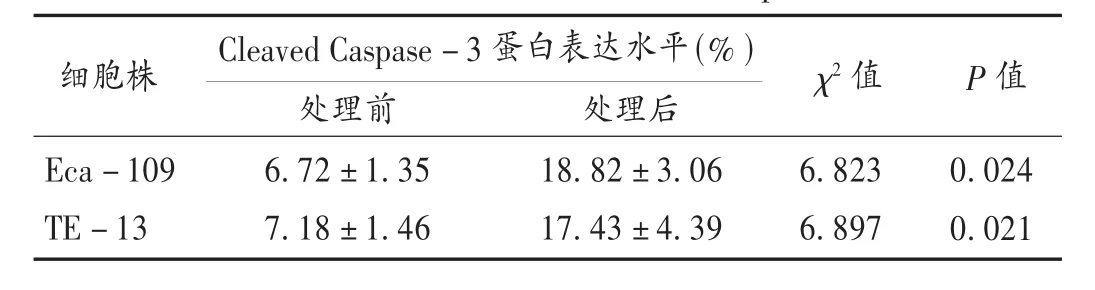
表1 DADA处理前后食管鳞癌Cleaved Caspase-3蛋白表达
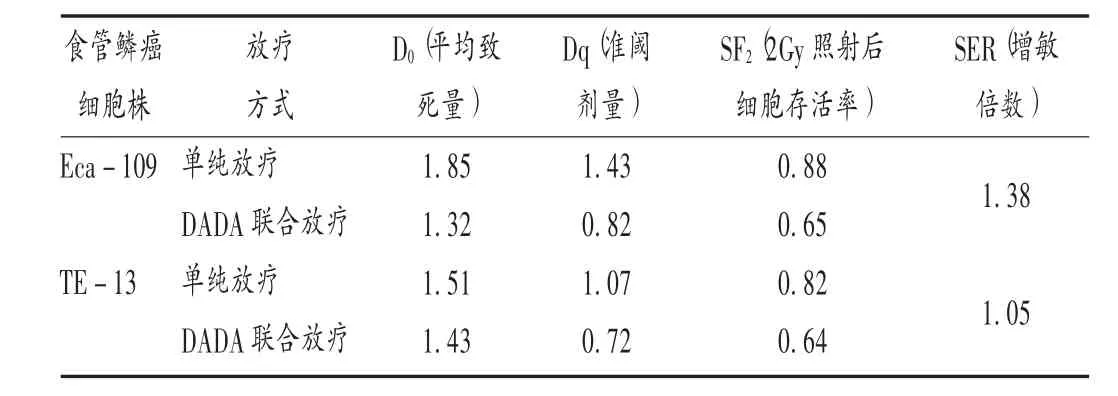
表2 DADA对食管癌细胞株放疗敏感性的影响
对食管癌细胞株放疗敏感性体内验证及ROS水平检测结果:结果显示,3组大鼠中,DADA联合放疗治疗大鼠肿瘤体积及质量均显著低于单用DADA及单用放疗大鼠(P<0.05),进一步说明DADA联合放疗可以增加放疗敏感性,抑制肿瘤生长。DADA联合放疗大鼠的Eca-109和TE-13细胞株内的ROS水平显著增加(P <0.05)。详见表 3。
表3 3组大鼠治疗后肿瘤质量及体积比较(±s)

表3 3组大鼠治疗后肿瘤质量及体积比较(±s)
组别DADA联合放疗组DADA组放疗组F值P肿瘤质量(g)10.31±2.18 15.69±1.96 16.71±2.04 1.803<0.05肿瘤体积(cm3)2.62±0.42 4.19±0.94 5.27±1.27 13.073<0.05 ROS(U /mL)1443.45±59.39 1106.27±36.17 1242.98±42.62 5.247<0.05
3 讨论
食管癌预后不理想,5年生存率极低[6-7],临床治疗方法主要有手术、化疗、靶向治疗及放疗等,放疗在治疗癌症方面起着重要作用,但不同癌种类、不同个体等对放疗的敏感性不同[8-12]。有研究表明,癌细胞的能量代谢与放疗的敏感性密切相关。二氯乙酸盐可降低细胞糖酵解,作为抗肿瘤药物已广泛应用于临床;DADA含有二氯乙酸盐的活性成分,可影响机体内糖酵解调控细胞能量代谢[13-15]。
本研究结果显示,DADA对Eca-109和TE-13细胞株的抗肿瘤活性高于DCA,经DADA处理后的Eca-109和TE-13细胞株,通过小室膜的细胞数目大量减少,表明经DADA处理过的食管癌细胞株迁移能力显著下降。但细胞株内的Cleaved Caspase-3蛋白含量显著增加,表明经过DADA处理过的食管癌细胞株细胞凋亡数量显著上升,因为Cleaved Caspase-3是蛋白酶家族中具有促进细胞凋亡作用的Caspase-3的活性形式。
糖酵解与放疗敏感性紧密相关,癌细胞糖酵解产生大量三磷酸腺苷(ATP)的同时可释放很多大分子物质,如乳酸、丙酮酸等,而这些大分子可有效清除细胞中的氧化自由基(如ROS等),从而降低癌细胞对放疗的敏感性[16-17]。本研究结果显示,对于食管鳞癌Eca-109和TE-13细胞株,DADA联合放疗的放疗敏感度增加1倍,而且Eca-109和TE-13细胞株中ROS水平显著增加,说明DADA通过增加癌细胞株中氧化磷酸化水平而增加ROS水平,从而提高其放射治疗敏感性,与上述研究推论一致。DADA联合放疗与单用DADA、单用放疗相比,Eca-109和TE-13细胞株中γ-H2AX蛋白水平显著升高,G2/M周期的细胞数量显著升高,其中γ-H2AX蛋白是细胞DNA双链损伤程度的标志物,γ-H2AX蛋白水平越高,DNA双链损伤越严重,而放射治疗的原理之一也是产生大量ROS,ROS进一步引起DNA双链断裂[18]。因此γ-H2AX蛋白水平的升高可从侧面反映出DADA可增加食管鳞癌放射治疗的敏感性。本研究结果显示,DADA联合放疗治疗大鼠,其肿瘤体积及质量均显著低于单用DADA及单用放疗(P<0.05)。
综上所述,DADA可抑制食管癌肿瘤细胞生长,促进凋亡,且抑制其迁移,与放疗联用可通过增加癌细胞中ROS水平而增加食管癌放疗的敏感性,从而更好地发挥其抗肿瘤活性。

