无机化学有关乙酸亚铬水合物制备的绿色改进
崔 莺,周 婷,樊善继,陈满生,许志锋,毛芳芳
(1. 衡阳师范学院 化学与材料科学学院,湖南 衡阳 421008;2. 长沙市麓山滨江实验学校,湖南 长沙 410000;3. 南华大学第一附属医院,湖南 衡阳 421008)
乙酸亚铬水合物([Cr(CH3COO)2]2·2H2O),又称醋酸亚铬水合物。其色泽较深,往往呈现出深红色。常温下为晶体,密度为1.79g/cm3。一般情况下,其存在形式均为二聚体分子。乙酸亚铬水合物不溶于冷水、乙醚,微溶于乙醇,极易溶于盐酸[1]。在通常情况下,[Cr(CH3COO)2]2·2H2O很不稳定,易吸收空气中的O2而被氧化成醋酸铬水合物。因此,在做其制备实验时,不宜直接选择在大气气氛条件下进行,而常在惰性气体(例如He、Ne、Ar、Kr等)或者在具有还原性的气氛(例如H2、CH4、CO、SO2等)的保护下合成,避免生成的乙酸亚铬水合物在制备时,迅速被空气中的氧气所氧化[2]。
由“无机化学实验”教材中(第三版)[3],有关制备乙酸铬(II)水合物实验,其实验方案是密封的实验装置(如图1所示),在抽滤瓶中加入过量的金属锌颗粒,作为该反应的还原剂,将Cr3+还原成Cr2+。并利用反应体系所产生的H2作还原性气氛,以及产生的一定压力完成反应。在实验过程中,主要出现下述问题:
(1)在制备过程中,需要考虑到实验产生的H2的量要足够多,才能形成较强的气压,将含有Cr2+离子的溶液顺利压入锥形瓶中,实现与乙酸钠的反应。但是当浓盐酸的用量较多时,反应产物易溶于盐酸,所以产品在最后的洗涤过程中损失量过大,导致产品产率较低[4]。
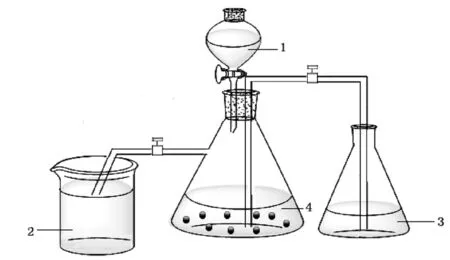
1.分液漏斗内装浓盐酸;2. 水封;3. CH3COONa水溶 液盛于锥形瓶内;4. 抽滤瓶内装Zn粒,CrCl3和去氧水图1 制备[Cr(CH3COO)2]2·2H2O原始装置示意图
(2)实验采用抽滤瓶作为反应装置,但是抽滤瓶底部是平面,其面积、所占空间较大,不易把抽滤瓶中含有的二价铬离子溶液全部压入到盛有CH3COONa溶液的锥形瓶中。从而导致二价铬离子溶液残留量较高,使实验的成功率较低。
(3)在实验过程中,分液漏斗由于体积较大,使底部装置容易发生倾倒。并且,其在滴加液体的过程中,容易松动活塞,盐酸溶液可趁机渗漏出来,具有一定安全隐患。
(4)放置去氧水的锥形瓶在敞口的状态下,空气中的氧气易溶于瓶中的去氧水中,从而造成Cr(II)的氧化,导致产品的产率降低。
针对上述问题 , 本实验主要对原来的实验装置进行了改进并对盐酸的用量进行了探究。改进后的实验,提高了反应液转移的效率,增强了实验的安全性,在保证实验产率和产品质量的前提下,减少了反应物和盐酸的用量,使得此实验遵循了绿色化学理念。
1 改进实验的内容
1.1 实验原理
首先,利用金属Zn作为还原剂,把Cr3+还原成Cr2+,然后利用反应体系中产生的H2作为还原性气氛,用连接在盛装CH3COONa抽滤瓶支管口处的注射器,将还原后的二价铬离子溶液抽入到盛有CH3COONa的溶液中,制得产物。制备该反应的离子方程如下[5]:
2Cr3++Zn→2Cr2++Zn2+
2Cr2++4CH3COO-+2H2O→[Cr(CH3COO)2]2·2H2O
1.2 仪器与试剂
试剂: CrCl3·6H2O、Zn粒、无水CH3COONa、浓盐酸、去氧水、乙醚(分析纯)。
仪器与材料:烧杯(100mL)、三口圆底烧瓶、注射器2支(10mL和20mL各一支)、螺旋夹2个、吸滤瓶(50mL)、布氏漏斗、胶头滴管、玻璃棒、空心玻璃塞、玻璃导管、橡胶管、两孔橡皮塞。
1.3 实验步骤

1.注射器内装浓盐酸;2.导管连胶头滴管的下端; 3.三口圆底烧瓶内装Zn粒,CrCl3和去氧水;4.聚四氟乙烯套管; 5.注射器连抽滤瓶分支处;6.抽滤瓶内装醋酸钠溶液图2 改进后制备[Cr(CH3COO)2]2·2H2O的装置示意图
(1)称取份量为2.5g的无水CH3COONa于右端的抽滤瓶中,加入6mL的去氧水配成CH3COONa溶液,如图2所示,用去掉针头的注射器(20mL)通过乳胶管连接抽滤瓶分支口,并用空心玻璃塞及时密封抽滤瓶。(2)准备好50mL烧杯,往里面加入30mL自来水,按图2所示的装置,连接于抽滤瓶左侧。在中间的三口圆底烧瓶中,加入3.0g的Zn粒和2.5 g的CrCl3·6H2O,并加入3mL的去氧水。充分摇动三口圆底烧瓶,得到混合物,其颜色呈现为深绿色。
(3)用去掉针头的注射器(10mL)吸入5mL不同浓度的盐酸溶液,按图2的装置图安装好,并检查该装置的气密性是否完好。
(4)夹住通往CH3COONa溶液的螺旋夹,而开启通往左边作水封处理的后烧杯的螺旋夹,缓慢地推动盛装好盐酸的10mL注射器,向三口圆底烧瓶中滴入盐酸。30min内保持匀速滴入5mL盐酸溶液。注意在此期间,不断地振摇反应仪器。双眼记得仔细观察里面的溶液颜色变化,在开始时溶液会逐渐变为蓝绿色,最后颜色加深变为亮蓝色。
(5)开启通往CH3COONa溶液的螺旋夹,而夹住通往作水封处理的后烧杯的螺旋夹。开始向外抽取抽滤瓶所连的20mL注射器,使三口烧瓶中反应生成的溶液(亮蓝色)快速地流入到盛装CH3COONa溶液的吸滤瓶中。这个过程非常迅速,一旦接触立即生成沉淀,颜色为砖红色,即醋酸亚铬沉淀。此时应摇动锥形瓶,充分地使反应物相互接触。
(6) 将混合液及时进行减压抽滤。依次用8mL去氧水、少量乙醚洗涤洗涤(分别三次)。所得产物,在室温下置于表面皿上干燥。使用台秤称量,并及时记录产品质量。保存产品,计算产率。
(7)重复上述实验,并将实验(3)所用5mL盐酸溶液依次替换为4mL浓盐酸与1mL去氧水混合、3mL浓盐酸与2mL去氧水混合、2mL浓盐酸与3mL去氧水混合、1mL浓盐酸与4mL去氧水混合。记录实验数据,并对比实验所得产率。
2 结果讨论
2.1 实验装置的改进
第一,将原实验反应生成Cr2+溶液的装置--抽滤瓶,将之改为三口圆底烧瓶。由于三口圆底烧瓶的底部空间较小,而抽滤瓶的底部空间较大,将Cr2+溶液压入到CH3COONa溶液里使之反应后,抽滤瓶中却还有大量的Cr2+溶液未能压到CH3COONa溶液中,导致大量的二价铬离子未能参与到反应中,两者进行对比,三口圆底烧瓶方便在实验中尽可能多的将含有Cr2+的溶液压入CH3COONa溶液中,从而保证了较少的残留量,减少原来造成的试剂浪费,使实验的产率得到一定幅度的提升。
第二,采用注射器滴加盐酸。注射器轻巧,密闭,有清晰的刻度标识,可以直接抽取相应体积的反应液,解决了由于较大体积的分液漏斗使底部装置易发生倾倒,旋转活塞易形成溶液渗漏等实验安全问题。
第三,巧用胶头滴管口的下端代替原来的玻璃导管口。在原有的装置中,仍旧存在二价铬离子溶液未被完全利用的问题。由于导管为玻璃材质,其下端开口过大,会导致实验后期不能将药品转移完全。Cr2+溶液从抽滤瓶中不能有效进入CH3COONa溶液中,造成产量偏低。改进后的装置中,在玻璃导管上用一截橡胶管套上一小段橡皮管连接去掉胶帽的胶头滴管的下端,能够行之有效地将含有Cr2+的溶液压入到盛装CH3COONa溶液的吸滤瓶中,从而提高了产品的产率。
第四,利用注射器替代氢气的压力。Cr2+容易被氧化成Cr3+,因此装置在改进后,需要添加一个聚四氟乙烯套管于右端的吸滤瓶上,可以有效地减少外界空气中的溶解氧溶于去氧水中,提高产品产率。但是,在实验过程中却出现这样一个问题,完全依靠反应产生的气体的气压将Cr2+溶液压入到盛装CH3COONa溶液的吸滤瓶中,盛装盐酸溶液的注射器容易向上崩出,增加了危险性。而在H2气压不够的情况下,容易出现二价铬离子溶液压不过去的情况。再者,由于其密闭环境,后期锥形瓶内由于产生压强增大,导致醋酸钠溶液倒吸大大减少产率。在改进后的装置中,将原实验的锥形瓶改为抽滤瓶,并在吸滤瓶分支处套上一支20mL的注射器,反应完全后将注射器向外抽气,能够将二价铬离子溶液完全抽入到抽滤瓶中。
如上所述,改进了实验装置后,既减少了实验危险性,还有效地提高了实验的成功率与产率。
2.3 原料用量的减少
按照原实验方案,对药品进行减半处理。在投加2.5 gCrCl3、2.5g无水CH3COONa情况下,记录数据发现,平均可得约1.0 g的产品。
在收集实验剩余锌粒的过程中,我们发现其剩余量较大。经过反复试验,并统计锌粒的残留量,可适量地将原来锌粒药品减半后的4g锌粒,改为加入3g锌粒反应。
2.2 盐酸浓度的改变
本实验需要添加盐酸,保证还原性气氛,但是浓盐酸具有强挥发性和酸性,过多时易对师生身体健康造成危害,并且对环境造成污染。因此,在不降低产率的前提下,减少盐酸的用量是实验改进需要探究的地方。将所用的盐酸溶液依次替换为4mL浓盐酸与1mL去氧水混合、3mL浓盐酸与2mL去氧水混合、2mL浓盐酸与3mL去氧水混合、1mL浓盐酸与4mL去氧水混合。所制得的粗产品[Cr(CH3COO)2]2·2H2O的实际产量分别为1.01g、1.31g、1.44g、1.50g、1.61g。
计算产率:产率=m产品/m理论×100%
(2)
查得六水合三氯化铬的物质的摩尔质量为266.44g·mol-1、[Cr(CH3COO)2]2·2H2O的摩尔质量为250.5g·mol-1。通过公式(2)[6],进行数据计算,得到的[Cr(CH3COO)2]2·2H2O产率依次为57%、74%、82%、85%、91%。如表1所示,发现在原料减半的情况下,逐步稀释浓盐酸后,采用相同的实验装置,产率能够逐步提升到90 %左右。经过反复试验发现如果所使用的浓盐酸含量低于1mL,则实验时间较长,且反应过程产物不完全变色。而浓盐酸为5mL(原实验投加量的1/2)时,能够产生大量氢气,但由于产品是易溶于盐酸的,在洗涤的时,易大量流失导致其产率较低[5]。通过反复试验,发现在1mL浓盐酸和4mL去氧水混合的盐酸溶液下,能够真正有效降低反应的剧烈程度,降低了实验危险性,此时反应的时长适当,并能得到较高产率。

表1 稀释浓盐酸后的实验结果对比
3 实验结论
针对原实验出现的问题,分别对实验装置、盐酸浓度、反应物用量做出了改进。与原来的实验装置相比,改进后的新实验装置具有下面的优点:
(1) 安全性: 实验用注射器替代分液漏斗滴加盐酸,增强了反应体系的密封性,提高了使用盐酸过程中的安全性。
(2) 确保成功率: 实验通过添加注射器,在H2气压不够的情况下,向外抽气,能够将二价铬离子溶液抽入到抽滤瓶中,使得此实验更容易成功,可以达到预期的实验效果和目的。
(3) 提高产率:用圆底烧瓶作为反应器,保证了较少的残留量,避免了反应物的损失,提高了产率使实验的产率得到一定幅度的提升。
(4) 经济性:通过探讨盐酸的用量,可以在原实验用量减半的情况下,保证产率,减少了实验开支。
绿色化改进后的实验方案不仅可以提高实验相对产率,实验现象明显,还可以提高实验成功率、绿色化与安全性,使实验操作简便,适合实验教学。

