miR-29b过表达对NIH/3T3细胞直接靶向作用及细胞功能的影响*
邓菊红 范翔雪 陶 然 宋启琴 孔红言 焦云桃 黄加权△
1.华中科技大学同济医学院附属梨园医院内科 (湖北 武汉, 430077 ) 2.华中科技大学同济医学院附属同济医院感染科
肝星状细胞(HSC)的持续激活是肝纤维化发生发展过程中的关键环节[1],在HSCs激活和肝纤维化过程中, 转化生长因子β1(TGF-β1)信号转导通路发挥重要作用[2]。microRNA29b(miR-29b)是新近发现的一类与纤维化疾病密切相关的小分子RNA家族成员之一。诸多研究发现miR-29b可通过直接抑制多种细胞外基质蛋白表达和调控多种信号通路参与纤维化过程[3,4]。在肝纤维化过程中,不仅miRNAs可作用于TGF-β1信号转导通路影响TGF-β1发挥作用,而且TGF-β1也能通过调节miRNAs的表达来行使功能。本研究旨在探讨miR-29b靶向调控COL1α1及COL3α1的表达及作用机制,为进一步探索其在肝纤维化中的作用提供实验依据。
1 材料与方法
1.1 主要材料 NIH/3T3细胞系(小鼠成纤维母细胞),购自武汉大学中国典型培养物保藏中心。重组人转化生长因子(TGF)-β1购自北京达科为生物技术有限公司;miR-29b mimics/miR-NC、miR-29b /U6扩增引物,均购自广州锐博生物科技有限公司;兔源性Collagen I/CollagenIII单克隆抗体、山羊抗兔荧光二抗、羊抗兔IgG,均购自武汉博士德生物工程有限公司;兔源性HSP47抗体、鼠源性α-SMA/TIMP-1/MMP-9抗体,均购自Santa Cruz Biotechnology公司;逆转录试剂盒、SYBR Green I Master mix,均购于日本ToYoBo公司;脂质体转染试剂盒(lipo 2000)购于美国Invitrogen公司;Cell Counting Kit-8(CCK-8)试剂盒购于日本同仁化学研究所;凋亡试剂盒购于南京凯基生物科技发展公司。
1.2 实验方法
1.2.1 双荧光素酶基因报告分析 培养共转染miR-29b mimic/miR-NC质粒的NIH/3T3细胞,用PBS洗两次,经裂解离心取上清后用双荧光素酶报告分析系统分析相对荧光素酶活性(萤火虫荧光素酶活性∶肾素荧光素酶活性)。
1.2.2 NIH/3T3细胞培养与转染 NIH/3T3细胞在含10%胎牛血清的DMEM培养基中进行培养,放置于37℃、5% CO2培养箱中生长至细胞融合度达80%~90%时进行细胞传代。转染前一天按2×105/ml将对数生长期细胞接种于6孔板内培养,细胞融合度80%~90%即可转染。将铺板细胞分为6组:空白对照(Control)组,miR-29b mimic组,miR-NC组,TGF-β1组,TGF-β1+miR-29b mimics组,TGF-β1+miR-NC组。按照lipo2000试剂盒说明书进行miR-29b mimic/miR-NC转染。其中Control 组细胞常规培养,TGF-β1组加入含10ng/L TGF-β1的DMEM培养基,TGF-β1+miR-29b mimics/ miR-NC组是在转染miR-29b mimics/ miR-NC后培养4~6h,然后换用含10ng/L TGF-β1的新鲜完全培养基,培养48h收集细胞。
1.2.3 荧光实时定量PCR检测转染效率及纤维化相关因子基因表达 参考TRIzol(Invitrogen公司)说明书抽提总RNA。①检测转染效率:以U6为内参基因,反应体系为:5μM miR-29b/U6上下游引物各0.8μl,模板2μl,SYBR Green I Master Mix 9μl,RNase-free Water加至20μl。实时定量PCR仪(美国Roche公司)程序设置:95℃ 20s,(95℃ 10s,60℃ 20s,70℃ 10s),共39个循环;行融解曲线分析,设定温度为70℃~95℃,升温速率为 0.4℃/次,恒温时间为 1 s/次。②检测相关纤维化指标:以GAPDH为内参,引物序列见表1,反应体系为:10μM上下游引物各0.4μl,模板1μl,SYBR Green I Master mix 10μl,RNase-free Water补充至20μl,程序设定为:95℃ 30s,(95℃ 5s,58℃ 5s,72℃ 15s),共40个循环,根据所获循环阈值(CT)分析基因相对表达水平。
1.2.4 Western-blot检测纤维化相关指标蛋白表达 蛋白抽提试剂提取各组细胞总蛋白,Bradford蛋白浓度测定试剂盒检测蛋白浓度,SDS-PAGE电泳分离蛋白,用PVDF膜转膜2h,BSA溶液封闭1h,加一抗4℃孵育过夜。次日 TBST洗膜后加二抗孵育慢摇1h,TBST洗膜20min×3次,采用ECL显色液和成像系统于暗室曝光,检测目的蛋白的表达情况。扫描图片,ImageJ分析软件将特异条带灰度值数据化。
1.2.5 免疫荧光染色检测纤维化相关蛋白表达 NIH/3T3细胞培养、铺板及转染miR-29b mimics/ miR-NC步骤同前,转染48h后PBS漂洗、甲醇固定15min,再用PBS清洗。BSA封闭液室温孵育30min后,分别滴加COL1α1抗体、COL3α1抗体、IgG,湿盒内4℃孵育过夜。次日PBS清洗,避光加入荧光二抗,37℃孵育40min后PBS清洗。DAPI染核,避光孵育15min,PBS清洗后荧光显微镜下观察拍照。
1.2.6 流式细胞术检测细胞凋亡 收集转染后48h各组细胞,用PBS清洗细胞两次(2000rpm离心5min),收集1~5 ×105细胞,加入500μl Binding Buffer悬浮细胞,加入5μl AnnexinⅤ-FITC混匀后,加入5μl Propidium Iodide混匀,室温避光反应5~15min;1h内用流式细胞仪检测,激发波长488nm,发射波长530nm。实验结果以百分率表示。
1.2.7 CCK-8法检测NIH/3T3细胞增殖活力 96孔板各孔中加入100μl细胞悬液,待细胞生长至60%~70%融合时转染,实验分组同上,分别于转染24h、48h、72h检测细胞增殖活力。吸出96孔板中的培养基,每孔加入100μl含10%CCK8的培养基,在培养箱中孵育0.5~1h,酶标仪测定450nm处的吸光度,细胞活力(%)=(A加药-A空白)/( A0加药-A空白)×100%,其中A加药为具有细胞、质粒和(或)TGF-β1的孔吸光度,A空白为没有细胞的孔吸光度,A0加药为仅有细胞而没有质粒和(或)TGF-β1的孔吸光度。
1.3 统计学方法 实验数据以Mean±SEM表示,应用GraphPad Prism 5.0进行统计学分析,两组间均数的比较采用Student-t检验,多组间均数比较采用单因素方差分析(One-WayANOVA)。P<0.05表示差异有统计学意义。
2 结果
2.1 miR-29b对COL1α1及COL3α1靶向调控作用验证 通过生物信息学分析发现miR-29b可与COL1α1及COL3α1 3′UTR互补结合。进一步通过双荧光素酶基因报告证实miR-29b可与COL1α1及COL3α1 3′UTR特异性结合,抑制其表达。
2.2 miR-29b转染效率 转染48h,靶基因miR-29b的相对表达量为(221.462±2.358),与miR-NC组、Control组比较均显著升高,差异具有统计学意义(P<0.001,见图1)。
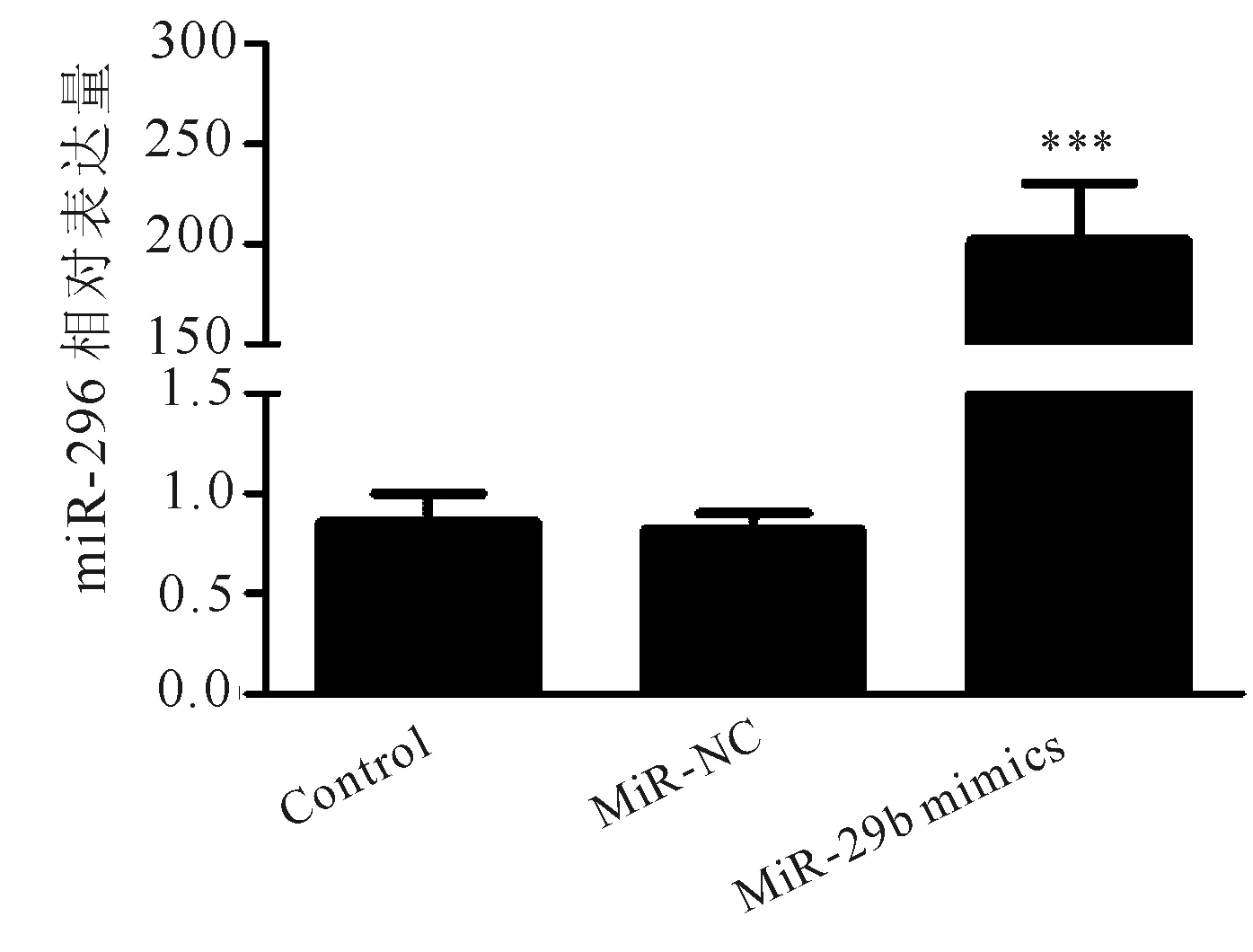
图1 转染48h后NHI/3T3细胞miR-29b表达情况
2.3 过表达miR-29b对NIH/3T3细胞胶原COL1α1、COL3α1 mRNA及蛋白表达的影响 转染48h后,与miR-NC组相比,miR-29b mimics组CollagenⅠ、Ⅲ表达显著减少(见插页图2),COL1α1 mRNA相对表达量(2.696±0.15)显著下调(图3A,P<0.01),COL3α1 mRNA相对表达量(1.884±0.064)亦显著下降(图3B,P<0.05);Western Blot检测示,与miR-NC组比较,miR-29b mimics组 Ⅰ 型和Ⅲ型前胶原蛋白表达均明显下调(0.42vs0.56, 0.17vs0.24,P﹤0.05,图3C)。
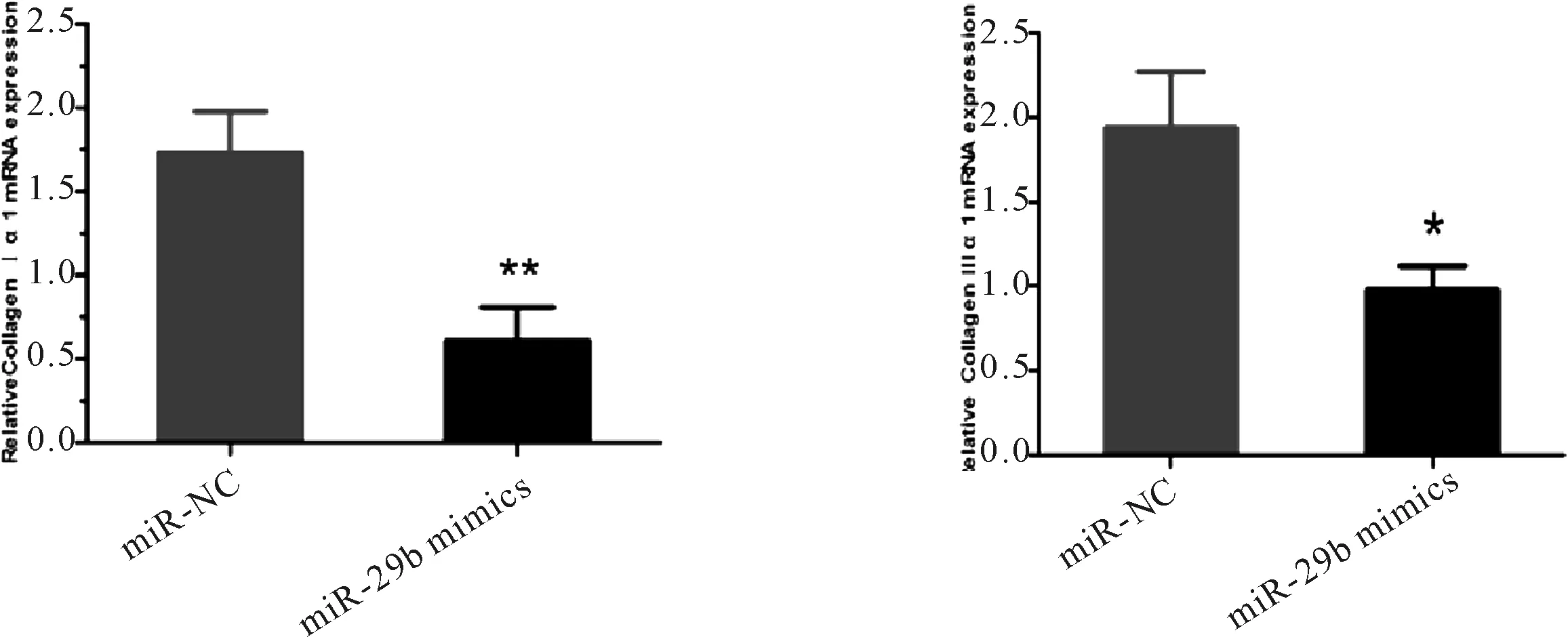
A.COL1α1 mRNA表达情况 B.COL3α1 mRNA表达情况

C.COLⅠ/Ⅲ蛋白表达情况
2.4 过表达miR-29b对TGF-β1致NIH/3T3细胞形态变化的影响 RT-PCR显示,miR-29b mimics转染NIH/3T3细胞4~6h后,再经TGF-β1 10ng/ml干预48h,与Control组、TGF-β1组及TGF-β1 +NC组相比,miR-29b表达显著上调(与Control组比较,P<0.05;与TGF-β1+miR-29b mimics比较,P<0.001;图4)。镜下观察,Control组细胞排列紧密,呈“星芒状”贴壁生长,胞内富含大量脂质小滴,TGF-β1作用后细胞内脂滴消失,体积逐渐变大变长,呈长梭形,排列紊乱,几乎无细胞脱落。miR-29b mimics作用48h后,细胞生长稀疏,体积逐渐变大变长,大量细胞脱落死亡(见插页图5)。

图4 不同处理条件下NIH/3T3细胞miR-29b相对表达量分析
2.5 过表达miR-29b下调TGF-β1对NIH/3T3细胞肝纤维化指标mRNA及蛋白表达的影响 RT-PCR结果显示,miR-29b mimics转染NIH/3T3细胞4~6h后再经TGF-β1 10ng/ml处理48h,与TGF-β1组和TGF-β1+NC组相比,COL1α1、 COL3α1、α-SMA、HSP47、TIMP-1 mRNA表达下调,而MMP-9 mRNA表达上调(与Control组相比,#P<0.05,##P<0.01;与TGF-β1组相比,*P<0.05,**P<0.01)(图6)。Western Blot结果与RT-PCR结果基本一致(图7)。

图6 不同处理条件下NIH/3T3细胞肝纤维化指标mRNA表达变化
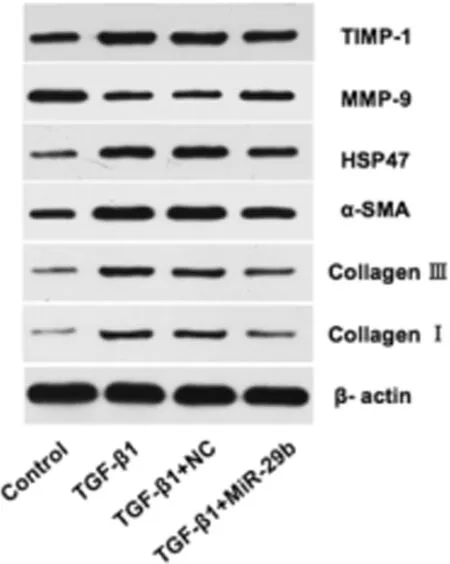

图7 不同处理条件下NIH/3T3细胞肝纤维化指标指标蛋白表达变化
2.6 过表达miR-29b对NIH/3T3细胞增殖的影响 CCK-8检测结果显示,TGF-β1组及TGF-β1+miR-NC组细胞增殖率逐渐上升,均高于TGF-β1+miR-29b mimics及Control组(P<0.05,见图8)。

图8 不同处理条件对NIH/3T3细胞增殖的影响
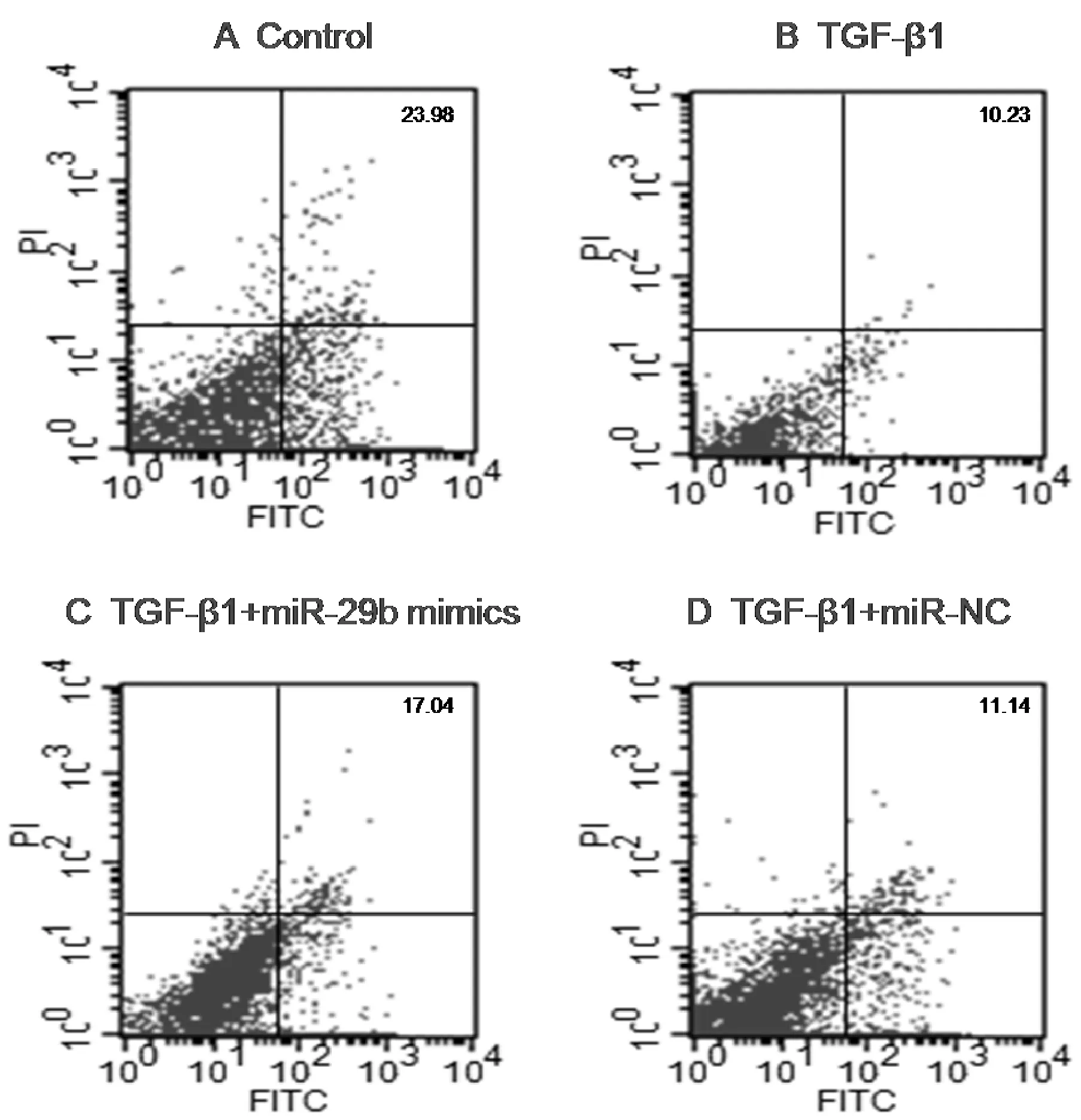
图9 不同处理条件对NIH/3T3细胞凋亡的影响
2.7 转染miR-29b mimics对NIH/3T3细胞凋亡的影响 流式细胞仪检测结果提示,与其它各组相比,TGF-β1+miR-29b mimics组细胞凋亡率显著升高,差异具有统计学意义(P<0.05),见图9。
3.讨论
HSC活化是肝纤维化发生的主要驱动因素,可以导致ECM的合成和降解失衡,引起ECM过度沉积,进一步向肝硬化发展[5],在此过程中伴随有microRNA的变化[6]。Roderburg等[7]发现在肝内多种细胞中,miR-29b在星状细胞中表达最高,是其在肝细胞、库弗氏细胞及内皮细胞中的100多倍。近期研究表明,miR-29b与纤维化疾病密切相关,miR-29b在各种纤维化疾病中表达都明显下调,其过表达可以抑制胶原蛋白及金属蛋白酶的表达[8,9],但miR-29b是否能对胶原纤维进行调控从而在纤维化疾病发病过程发挥重要作用尚不清楚。
生理状态下,NIH/3T3细胞表达一定量的miR-29b,我们发现,给予miR-29b mimics干预后,miR-29b表达显著上调,同时Ⅰ型和Ⅲ型胶原蛋白表达均明显降低。藉此本研究中的miR-29b mimics可以作为研究靶向上调miR-29b基因后观察该基因效应的目标分子。我们通过荧光双染色酶基因报告分析发现只有WT(野生型)COL1α1及COL3α1的3′UTR的启动子区域可以和miR-29b结合,证实了miR-29b可以对COL1α1及COL3α1 mRNA表达靶向调控。
多种细胞因子参与肝纤维化的发生发展过程,其中TGF-β1是最关键的致纤维化细胞因子。TGF-β1具有多种生物学功能,一方面参与调控细胞增殖、分化和细胞外基质形成,另一方面在生物体血管形成、免疫调节、组织修复、胚胎发育、肿瘤发生等生理病理过程中发挥重要作用[10,11]。TGF-β1不仅促进ECM基因激活转录并高表达,还通过抑制金属蛋白酶(MMP)和促进组织金属蛋白酶抑制剂(TIMP)减少异常合成的ECM降解,从而加重ECM在损伤组织、器官的沉积。我们以TGF-β1干预NIH/3T3细胞作为体外研究肝纤维化病变发生机制的细胞模型,研究发现过表达miR-29b对TGF-β1致NIH/3T3细胞COL1α1、COL3α1、α-SMA、TIMP-1、HSP47等表达升高有抑制作用,说明miR-29b可能不仅仅局限于通过调控胶原蛋白的表达而抑制纤维化,在肝纤维化过程中它可能有更广泛的抑制纤维化机制,研究以何种方式参与调节尚不清楚。
HSP47作为胶原的“分子伴侣”,能与多种类型胶原和前胶原特异性结合,参与前胶原在内质网中修饰、折叠、装配等整个加工过程,从而在肝纤维化进程中起重要作用[12]。本研究表明,miR-29b过表达可抑制TGF-β1所致HSP47表达下调,其具体机制尚需进一步的研究。Sekiya等[11]运用WST-1分析结果显示,miR-29b具有抑制HSC增殖及活性作用,此外,miR-29b可能调控HSC的数目。与此类似,我们的CCK-8细胞检测及Annexin-FITC细胞凋亡检测结果显示miR-29b显著影响NIH/3T3细胞的增殖及凋亡,转染miR-29b mimics抑制TGF-β1刺激NIH/3T3细胞的增殖及增加细胞凋亡。其具体调节机制尚需进一步研究。
我们认为miR-29b表达增高可以抑制肝脏纤维化,其抑制纤维化作用不仅与其调控胶原蛋白有关,而且还影响TIMP-1、MMP-9、HSP47,α-SMA的表达。此研究结果表明,在肝纤维化的发生、发展过程中,TGF-β1与miRNAs相互作用起到了重要作用。一方面有利于从更开阔的视野深入了解TGF-β1的作用机制;另一方面也为使用相应的miRNAs,增强或阻断TGF-β1信号通路转导,从而为探索肝脏纤维化发病机制和治疗提供新思路、新方法。

