NOD∕SCID免疫缺陷小鼠白血病模型的复制及其鉴定
叶振策,李 渊,韩艳君,周 玥,丁继超
(大理大学基础医学院,云南大理 671000)
急性髓系白血病(acute myeloid leukemia,AML)是一种造血系统恶性肿瘤性疾病。目前临床多采用药物化疗等方法对其进行治疗,已取得较好的效果,但难治和复发的情况仍未改善〔1-2〕,探究白血病药物靶向治疗的有效方法是白血病研究的关键点。本研究将CD34+CD38-LSCs移植入非肥胖型糖尿病∕重症联合免疫缺陷小鼠(NOD∕SCID小鼠)建立AML模型,旨在为治疗白血病提供新的思路和方法。
1 材料
1.1 动物雄性NOD∕SCID小鼠12只,6~8周龄,体质量25~30 g。购自北京维通利华实验动物技术有限公司,动物许可证号:SCXK(京)2010-0012。在符合SPF标准的层流室中饲养。
1.2 细胞株K562细胞株为云南省细胞生物学重点实验室馈赠。
1.3 药品与试剂环磷酰胺水合物试剂(Sigma公司);瑞氏染液试剂、台盼篮染色试剂(南京建成生物科技公司);Anti-CD34抗体、Anti-Alexa Fluor 647抗体(abcam公司);免疫荧光一、二抗稀释液(碧云天公司);山羊血清(上海生工公司);DAPI染色液、抗荧光淬灭剂(碧云天公司);PBS(杭州四季青公司);二甲苯、多聚甲醛、乙醇、Triton x-100(昆明科仪化玻有限公司)。
1.4 仪器超净工作台(苏州安泰空气技术有限公司);MC-6500血常规仪(库贝尔生物科技有限公司);倒置显微镜(日本OLYMPUS公司);二氧化碳培养箱(日本三洋公司);激光共聚焦荧光显微镜(德国Leica公司);移液器(德国Eppendorf公司);细胞计数板(上海涸宇机电科技有限公司);细胞培养瓶及细胞培养板(美国Costar公司);台式离心机(中国湘仪公司)。
2 方法
2.1 CD34+CD38-LSCs的分离纯化及鉴定
2.1.1 CD34+CD38-LSCs的分离纯化 运用免疫磁珠分选法(MACS)分选CD34+CD38-LSCs细胞,将K562细胞悬液与抗体为human anti-CD38-APC的免疫磁珠充分混匀,LD分选柱放置于磁场分离器中,将混合液滴加入分选柱中,流出的为CD38-细胞群,吸附于柱上的即为CD34+细胞群;按100 μL FcR blocking reagent:1×108个 CD38-细胞:100 μL CD34 microbeads:300 μL Buffer的比例充分混合均匀,迅速用活塞从分选柱中清洗出磁性标记细胞,洗下的细胞即为CD34+CD38-细胞群。
2.1.2 台盼蓝染色检测CD34+CD38-LSCs的活性取适量分选后的细胞悬液,滴加适量台盼蓝溶液,充分混匀后滴加至载玻片上,倒置显微镜选取多个视野进行观察和计数。
2.1.3 流式细胞术检测CD34+CD38-LSCs的纯度各取免疫磁珠分选前和分选后的细胞群1×106个,加入单克隆抗体human anti-CD34-FITC和human anti-CD38-APC,采用流式细胞术检测APC和FITC的荧光信号。细胞纯度(%)=(CD34+CD38-细胞数∕细胞总数)×100%。
2.2 实验分组将NOD∕SCID小鼠随机分为对照组、模型组,每组6只。细胞移植前2 d给予NOD∕SCID小鼠腹腔注射环磷酰胺2 mg∕(只·d),连续2 d;模型组:移植当天,在无菌条件下通过尾静脉移植CD34+CD38-LSCs,细胞量为2×107个∕只;对照组:移植当天,相同条件下尾静脉注入等量等时的无菌PBS。
2.3 小鼠的一般情况实验期间按照3次∕周的频率观察小鼠精神、食欲、活动能力、毛发状况、腹部肿块、体质量等情况,并做好记录。
2.4 外周血血常规检测第25天小鼠处死前,摘眼球取血,采血量1 mL∕只,EDTA-K2抗凝,全自动血常规检测仪检测外周血常规。
2.5 血涂片分析制备血涂片,瑞氏-吉姆萨染色,待干后即可镜检,中性树胶封固。
2.6 小鼠骨髓象分析无菌分离的小鼠双侧股骨和胫骨,用PBS冲洗骨髓腔至颜色发白。吹打至细胞悬液,离心机离心细胞悬液,PBS洗涤1次,制备细胞爬片。瑞氏-吉姆萨染色,待干后即可镜检,中性树胶封固。
2.7 肝脏病理学检测第25天处死小鼠后取新鲜肝脏,在多聚甲醛中固定,在按照设置好的乙醇浓度梯度中依次进行脱水,在二甲苯中进行透明,石蜡包埋组织块,冷冻切片后HE染色,乙醇脱水后二甲苯透明,晾干后即可镜检和封片。
2.8 免疫荧光染色鉴定肿瘤细胞来源在培养板中将已制备完成的细胞爬片用PBS浸洗3次,4%的多聚甲醛常温固定15 min,PBS浸洗后用0.5%的Triton x-100通透细胞15 min,滴加6%正常山羊血清室温封闭30 min,滴加荧光一抗Anti-CD34(稀释比例为1:500)湿盒中4℃孵育过夜,复温后滴加荧光二抗Anti-Alexa Fluor 647(稀释比例为1:800)湿盒中37℃孵育30 min;PBS浸洗后滴加DAPI避光孵育5 min对标本进行染核,PBS浸洗后用含抗荧光淬灭剂封片,激光扫描聚焦显微镜下观察采集图像。
2.9 统计学处理运用SPSS 17.0软件对数据进行统计学分析,采用析因设计、单因素方差分析方法,数据均以(±s)表示,P<0.05为差异有统计学意义。
3 结果
3.1 CD34+CD38-LSCs的纯度与活性流式细胞术测定结果显示,分选前细胞中CD34+CD38-LSCs细胞群百分比为(9.50±1.25)%,分离纯化后CD34+CD38-LSCs细胞群纯度可达(95.86±1.75)%。台盼蓝染色测定结果显示,分选后细胞活性为(94.35±2.25)%。提示通过MACS法分选得到的CD34+CD38-LSCs有较高的纯度和活性。见图1。
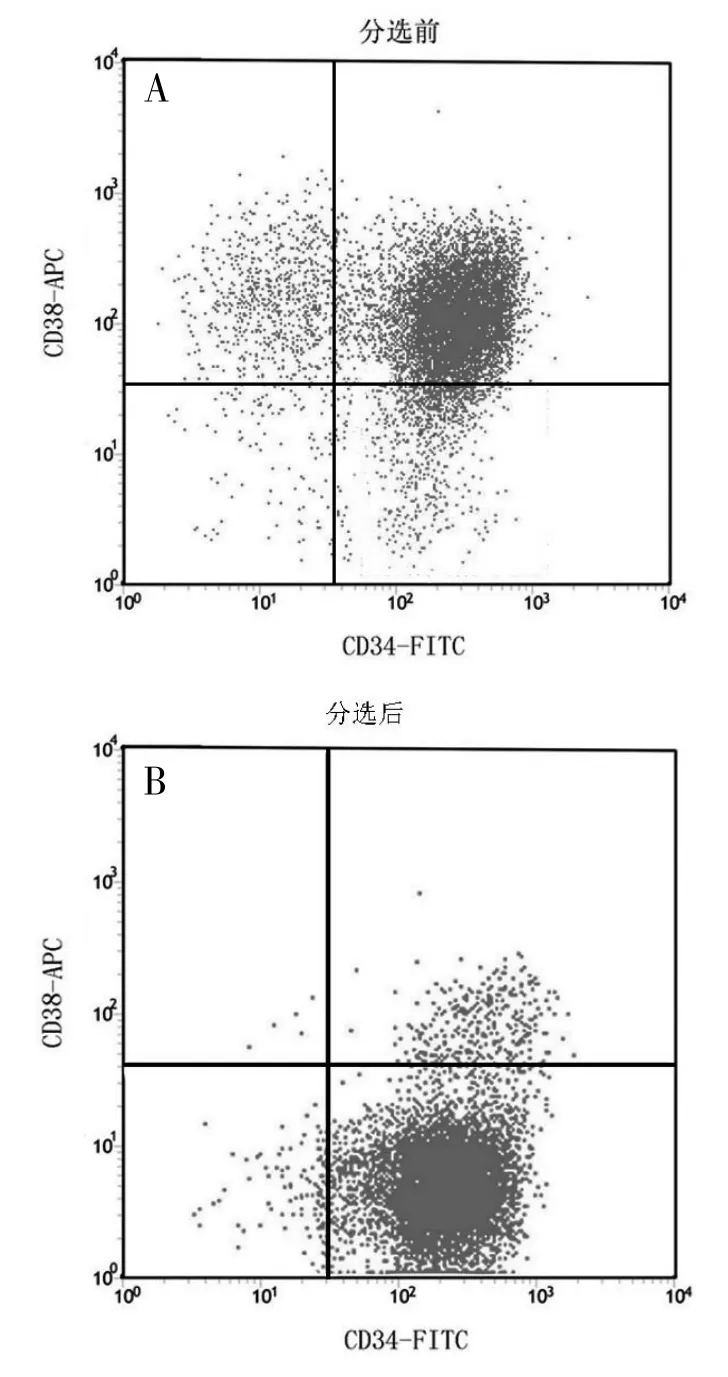
图1 分选前后CD34+CD38-LSCs细胞纯度
3.2 NOD∕SCID小鼠一般情况与对照组小鼠比较,模型组小鼠精神萎靡、步态不稳、皮毛粗糙杂乱,小鼠腹部肿块明显大于对照组,第25天的模型组小鼠平均体质量明显低于对照组,差异具有统计学意义(P<0.05);对照组小鼠表现正常。见表1。
3.3 小鼠外周血常规检测与对照组小鼠比较,模型组小鼠的外周血中白细胞数明显高于对照组,差异具有统计学意义(P<0.05),红细胞数、血红蛋白数、血小板数明显低于对照组,差异具有统计学意义(P<0.05);对照组小鼠的白细胞数、红细胞数、血红蛋白数、血小板数都处于正常范围之内。见表2。
表1 第25天小鼠平均体质量(±s,n=6)

表1 第25天小鼠平均体质量(±s,n=6)
注:与对照组相比,*P<0.05。
组别对照组模型组平均体质量∕g 28.49±0.73 23.29±2.63*
表2 各组小鼠外周血中白细胞、红细胞、血红蛋白、血小板计数(±s,n=6)

表2 各组小鼠外周血中白细胞、红细胞、血红蛋白、血小板计数(±s,n=6)
注:与对照组相比,*P<0.05。
组别对照组模型组白细胞数量∕(1×109个∕L)3.83±0.81 9.87±0.45*红细胞数量∕(1×1012个∕L)9.23±0.19 4.41±0.61*血红蛋白数量∕(g∕L)133.00±7.00 88.67±3.51*血小板数量∕(1×109个∕L)712.67±228.30 280.67±55.81*
3.4 小鼠血涂片分析瑞氏-吉姆萨血涂片结果显示,与对照组相比较,模型组小鼠血中白细胞比例明显增加。见图2。
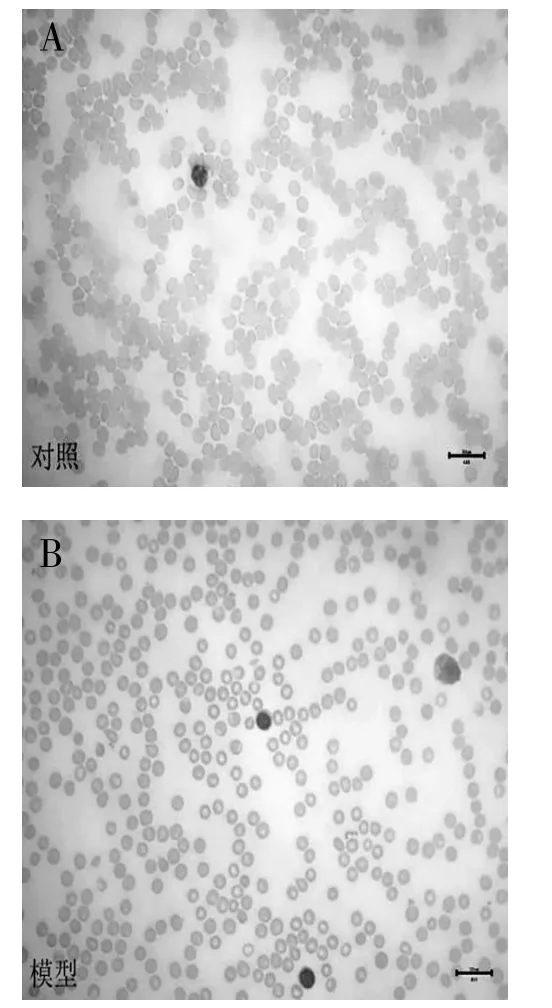
图2 小鼠血涂片染色(瑞氏-吉姆萨染色,400×)
3.5 小鼠骨髓象分析结果瑞氏-吉姆萨染色骨髓涂片结果显示,与对照组相比较,模型组小鼠骨髓增生活跃,可见大量白细胞浸润。见图3。
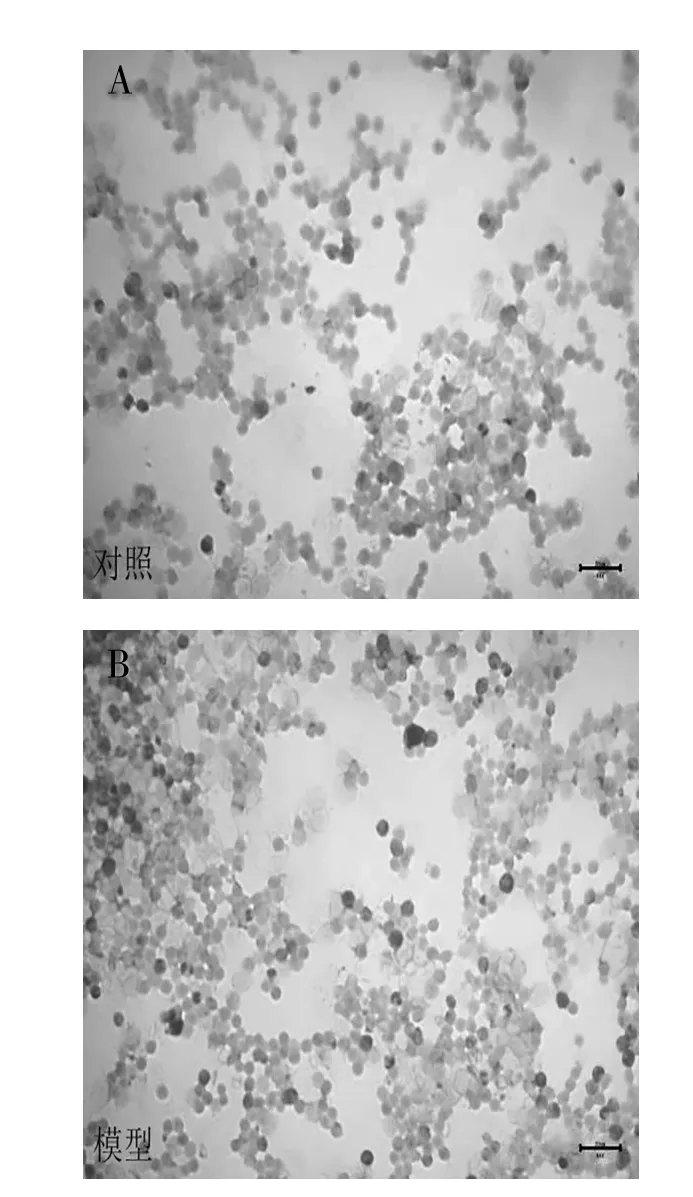
图3 小鼠骨髓涂片染色(瑞氏-吉姆萨染色,400×)
3.6 肝脏病理学检测与对照组相比,模型组小鼠的肝小叶完整结构被毁坏,肝脏组织中大量白细胞浸润,肝细胞出现水样变性(图4B中箭头指示)。见图4。
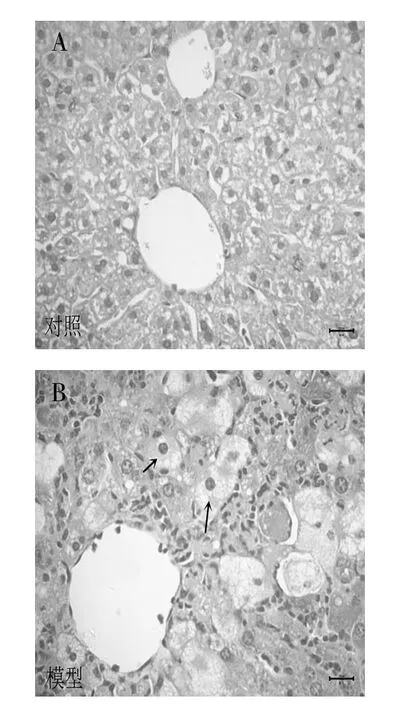
图4 肝脏病理学检测(HE染色,400×)
3.7 免疫荧光染色鉴定肿瘤细胞来源免疫荧光细胞化学检测结果显示,模型组骨髓细胞荧光明亮且清晰,出现明显阳性表达,提示模型组小鼠骨髓细胞中有大量人源白血病细胞。见图5。

图5 各组免疫荧光鉴定骨髓中白血病细胞(1600×)
4 讨论
白血病作为血液系统的恶性肿瘤,严重威胁着患者的健康。治疗白血病的方法主要有化学药物治疗、放射治疗、骨髓移植等。目前,化疗仍是白血病治疗的主要手段,随着靶向药物的不断开发,化疗治疗白血病虽然已经取得了巨大进展,但长期使用化疗药物会产生耐药性,此为白血病难治及复发的重要原因之一〔3〕。白血病的发病机制研究是白血病治疗研究的关键,白血病动物模型构建是白血病机制研究及治疗研究的前提基础,本实验通过尾静脉移植CD34+CD38-LSCs构建急性髓系白血病小鼠模型,为白血病靶向治疗药物的研究提供实验基础。
白血病在人体内的机制十分复杂,建立高效的白血病动物模型,不仅能够迅速地研究疾病的发生机制,同时可为相关疾病药物的开发提供理论和实验基础。有研究表明,将白血病细胞直接移植入小鼠体内可成功构建白血病小鼠模型。接种过HL-60细胞的NOD∕SCID小鼠在第5周后会出现全身白血病表现〔4-5〕;也有研究表明,从白血病患者的骨髓中分离纯化得到的CD34+CD38-LSCs,移植入小鼠体内可成功构建白血病模型〔6-8〕。相比而言,白血病干细胞因其不仅能够增殖分化,而且具有干细胞无限增殖的特点,移植入小鼠体内效果更好,更容易形成白血病。目前白血病研究应用的免疫缺陷小鼠主要有NOD∕SCID小鼠和重症联合免疫缺陷小鼠(SCID小鼠),其中NOD∕SCID小鼠相比SCID小鼠具有更高的移植效率,而且缺失T、B两种淋巴细胞,多种肿瘤细胞都可以植入,发生排斥反应的几率比较小,被广泛应用于人类白血病模型建立以及白血病靶向治疗药物研究中〔9〕。
本研究通过尾静脉移植CD34+CD38-LSCs来构建NOD∕SCID小鼠急性髓系白血病模型,细胞免疫荧光检测提示模型组小鼠的骨髓细胞中有大量人源白血病细胞。与对照组相比,模型组小鼠的一般情况发生变化:腹部肿块明显大于对照组,体质量明显低于对照组;血液系统发生变化:模型组小鼠的外周血中白细胞总数明显高于对照组;肝脏发生变化:模型组小鼠的肝小叶结构被破坏,肝细胞出现水样变性,肝脏组织中大量白细胞浸润。这些结果证明通过尾静脉移植CD34+CD38-LSCs可以成功复制急性髓系白血病小鼠模型,该模型的复制为白血病药物的开发提供了实验基础〔10-11〕。

