云南省红河州和德宏州吸毒人群中HIV-1/HCV共感染者HIV-1耐药性分析
王 雨,陈 鑫,叶 梅,熊思东,郑永唐
自1989年首次在云南省静脉吸毒人群中暴发HIV-1后,云南省成为了中国HIV-1感染最严重的省份之一[1]。至2016年底,云南省累计抗HIV-1治疗的患者超过8.5万例,其中90%接受治疗的感染者体内病毒得到了抑制。然而,随着抗反转录病毒药物的使用,耐药株流行比例逐渐增加[2]。最近有研究显示云南省红河州和德宏州未治疗人群耐药发生率分别为8.3%、12.0%[3-4],而这2个地区治疗失败者耐药发生率高达40%[5-6]。由于HIV-1/HCV共感染可能会影响HIV-1的治疗效果,而HIV-1 pol基因是抗反转录病毒药物作用的主要靶位,因此,我们基于pol序列对云南省红河州和德宏州吸毒人群中HIV-1/HCV共感染者HIV-1耐药情况进行分析,希望为该人群的抗病毒治疗提供一定的科学依据。
1 对象和方法
1.1 对象 选取2009—2010年间在中国云南省红河州社区、戒毒所、美沙酮治疗点和德宏州戒毒所、美沙酮治疗点吸毒人群中筛选获得的305例HIV-1/HCV共感染者。纳入标准:HIV-1/HCV共感染,有吸毒史,年龄>16岁,无其他基础性疾病。所有患者均签署知情同意书。
1.2 方法
1.2.1 资料收集 对参与者进行访谈式问卷调查。问卷调查的内容包括人口统计学基本信息(年龄、性别、民族、职业、文化程度及婚姻状况)、高危行为(吸毒时间、共用针具情况、性伴侣数及性病感染状况)和治疗相关信息(是否用药、开始治疗时间及用药方案)。
1.2.2 HIV-1 RNA提取 HIV-1 RNA使用罗氏公司的High Pure Viral RNA Kit试剂盒进行提取,所有操作均按说明书进行。
1.2.3 巢式PCR扩增pol基因区 使用北京宝日医生物技术有限公司的PrimeScript™ II 1st Strand cDNA Synthesis Kit试剂盒合成cDNA。使用北京全式金生物技术有限公司的TransTaq DNA Polymerase High Fidelity试剂盒进行巢式PCR。第1轮PCR扩增反应总体系25 μl,引物为MAW26和RT21[7]。第2轮PCR扩增反应总体系50 μl,引物为PRO-1和RT20[8]。扩增产物长度为1294 bp,包含蛋白酶全长[PR(1-99)密码子]区和部分反转录[RT(1-300密码子)]区。所有PCR均设置阴性对照,同时将本研究的序列与实验室以前获得的序列进行比对分析,以排除样品之间的交叉污染。
1.2.4 PCR扩增产物电泳鉴定和测序 使用1%琼脂糖凝胶电泳鉴定PCR产物,阳性样本送至北京擎科新业生物技术有限公司进行序列测定。测序采用正向引物PRO-1和反向引物RT20测通。
1.2.5 序列分析 使用BidEdit、Lasergene软件包中的SeqMan以及MEGA对序列进行整理、拼接与比对。所有序列使用HIV Databases中的Quality Control工具进行分析,对照测序峰图修正终止密码子和移码突变,以确保序列读码框的正确性,随后再使用美国耐药数据库(https://hivdb.stanford.edu/)在线分析病毒突变位点和耐药水平(敏感、潜在耐药、低度耐药、中度耐药、高度耐药),将低度及以上耐药记为耐药。
1.2.6 统计学处理 采用SPSS 24.0软件对数据进行统计分析,计量资料呈正态分布,用±s表示,组间比较采用t检验(组间方差齐)。计数资料采用χ2检验,以P<0.05为差异有统计学意义。
2 结 果
2.1 调查对象的人口统计学特征 在305例HIV-1/HCV共感染吸毒者中,有202例成功获得pol基因。其中,男性180例,女性22例,平均年龄(36.1±7.1)岁。汉族,未婚,无业,初中及以下文化者分别各占总吸毒人员的50%左右。接受药物治疗的有32例,未接受治疗的有81例,其余治疗信息未知的有89例。治疗组的平均年龄为(38.2±6.7)岁显著大于未治疗组的(35.3±6.2)岁(t=2.262,P=0.026)。
2.2 耐药发生率 在202例患者中,整体耐药发生率为15.3%(31/202),其中治疗组的耐药发生率为40.6%(13/32),未治疗组的耐药发生率为8.6%(7/81),治疗信息未知的耐药发生率为12.4%(11/89)。治疗组的耐药率显著高于未治疗组(χ2=16.108,P=0.000)。对治疗组与未治疗组的调查研究发现,小学文化水平的吸毒者的耐药发生率显著高于其他文化水平的吸毒者(χ2=8.847,P=0.031),而耐药发生率在不同居住地、性别、年龄、民族、婚姻状况、职业等方面差异无统计学意义(P均>0.05)。见表1。
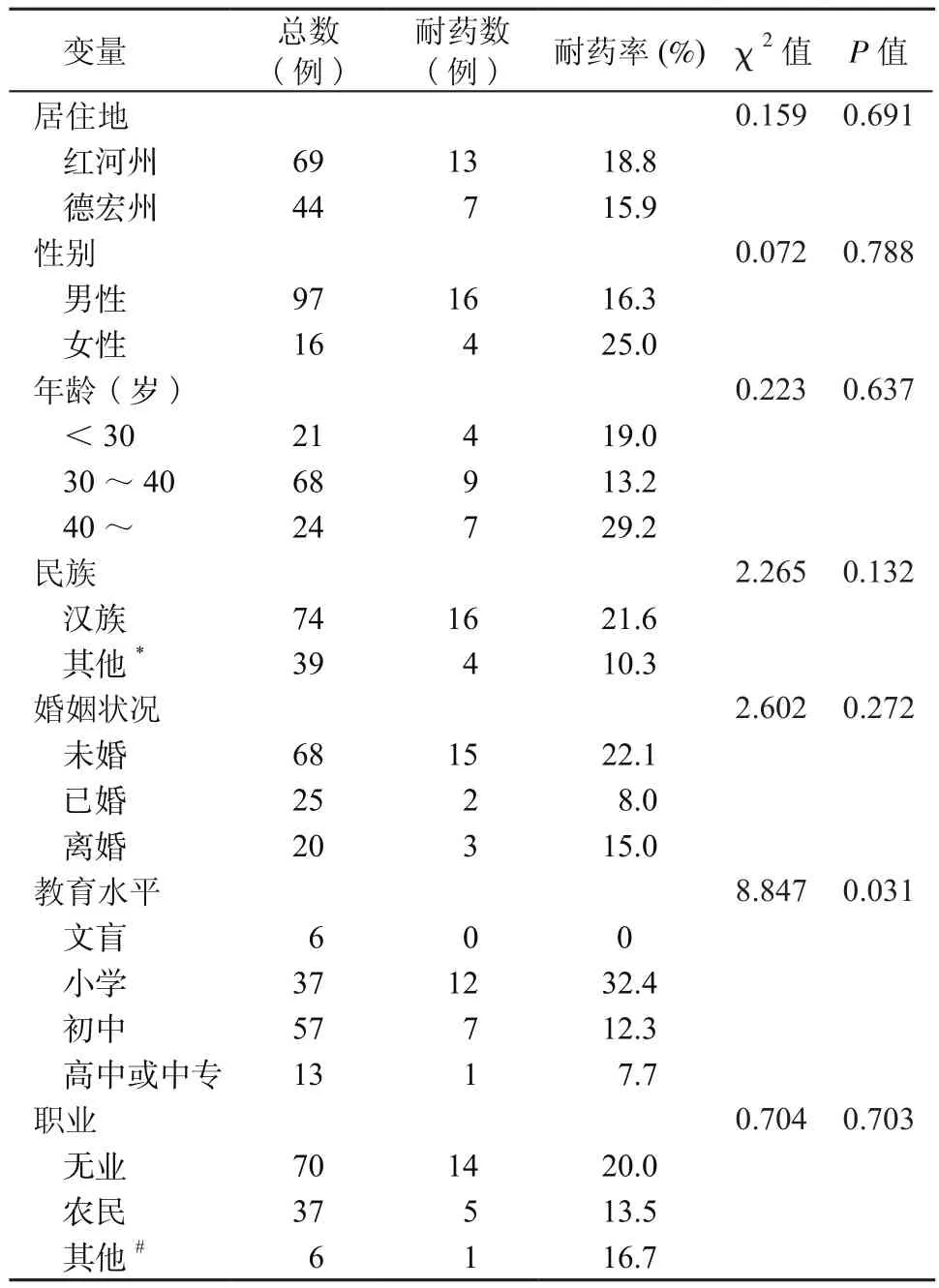
表1 云南省红河州和德宏州HIV-1/HCV共感染吸毒人群HIV-1耐药性特征Table 1 HIV-1 drug resistance characteristics among HIV-1/HCV co-infected drug users in Honghe and Dehong Prefectures of Yunnan Province
2.3 耐药位点 治疗组有13例出现耐药相关的突变位点,其中有4例出现多重耐药突变位点;未治疗组有7例出现耐药相关的突变位点,其中1例出现多重耐药突变位点。与核苷类反转录酶抑 制 剂(nucleoside reverse transcriptase inhibitor,NRTIs)相关的耐药突变位点有K65R、T69D、M184V等。与非核苷类反转录酶抑制剂(non-nucleoside reverse transcriptase inhibitor, NNRTIs)相关的突变位点有K103N、E138A、V179D/E、Y181C、G190A、K283N。与蛋白酶抑制剂(protease inhibitor, PIs)相关的突变位点有G48V等。与未治疗组相比,治疗组中出现的与PIs、NRTIs和NNRTIs相关的耐药突变位点差异无统计学意义(P均>0.05)。见表2。
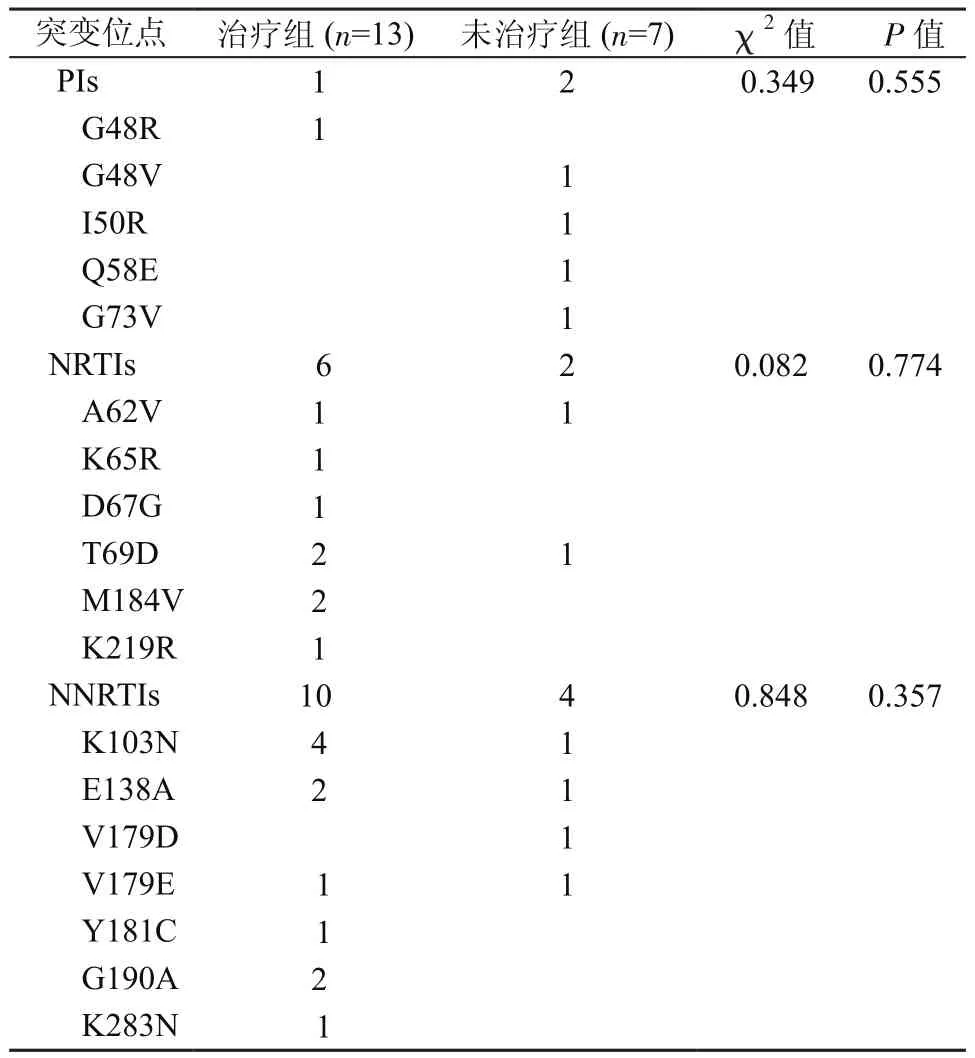
表2 云南省红河州和德宏州HIV-1/HCV共感染吸毒者HIV-1耐药突变位点汇总Table 2 Drug-resistance mutations among HIV-1/HCV co-infected drug users in Honghe and Dehong Prefectures of Yunnan Province
2.4 抗病毒药物耐药情况 治疗组对NRTIs的耐药例数为6例,耐药发生率为18.8%(6/32)。其中仅对NRTIs的耐药例数为3例,耐药率为9.4%(3/32);有3例同时对NRTIs和NNRTIs产生耐药。治疗组对NNRTIs的耐药例数为10例,耐药率为31.3%(10/32)。其中仅对NNRTIs的耐药例数为7例,耐药率为21.9%(7/32);有3例同时对NRTIs和NNRTIs产生耐药,耐药率为9.4%(3/32)。治疗组未对PIs产生耐药。未治疗组对NRTIs的耐药例数为1例,耐药率为1.2%(1/81);对NNRTIs的耐药例数为4例,耐药率为4.9%(4/81)。未治疗组有2例对PIs产生耐药。治疗组主要对奈韦拉平、依非韦伦、拉米夫定、司他夫定和恩曲他滨高度耐药,而未治疗组仅个别对沙奎那韦、依曲韦林和利匹韦林高度耐药。见表3。
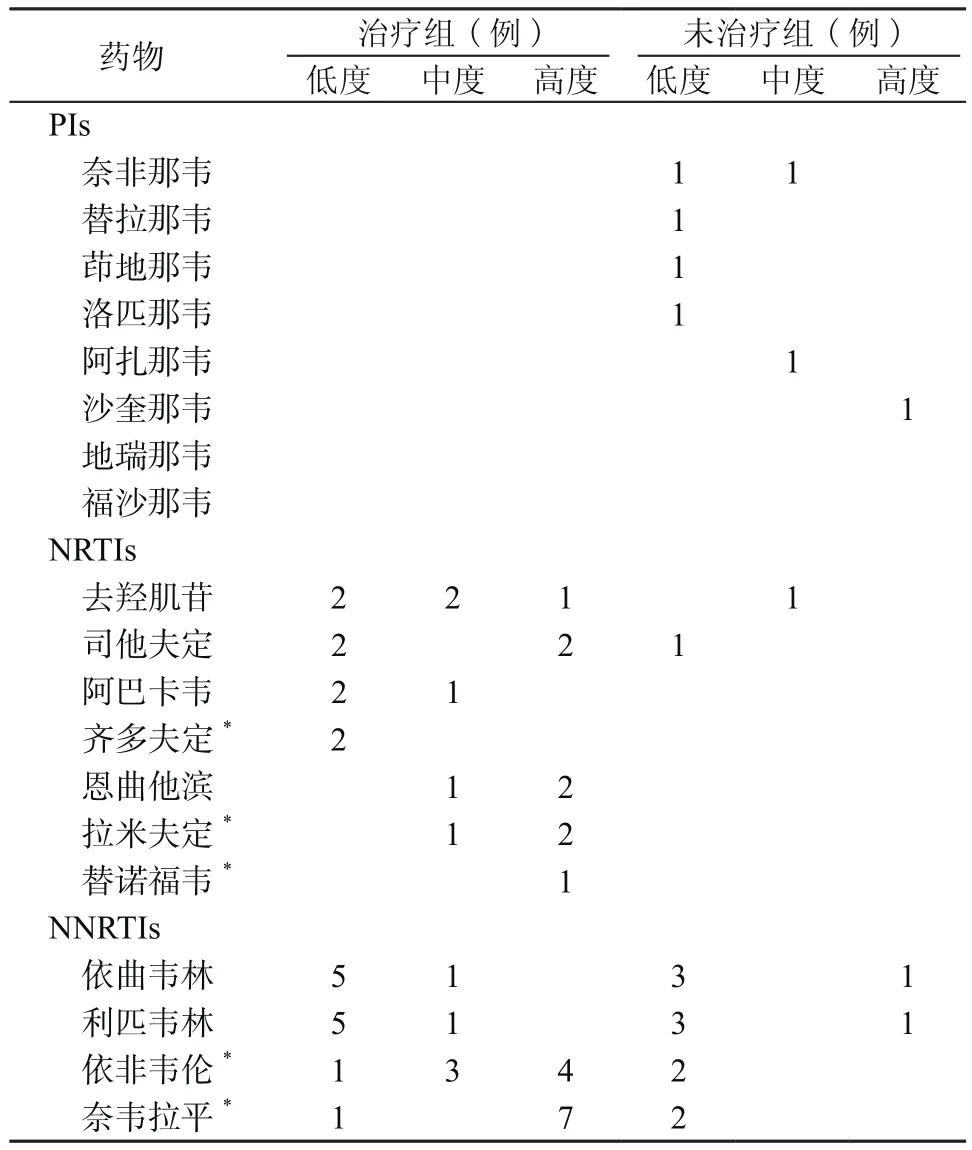
表3 云南省红河州和德宏州HIV-1/HCV共感染吸毒者抗病毒药物耐药程度Table 3 The level of drug resistance among HIV-1/HCV co-infected drug users in Honghe and Dehong Prefectures of Yunnan Province
3 讨 论
云南省东南部的红河州和西部的德宏州是AIDS高流行地区,吸毒是该地区HIV-1的主要传播途径,且吸毒人群存在较多HIV-1/HCV共感染者,了解其HIV-1耐药情况有助于制定AIDS治疗策略。本研究对吸毒人群中HIV-1/HCV共感染者中HIV-1耐药性进行比较分析,发现整体耐药率为15.3%,其中未治疗组的耐药率为8.6%,治疗组的耐药率为40.6%。未治疗组的耐药发生率高于Chen等[9]报道的4.3%,但与其文中静脉吸毒人群的耐药率10.6%相近,原因可能是静脉吸毒人群的共用针具等高危行为更容易促使耐药株扩散至未治疗人群[8]。治疗组的耐药率与Li等[10]报道的治疗失败人群耐药率相接近。吴新华等[11]研究发现吸毒人群更容易发生不规范服药,而不规范服药是导致耐药的主要因素。此外,由于治疗组的治疗时间超过1年,此时仍能从血浆中扩增病毒序列,表明治疗组的病毒载量较高。因此,本研究治疗组的耐药率接近治疗失败人群的耐药率。提示本研究的结果可能反映了红河州和德宏州吸毒人群的耐药情况。即HIV-1/HCV共感染者HIV-1耐药率处于较高水平。李重熙和Rocheleau等[12-13]比较HIV-1/HCV共感染者和HIV-1单感染者耐药发生率,均发现2者之间差异并无统计学意义(P均>0.05),故纳入本研究的均为HIV-1/HCV共感染的吸毒人群。
云南省主要HIV-1流行株的耐药突变位点有D30N、L33F、D67N、K103N、Y181C、M184V、G190A、M46I/V[14-16]。本研究发现的耐药突变位点有G48V/R、K65R、T69D、K103N、E138A、V179D/E、Y181C、M184V、G190A、K283N,与云南省的耐药突变位点大体一致。值得注意的是,本研究在未治疗组发现有1例特殊的突变位点G48V,它导致目前临床应用的多种PIs(阿扎那韦、奈非那韦、沙奎那韦)的敏感性下降30~60倍[17],该耐药突变位点为云南省首次报道。
目前,中国AIDS抗病毒一线治疗方案是2种NRTIs和1种NNRTIs的共同使用:替诺福韦/齐多夫定+拉米夫定+依非韦伦/奈韦拉平。本研究结果表明,未治疗组仅对依非韦伦和奈韦拉平低度耐药,对一线治疗方案中的其他药物均不耐药;而治疗组由于较长时间使用反转录酶抑制剂(包含NRTIs和NNRTIs),所以对一线用药均出现耐药,但未对二线用药中的蛋白酶抑制剂克力芝(洛匹那韦+利托那韦)耐药。因此,在该地区对吸毒人群中HIV-1/HCV共感染者进行现行治疗方案应该仍是有效的。
研究发现治疗组有10例(76.9%)对NNRTIs产生耐药,其中50%以上对依非韦伦、奈韦拉平高度耐药。同时还出现了对NRTIs和NNRTIs合并耐药的情况。如果该人群继续使用一线用药,会由于耐药而导致药物的病毒学治疗失败。因此,对于一线抗病毒治疗失败者应迅速进入二线治疗,以获得更好的治疗效果。
由于本研究的参与者均招募于戒毒所、社区或者美沙酮治疗点等,故易导致用药方案的缺失,无法对具体药物与耐药情况进行关联分析。同时,由于并发症、不良反应、病情严重程度等临床数据的缺失,也无法对耐药与临床表现之间的关系进行更深入的分析,存在一定的局限性。另外,本研究进行的是横断面调查,不能对研究对象治疗前与治疗后的耐药情况进行比较分析,无法区
分治疗组部分人群的耐药是由于原发耐药导致的,还是由于药物治疗筛选出来的。尽管如此,本研究还是能相对客观地展现出云南省红河州和德宏州吸毒人群中HIV-1/HCV共感染者HIV-1耐药水平,为该人群的抗病毒治疗提供一定的理论指导。

