干扰素注射液联合四季抗病毒合剂对手足口病的疗效观察
林瑞钰
流行病学研究显示近年来我国手足口病的发病率呈上升趋势,近3年来的发病率已达223/1万~394/1万人左右[1]。临床上手足口病的发生可导致患者皮肤黏膜、心肌细胞的损伤,增加肝肾功能异常的风险[2]。重症手足口病甚至可导致患者神经系统的损害甚至死亡。
常规的抗病毒治疗能够在改善患者的临床结局方面发挥重要的作用,干扰素等药物能够通过抑制柯萨奇病毒等的扩增和复制,改善患者的皮肤黏膜损害性表现,抑制病情进展[3-4]。但长期的临床随访研究发现,单纯重组人干扰素等药物治疗后患者的病情缓解率仍然较低,治疗后患者的心功能损伤表现仍然较为明显[5]。中医药在辅助治疗感染性疾病的过程中发挥了重要的作用,中医学认为手足口病属于“时疫”“温病”的范畴,四季抗病毒合剂具有“清热解毒,消炎退热”的作用,能够显著改善患者的上呼吸道症状[6-7]。本研究收集了2015年2月—2018年2月我院收治的手足口病患儿78例,探讨四季抗病毒合剂在辅助治疗手足口病中的作用,报道如下。
1 对象与方法
1.1 对象 选取2015年2月—2018年2月绵阳市第三人民医院游仙分院收治的手足口病患儿78例,根据治疗方法不同分为对照组和观察组。对照组39例,其中男22例,女17例;年龄1~6岁,平均(4.26±1.23)岁;病程3~7 d,平均(4.57±0.54)d。观察组39例,其中男20例,女19例;年龄1~6岁,平均(4.24±1.18)岁;病程3~7 d,平均(4.61±0.51)d。纳入标准:①符合中华医学会制定的相关诊断标准;②临床检测血清肠道病毒(enterovirus, EV)71抗体阳性(抗体滴度升高4倍以上);③均有发热、手足皮疹、口腔疱疹及肛周臀部散在皮疹。排除标准:①合并重症肺炎、肺出血、脑炎、心肌炎者;②重症及危重症手足口病患儿;③伴有精神疾病,严重肝、肾功能障碍者;④对本研究治疗药物存在过敏反应的患儿。2组手足口病患儿一般资料比较,具有均衡性(P>0.05)。
1.2 治疗方法 对照组采用重组人干扰素-α1b注射液(北京三元基因药业股份有限公司),10 μg/d,1次/d,肌肉注射,连续治疗3~5 d;观察组在采用重组人干扰素-α1b注射液的基础上,联合四季抗病毒合剂(陕西海天制药有限公司),小儿2~5岁, 5 ml/次;5~7岁,5~10 ml/次,均为3次/d,口服,连续治疗3~5 d。
1.3 检测方法 在患儿治疗前和结束后的48 h内采集其空腹静脉血,分离血清后,-20 ℃保存待测,采集标本后1周内检测CRP、降钙素原(procalcitonin, PCT)、 干 扰 素 -γ、TNF-α, 相关指标测定采用电化学发光法(美国雅培i2000全自动化学发光免疫分析仪);去甲肾上腺素(norepinephrine, NE)、促肾上腺皮质激素(adrenocorticotropic hormone, ACTH)、D-二聚体(D-Dime, D-D)、乳酸的检测采用全自动生化法;EV71抗体的检测采用酶联免疫吸附法检测,具体检测方法参照试剂盒说明书,试剂盒内配有质控血清或质控标准品。
1.4 观察指标 观察2组患儿的疗效、退热时间、皮疹消退时间、口腔疱疹愈合时间、正常饮食时间、血清EV71抗体转阴时间。检测2组患儿治疗前后血清炎症因子、NE、ACTH、D-D、乳酸水平变化情况。
临床疗效标准,①显效:治疗5~7 d,体温恢复正常,皮疹消退、口腔疱疹、溃疡消失或愈合;②有效:治疗7~10 d,上述临床症状基本消失,溃疡消失或愈合;③无效:治疗>10 d,临床症状、体征无改善或加重。
1.5 统计学处理 数据统计分析采用 SPSS 19.0软件,计量资料采用±s进行描述,组间比较采用独立样本t检验,计数资料采用例数进行描述,组间比较采用χ2检验,P<0.05表示差异具有统计学意义。
2 结 果
2.1 2组患儿治疗后临床效果比较 观察组患儿治疗的总有效率为94.87%,对照组为79.49%,差异有统计学意义(P<0.05)。见表1。
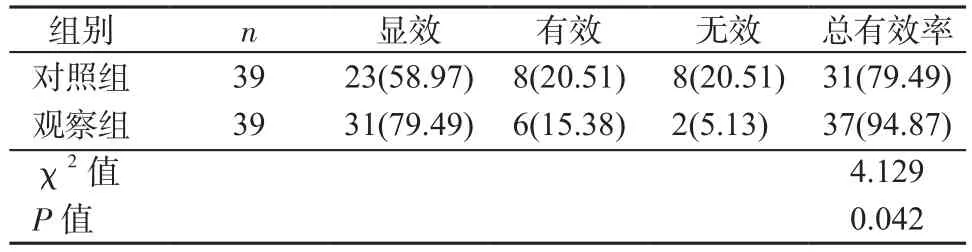
表1 2组患儿治疗后临床效果比较[例(%)]Table 1 Comparison of clinical effects between 2 groups after treatment[cases (%)]
2.2 2组患儿症状改善时间、血清EV71抗体转阴时间比较 观察组患儿退热时间、皮疹消退时间、口腔疱疹愈合时间、正常饮食时间及血清EV71抗体转阴时间均短于对照组,差异有统计学意义(P均<0.05)。见表2。
2.3 2组患儿治疗前后NE、ACTH、D-D、乳酸差值水平变化情况 经治疗,观察组患儿NE、ACTH、D-D、乳酸治疗前后差值水平高于对照组,差异有统计学意义(P均<0.05)。见表3。
2.4 2组患儿治疗前后血清炎症因子差值水平变化情况 经治疗,观察组患儿CRP、PCT、TNF-α治疗前后差值水平均高于对照组(P<0.05),但2组干扰素-γ差值水平比较,差异无统计学意义(P均>0.05)。见表4。
3 讨 论
在合并有体液免疫功能障碍的患儿中,手足口病具有较高的发生率,特别是在年龄<3岁的儿童中,手足口病的发生率维持在较高水平。病毒感染过程中释放的致病颗粒能够诱导感染者口腔、四肢及肺部等组织的自身免疫性损伤,导致T淋巴细胞功能紊乱,加剧皮肤黏膜组织的损害[8-9]。重组人干扰素能够通过抑制病毒颗粒的复制,进而改善患者病毒感染性症状,降低器官损害和并发症的发生率[10-11]。但一项囊括了727例样本量的手足口病的临床诊疗分析可见,重组人干扰素治疗后患儿病情的缓解程度<36%,且治疗后肝功能损伤的发生率>5%[12]。
中医理论认为手足口病属于口腔肺部瘀毒血滞型疾病,气血内滞于口腔及鼻部难以外宣,筋络不通、筋脉失养、肺部炙热难泄。四季抗病毒合剂中含有的鱼腥草、桔梗、桑叶、连翘等有效活性成分,具有解表散寒、驱瘀化湿的功效,能够补气益血、理气宽中,使得气血运行通畅,进而缓解患者的疼痛感。同时四季抗病毒合剂中含有的薄荷、紫苏叶、苦杏仁、芦根等,能够“清热利湿、解毒消肿、清热生津”,进而改善患者的皮肤黏膜损害表现[13]。有研究者报道了四季抗病毒合剂治疗手足口病后患者的病情改善效果,认为四季抗病毒合剂能够改善患者的皮肤黏膜疱疹症状,降低神经系统及循环系统受累的风险[14],但目前尚缺乏对于炎症因子如CRP、PCT、干扰素-γ、TNF-α等的分析研究。
本次研究中观察组患儿采用干扰素联合四季抗病毒合剂治疗后,其临床总体有效率明显高于单纯干扰素抗病毒治疗组,且差异较为明显,提示了四季抗病毒合剂辅助治疗手足口病的临床价值。观察组治疗后的病情缓解率较高,考虑可能与干扰素抗病毒联合四季抗病毒治疗的周期较长或者药物剂量较足有关。通过荟萃国内外的相关文献,我们认为四季抗病毒合剂对于手足口病的临床治疗价值的体现,主要考虑与下列因素有关[14]:①四季抗病毒合剂中含有的多种有效生物活性成分,具有发挥“清热解毒,凉血降热”的作用,能够减轻患者口腔及鼻黏膜的损伤;②四季抗病毒合剂中含有的桔梗、桑叶在发挥“宣散风热”的同时,能够发挥抗病毒的作用。曾伟红等[15]发现,四季抗病毒合剂治疗后,患者的皮肤病理损伤程度评分可平均下降20%以上,同时治疗后患者的脑膜炎或者心肌炎的发生率均可显著的下降。治疗后观察组患者的退热时间、皮疹消退时间、口腔疱疹愈合时间、正常饮食时间及血清EV71抗体转阴时间均短于对照组,提示四季抗病毒合剂不仅具有改善患者临床症状的作用,同时能够显著促进体内病毒抗体的转阴,这主要由于四季抗病毒合剂能够提高机体的细胞免疫功能,促进T淋巴细胞对于EV71的吞噬能力,促进了抗体的转阴。但也有些研究者并未发现四季抗病毒合剂治疗对于患者体内EV71抗体的转阴作用,存在相关差异主要与四季抗病毒合剂的治疗负荷剂量、治疗时间等因素有关。NE、ACTH、D-D及乳酸等是评估患者体内应激或者代谢相关性的指标,治疗后的观察组患者的NE、ACTH、D-D、乳酸均明显下降,提示了四季抗病毒合剂对于患者内环境的稳定作用,这主要由于四季抗病毒合剂能够抑制过度激活的肾上腺素系统,降低组织细胞的过度代谢导致的乳酸堆积。CRP、PCT、干扰素-γ、TNF-α是评估患者体内炎症反应的重要指标,治疗后的观察组患者的CRP、PCT、TNF-α下降程度明显高于对照组,差异较为明显,提示了四季抗病毒合剂对于体内炎症反应的抑制作用。
本次研究探讨了四季抗病毒合剂治疗后患儿体内 CRP、PCT、干扰素 -γ、TNF-α等因子的改变情况。干扰素注射液联合口服四季抗病毒合剂治疗手足口病疗效显著,可降低患儿血清炎症因子、NE、ACTH水平,促进病情的恢复。
表2 2组症状改善时间、血清EV71抗体转阴时间比较(±s,d)Table 2 Comparison of symptom improvement time and serum EV71 antibody negative time in 2 groups (±s, d)
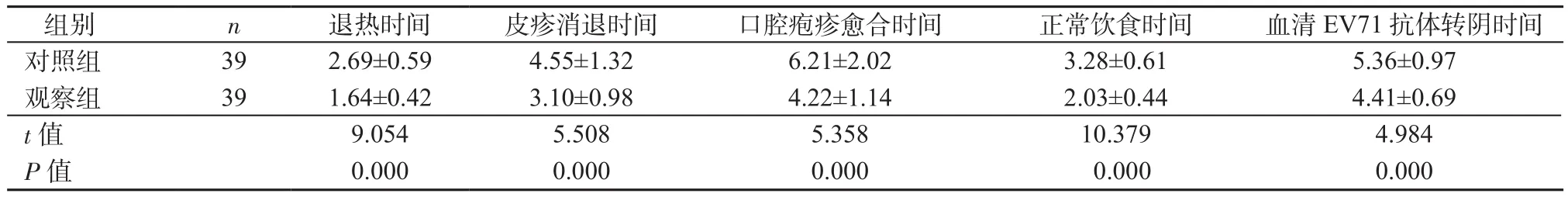
表2 2组症状改善时间、血清EV71抗体转阴时间比较(±s,d)Table 2 Comparison of symptom improvement time and serum EV71 antibody negative time in 2 groups (±s, d)
组别 n 退热时间 皮疹消退时间 口腔疱疹愈合时间 正常饮食时间 血清EV71抗体转阴时间 对照组 39 2.69±0.59 4.55±1.32 6.21±2.02 3.28±0.61 5.36±0.97 观察组 39 1.64±0.42 3.10±0.98 4.22±1.14 2.03±0.44 4.41±0.69 t值 9.054 5.508 5.358 10.379 4.984 P值 0.000 0.000 0.000 0.000 0.000
表3 2组治疗前后NE、ACTH、D-D、乳酸差值水平变化情况(±s)Table 3 Differences of NE, ACTH, D-D, lactic acid levels in 2 groups before and after treatment (±s)

表3 2组治疗前后NE、ACTH、D-D、乳酸差值水平变化情况(±s)Table 3 Differences of NE, ACTH, D-D, lactic acid levels in 2 groups before and after treatment (±s)
组别 NE(ng/L) ACTH(ng/L)D-D(ng/ml) 乳酸 (mmol/L) 对照组 13.99±2.56 3.3±0.87 61.56±5.88 6.57±1.26 观察组 30.19±3.47 9.45±1.53 103.21±9.75 7.87±1.34 t值 23.461 21.821 22.845 4.414 P值 0.000 0.000 0.000 0.000
表4 2组治疗前后血清炎症因子差值水平变化情况(±s)Table 4 Differences of serum inflammatory factors in 2 groups before and after treatment (±s)
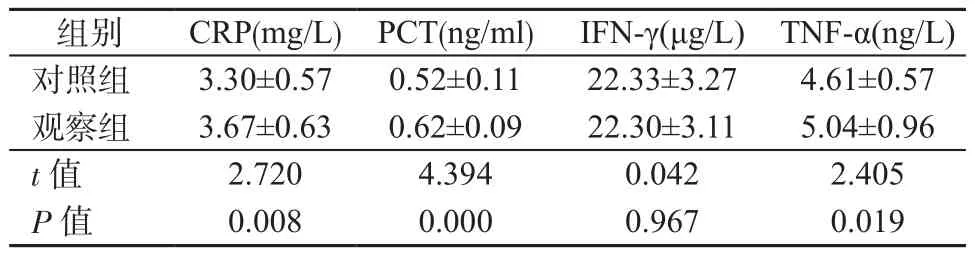
表4 2组治疗前后血清炎症因子差值水平变化情况(±s)Table 4 Differences of serum inflammatory factors in 2 groups before and after treatment (±s)
组别 CRP(mg/L)PCT(ng/ml) IFN-γ(μg/L) TNF-α(ng/L) 对照组 3.30±0.57 0.52±0.11 22.33±3.27 4.61±0.57 观察组 3.67±0.63 0.62±0.09 22.30±3.11 5.04±0.96 t值 2.720 4.394 0.042 2.405 P值 0.008 0.000 0.967 0.019

